2023化学苏教版选择性必修一 2.1.2 影响化学反应速率的因素 课件(共43张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 2.1.2 影响化学反应速率的因素 课件(共43张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 746.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 21:32:01 | ||
图片预览










文档简介
(共43张PPT)
第2课时
影响化学反应速率的因素
专题2 化学反应速率与化学平衡
第一单元 化学反应速率
学习目标
1. 理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。
2. 了解催化剂在生产、生活和科学研究领域中的重大作用。
3. 知道活化能的含义及其对化学反应速率的影响。
4. 了解通过改变外界条件改变化学反应速率的方法和意义。
知识回顾
(1)化学反应速率是用来衡量化学反应的快慢的尺度,它与时间和浓度变化有关。
(2)在同一反应中用不同物质来表示时,其数值可以不同,但都表示同一个反应的速率。因此,表示化学反应的速率时,必须说明反应物中哪种物质做标准。不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比。
(3)一般来说,化学反应速率随反应的进行而逐渐减
慢。因此,某一段时间内的反应速率,是平均速率,
而不是指瞬时速率。
(4)化学反应速率一般不能用固体或纯液体表示。
一. 有效碰撞理论
1.碰撞理论
化学反应发生的前提是反应物分子间发生 。能发生 的碰撞叫有效碰撞。
碰撞
反应
新知梳理
2.活化分子和活化能
(1)活化分子:
在化学反应中,能量较高、有可能发生 的分子。
(2)活化能:
活化分子的平均能量与所有分子的平均能量之差。
有效碰撞
正反应的活化能
反应热
3.活化能与化学反应速率的关系
(1)在一定条件下,活化分子所占的百分数是固定的,活化分子的百分数越大,单位体积内活化分子数越多,单位时间内 越多,化学反应速率越快。
有效碰撞次数
(2)活化能降低→普通分子变成 →
→有效碰撞次数增多→反应速率加快。
活化分子
活化分子百分数增大
1.内因
参加反应物质的 。
2.外因
(1)浓度:
性质
二. 影响化学反应速率的外界条件
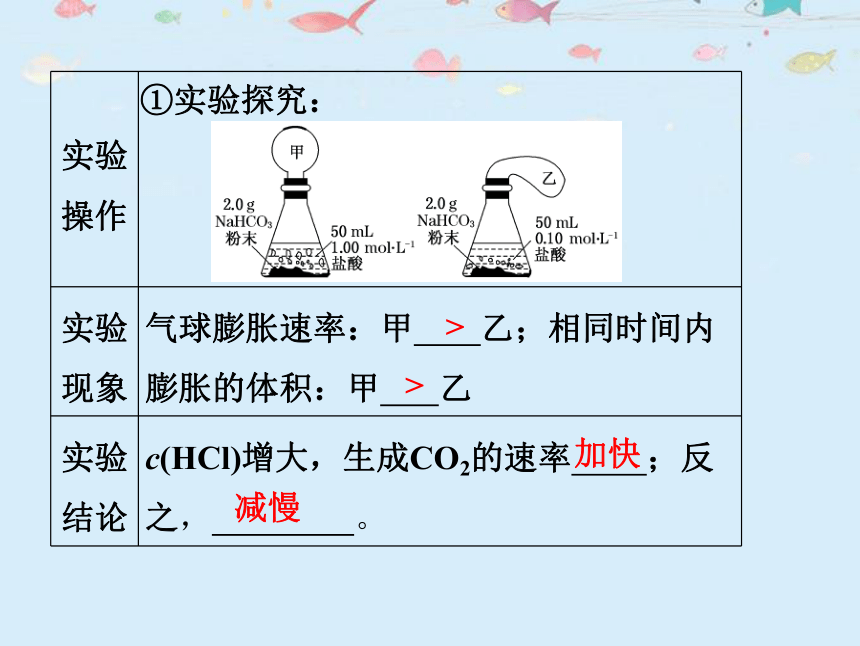
①实验探究:
实验 操作
实验 现象 气球膨胀速率:甲 乙;相同时间内膨胀的体积:甲 乙
实验 结论 c(HCl)增大,生成CO2的速率 ;反之, 。
加快
减慢
>
>
②规律(其他条件相同时):
增大反应物浓度,反应速率 ;
减小反应物浓度,反应速率 。
③原因:
c(反)增大―→单位体积内分子总数 ―→单位体积内活化分子数 ―→有效碰撞次数
―→v增大。
增大
减小
增多
增多
增多
注意:
改变固体或纯液体的用量,反应速率不变。原因:固体或纯液体浓度是常数,虽然用量改变,但浓度不变,反应速率不变,影响的是产物的产量;另外,固体表面积越大,v越大。
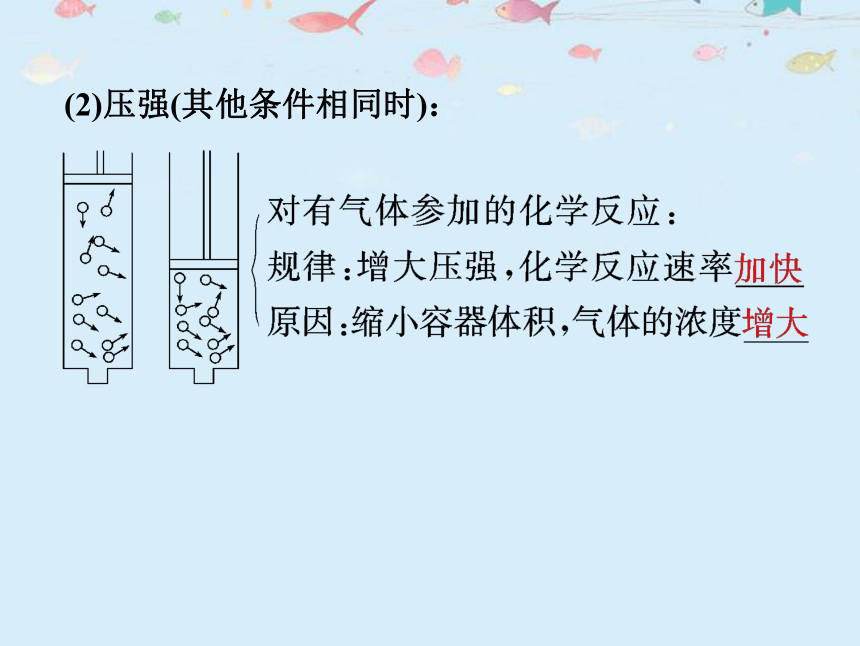
(2)压强(其他条件相同时):
N2 H2
Ar
讨论1:取一个容积固定的密闭容器,充入Ar气后,对速率如何影响?
总压强增大
N2、H2浓度不变
速率不变
恒容:“假”变
讨论2:向一个容积可变的容器中充入Ar气后,分析速率变化情况?
恒压:“真”变
前后压强不变
N2、H2浓度减小
速率减小
N2 H2
Ar
活塞
注意:
(1)对于没有气体参与的化学反应,由于改变压强,物质的浓度变化很小,可忽略不计,对化学反应速率无影响。
(3)压强对化学反应速率的影响是通过对浓度的影响实现的。对于压强的改变只有引起反应体系中反应物浓度的变化时,才对反应速率产生影响,改变压强其实改变了反应物的浓度。
你知道吗?
将食品置于低温条件下,常常可以保存更长的时间。为什么?
(3)温度:
①实验探究:
实验 操作
实验现象 溶液紫红色褪去所需时间长短:
实验结论 反应物的温度越高,反应速率越
甲>丙>乙
快
②规律(其他条件相同时):
升高温度,反应速率 ;
降低温度,反应速率 。
③原因:
温度升高―→活化分子百分数 ―→单位体积内活化分子数目 ―→单位时间有效碰撞次数 ―→v增大。
加快
减慢
增大
增多
增多
注意:
温度对反应速率的影响与反应类型无关。即,升高温度,吸热反应、放热反应的反应速率均增大;降低温度,吸热反应、放热反应的反应速率均减小。
你知道吗?
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶的洗衣粉,则较容易就能洗去。为什么?
(4)催化剂:
①实验探究:
实验操作
实验现象 三试管均产生气泡,但产生气泡速率: 较快, 最慢
实验结论 加入催化剂,化学反应速率
甲、乙
丙
加快
②规律:一般,催化剂能 反应速率。
③原因:
使用催化剂―→活化能 ―→活化分子百分数 ―→单位体积内活化分子数 ―→单位时间内有效碰撞次
数 ―→v增大。
(5)其他因素:
固体反应物 、光、溶剂、超声波、电磁波等也能影响反应速率。
加快
降低
增多
增多
增多
颗粒大小
加入催化剂改变反应的历程,降低反应所需的活化能,反应体系中活化分子百分数提高,使反应速率显著增大,但不改变反应过程中的反应热,能量变化如图。
注意:
(1)催化剂的使用与反应过程的能量变化:
(2)催化剂能改变化学反应的速率,但反应前后质量和化学性质不发生改变,催化剂具有选择性,不同的反应有不同的催化剂。
(3)若催化剂是酶,要注意酶只有在温和条件下催化效果才最好,若温度过高,则酶会变性,反应无催化作用。
[例1] 下列关于化学反应的说法中正确的是( )
A.同时改变两个变量来研究反应速率的变化,能更快
得出有关规律
B.放热反应的反应速率总是大于吸热反应的反应速率A
C.增大压强和加入催化剂都使反应速率增大,原因均
是因为降低了反应的活化能
D.相同温度下,H2(g)+CO2(g) CO(g)+H2O(g)中,
密闭容器中两种反应物浓度为0.020 mol·L-1的反应速
率大于两种反应物浓度为0.010 mol·L-1的反应速率
典型例题
[解析] 同时改变两个变量来研究化学反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律,A错;化学反应速率与反应是放热还是吸热无关,B错;压强对反应速率的影响同浓度对反应速率的影响一致,增大压强,增大了单位体积内活化分子的数目,从而增大有效碰撞次数,反应速率增大;而加入催化剂是降低了反应的活化能,故C错;同一个反应中,物质的浓度越高,反应速率越大,D正确。
[答案] D
(1)增大活化分子百分数的因素:升温和加入催化剂。前者是因为升温时,使部分普通分子获得能量,成为活化分子;后者是降低了反应活化能,使部分普通分子成为活化分子。
(2)压强对反应速率的影响实质是气体反应物浓度的影响,压强变,浓度变,速率变。
[借题发挥]
(3)中学阶段一般只研究一种变量对反应速率的影响,两种变量(对v的影响相反时)不作研究。
(4)化学反应速率与反应类型(吸热反应、放热反应)无关,升温时,吸热反应、放热反应的反应速率均增大。
[例2] 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的试验组别可能是 ( )
组别 c(HCl)/mol·L-1 温度/℃ 状态
1 2.0 25 块状
2 2.5 25 块状
3 2.5 50 块状
4 2.5 50 粉末状
A.4 3 2 1 B.1 2 3 4
C.3 4 2 1 D.1 2 4 3
[解析] 本题影响反应速率的因素有温度、浓度和接触面积,三者兼顾才可得出正确答案。第4组浓度最大,温度最高且为粉末状,反应最快,对应曲线a。
[答案] A
化学反应速率图像题和表格题分析技巧
(1)图像分析技巧“三看”:
一看起点:分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
二看变化趋势:分清正反应和逆反应,分清放热反应和吸热反应。
三看终点:分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比等于化学反应方程式中各物质的化学计量数之比。
[借题发挥]
(2)表格题(对照)分析技巧:
①分析表格,找出对探究结果影响的因素。
②按只改变一个因素,其它因素不变,将题目所列实验进行分组。
③对照规律,逐组分析,得出结论。
(1)通过表格可以得出影响该反应化学反应速率的因素有哪些?
(2)该题得出结论,至少用了几次“对照”?
提示:(1)浓度,温度和
固体的状态。
(2)三次。一、二组对
照,得出浓度对v的影
响;
二、三组对照,得出温度对
v的影响;
三、四组对照,得出固体状态对v的影响。
1.下列哪项是影响化学反应速率的主要因素( )
A.压强 B.浓度
C.催化剂 D.反应物的性质
随堂练习
D
2.用3 g块状大理石与30 mL 3 mol·L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是 ( )
①再加入30 mL 3 mol·L-1盐酸
②改用30 mL 6 mol·L-1盐酸
③改用3 g粉末状大理石
④适当升高温度
A.①②④ B.②③④
C.①③④ D.①②③
B
3.一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能加快反应速率的是 ( )
A.增大体积使压强减小
B.恒容,充入N2
C.恒容,充入He
D.恒压,充入He
B
4.下列说法正确的是 ( )
A.增大压强,活化分子数增多,化学反应速率一定增大
B.升高温度,增大了活化分子的数目,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
BD
答案:(1)纯氧气中O2分子的浓度大,反应速率大,单位时间内放出热量多,容易使氨跟氧气的反应发生,并达到着火点而燃烧。
5.解释下列反应事实:
①氨气在空气中不能燃烧,但在纯氧气中点燃能剧烈燃烧。
②硫在空气中点燃产生淡蓝色火焰,而在氧气中点燃却产生蓝紫色火焰。
(2)O2分子浓度大,硫跟O2分子反应速率大,产生的火焰的颜色深。
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是
6.氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)的反应速率如图所示,已知这个反应速率随着溶液中[H+]增大而加快。
2KClO3+6NaHSO3 3Na2SO4+2KCl+3H2SO4,
氢离子浓度增大,反应速率加快 。
反应物浓度减小,反应速率减慢。
本节内容结束
第2课时
影响化学反应速率的因素
专题2 化学反应速率与化学平衡
第一单元 化学反应速率
学习目标
1. 理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。
2. 了解催化剂在生产、生活和科学研究领域中的重大作用。
3. 知道活化能的含义及其对化学反应速率的影响。
4. 了解通过改变外界条件改变化学反应速率的方法和意义。
知识回顾
(1)化学反应速率是用来衡量化学反应的快慢的尺度,它与时间和浓度变化有关。
(2)在同一反应中用不同物质来表示时,其数值可以不同,但都表示同一个反应的速率。因此,表示化学反应的速率时,必须说明反应物中哪种物质做标准。不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比。
(3)一般来说,化学反应速率随反应的进行而逐渐减
慢。因此,某一段时间内的反应速率,是平均速率,
而不是指瞬时速率。
(4)化学反应速率一般不能用固体或纯液体表示。
一. 有效碰撞理论
1.碰撞理论
化学反应发生的前提是反应物分子间发生 。能发生 的碰撞叫有效碰撞。
碰撞
反应
新知梳理
2.活化分子和活化能
(1)活化分子:
在化学反应中,能量较高、有可能发生 的分子。
(2)活化能:
活化分子的平均能量与所有分子的平均能量之差。
有效碰撞
正反应的活化能
反应热
3.活化能与化学反应速率的关系
(1)在一定条件下,活化分子所占的百分数是固定的,活化分子的百分数越大,单位体积内活化分子数越多,单位时间内 越多,化学反应速率越快。
有效碰撞次数
(2)活化能降低→普通分子变成 →
→有效碰撞次数增多→反应速率加快。
活化分子
活化分子百分数增大
1.内因
参加反应物质的 。
2.外因
(1)浓度:
性质
二. 影响化学反应速率的外界条件
①实验探究:
实验 操作
实验 现象 气球膨胀速率:甲 乙;相同时间内膨胀的体积:甲 乙
实验 结论 c(HCl)增大,生成CO2的速率 ;反之, 。
加快
减慢
>
>
②规律(其他条件相同时):
增大反应物浓度,反应速率 ;
减小反应物浓度,反应速率 。
③原因:
c(反)增大―→单位体积内分子总数 ―→单位体积内活化分子数 ―→有效碰撞次数
―→v增大。
增大
减小
增多
增多
增多
注意:
改变固体或纯液体的用量,反应速率不变。原因:固体或纯液体浓度是常数,虽然用量改变,但浓度不变,反应速率不变,影响的是产物的产量;另外,固体表面积越大,v越大。
(2)压强(其他条件相同时):
N2 H2
Ar
讨论1:取一个容积固定的密闭容器,充入Ar气后,对速率如何影响?
总压强增大
N2、H2浓度不变
速率不变
恒容:“假”变
讨论2:向一个容积可变的容器中充入Ar气后,分析速率变化情况?
恒压:“真”变
前后压强不变
N2、H2浓度减小
速率减小
N2 H2
Ar
活塞
注意:
(1)对于没有气体参与的化学反应,由于改变压强,物质的浓度变化很小,可忽略不计,对化学反应速率无影响。
(3)压强对化学反应速率的影响是通过对浓度的影响实现的。对于压强的改变只有引起反应体系中反应物浓度的变化时,才对反应速率产生影响,改变压强其实改变了反应物的浓度。
你知道吗?
将食品置于低温条件下,常常可以保存更长的时间。为什么?
(3)温度:
①实验探究:
实验 操作
实验现象 溶液紫红色褪去所需时间长短:
实验结论 反应物的温度越高,反应速率越
甲>丙>乙
快
②规律(其他条件相同时):
升高温度,反应速率 ;
降低温度,反应速率 。
③原因:
温度升高―→活化分子百分数 ―→单位体积内活化分子数目 ―→单位时间有效碰撞次数 ―→v增大。
加快
减慢
增大
增多
增多
注意:
温度对反应速率的影响与反应类型无关。即,升高温度,吸热反应、放热反应的反应速率均增大;降低温度,吸热反应、放热反应的反应速率均减小。
你知道吗?
衣物上的油渍用普通洗衣粉很难洗去,但如果用加有酶的洗衣粉,则较容易就能洗去。为什么?
(4)催化剂:
①实验探究:
实验操作
实验现象 三试管均产生气泡,但产生气泡速率: 较快, 最慢
实验结论 加入催化剂,化学反应速率
甲、乙
丙
加快
②规律:一般,催化剂能 反应速率。
③原因:
使用催化剂―→活化能 ―→活化分子百分数 ―→单位体积内活化分子数 ―→单位时间内有效碰撞次
数 ―→v增大。
(5)其他因素:
固体反应物 、光、溶剂、超声波、电磁波等也能影响反应速率。
加快
降低
增多
增多
增多
颗粒大小
加入催化剂改变反应的历程,降低反应所需的活化能,反应体系中活化分子百分数提高,使反应速率显著增大,但不改变反应过程中的反应热,能量变化如图。
注意:
(1)催化剂的使用与反应过程的能量变化:
(2)催化剂能改变化学反应的速率,但反应前后质量和化学性质不发生改变,催化剂具有选择性,不同的反应有不同的催化剂。
(3)若催化剂是酶,要注意酶只有在温和条件下催化效果才最好,若温度过高,则酶会变性,反应无催化作用。
[例1] 下列关于化学反应的说法中正确的是( )
A.同时改变两个变量来研究反应速率的变化,能更快
得出有关规律
B.放热反应的反应速率总是大于吸热反应的反应速率A
C.增大压强和加入催化剂都使反应速率增大,原因均
是因为降低了反应的活化能
D.相同温度下,H2(g)+CO2(g) CO(g)+H2O(g)中,
密闭容器中两种反应物浓度为0.020 mol·L-1的反应速
率大于两种反应物浓度为0.010 mol·L-1的反应速率
典型例题
[解析] 同时改变两个变量来研究化学反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律,A错;化学反应速率与反应是放热还是吸热无关,B错;压强对反应速率的影响同浓度对反应速率的影响一致,增大压强,增大了单位体积内活化分子的数目,从而增大有效碰撞次数,反应速率增大;而加入催化剂是降低了反应的活化能,故C错;同一个反应中,物质的浓度越高,反应速率越大,D正确。
[答案] D
(1)增大活化分子百分数的因素:升温和加入催化剂。前者是因为升温时,使部分普通分子获得能量,成为活化分子;后者是降低了反应活化能,使部分普通分子成为活化分子。
(2)压强对反应速率的影响实质是气体反应物浓度的影响,压强变,浓度变,速率变。
[借题发挥]
(3)中学阶段一般只研究一种变量对反应速率的影响,两种变量(对v的影响相反时)不作研究。
(4)化学反应速率与反应类型(吸热反应、放热反应)无关,升温时,吸热反应、放热反应的反应速率均增大。
[例2] 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的试验组别可能是 ( )
组别 c(HCl)/mol·L-1 温度/℃ 状态
1 2.0 25 块状
2 2.5 25 块状
3 2.5 50 块状
4 2.5 50 粉末状
A.4 3 2 1 B.1 2 3 4
C.3 4 2 1 D.1 2 4 3
[解析] 本题影响反应速率的因素有温度、浓度和接触面积,三者兼顾才可得出正确答案。第4组浓度最大,温度最高且为粉末状,反应最快,对应曲线a。
[答案] A
化学反应速率图像题和表格题分析技巧
(1)图像分析技巧“三看”:
一看起点:分清反应物和生成物,浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
二看变化趋势:分清正反应和逆反应,分清放热反应和吸热反应。
三看终点:分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比等于化学反应方程式中各物质的化学计量数之比。
[借题发挥]
(2)表格题(对照)分析技巧:
①分析表格,找出对探究结果影响的因素。
②按只改变一个因素,其它因素不变,将题目所列实验进行分组。
③对照规律,逐组分析,得出结论。
(1)通过表格可以得出影响该反应化学反应速率的因素有哪些?
(2)该题得出结论,至少用了几次“对照”?
提示:(1)浓度,温度和
固体的状态。
(2)三次。一、二组对
照,得出浓度对v的影
响;
二、三组对照,得出温度对
v的影响;
三、四组对照,得出固体状态对v的影响。
1.下列哪项是影响化学反应速率的主要因素( )
A.压强 B.浓度
C.催化剂 D.反应物的性质
随堂练习
D
2.用3 g块状大理石与30 mL 3 mol·L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是 ( )
①再加入30 mL 3 mol·L-1盐酸
②改用30 mL 6 mol·L-1盐酸
③改用3 g粉末状大理石
④适当升高温度
A.①②④ B.②③④
C.①③④ D.①②③
B
3.一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能加快反应速率的是 ( )
A.增大体积使压强减小
B.恒容,充入N2
C.恒容,充入He
D.恒压,充入He
B
4.下列说法正确的是 ( )
A.增大压强,活化分子数增多,化学反应速率一定增大
B.升高温度,增大了活化分子的数目,化学反应速率一定增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大
BD
答案:(1)纯氧气中O2分子的浓度大,反应速率大,单位时间内放出热量多,容易使氨跟氧气的反应发生,并达到着火点而燃烧。
5.解释下列反应事实:
①氨气在空气中不能燃烧,但在纯氧气中点燃能剧烈燃烧。
②硫在空气中点燃产生淡蓝色火焰,而在氧气中点燃却产生蓝紫色火焰。
(2)O2分子浓度大,硫跟O2分子反应速率大,产生的火焰的颜色深。
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是
6.氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)的反应速率如图所示,已知这个反应速率随着溶液中[H+]增大而加快。
2KClO3+6NaHSO3 3Na2SO4+2KCl+3H2SO4,
氢离子浓度增大,反应速率加快 。
反应物浓度减小,反应速率减慢。
本节内容结束
