2023化学苏教版选择性必修一 2.2.2 化学平衡状态 课件(共26张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 2.2.2 化学平衡状态 课件(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 307.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 21:33:59 | ||
图片预览








文档简介
(共26张PPT)
第2课时
化学平衡状态
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向与限度
学习目标
1.了解化学反应的可逆性及可逆反应的限度,建立化学平衡的观点。
2.掌握判断化学平衡状态的方法。
高炉炼铁的主要反应为:
Fe2O3+3CO 2Fe +3CO2
从炼铁炉口排出的尾气中含有一定量的CO。100多年
前,人们曾认为这是由于 CO与铁矿石接触时间不够
的缘故。为使反应进行的完全,当时曾耗巨资改建高
炉,以延长 CO和Fe2O3的接触时间,结果尾气中CO
的含量并未减少。你知道这是为什么吗?
你知道吗?
反应Fe2O3+3CO 2Fe +3CO2 为什么不能进行到底?
讨论、小结:
反应Fe2O3+3CO 2Fe +3CO2 的特点是高温下既能向正反应方向进行又能向逆反应方向进行,是可逆反应。
交流讨论
1. 可逆反应
(1)在相同条件下同时向正、反两个方向进行的反应称可逆反应。
3H2 + N2 2NH3
2SO2 + O2 2SO3
不可逆反应:在一定条件下,进行得很彻底或可逆程度很小的反应。
一、可逆反应的概念及其特点
(1)可逆反应的普遍性:大部分化学反应都 是可逆反应。
(2)可逆反应的特点:
①相同条件下,正反应和逆反应同时发生。
②反应物、生成物共同存在。
③可逆反应有一定的限度(反应不能进行到底)。
2. 可逆反应特点
1.下列为可逆反应的是 ( )
A. 氢气与氧气点燃可化合成水,水电解可生成氢气和氧气,因此氢气与氧气的反应是可逆反应。
B. 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又有分解。
C. 合成氨的反应,在现有技术条件下,其转化率总是达不到百分百。
D. 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应是可逆反应。
练习
BC
2. 在一定条件下,向一固定容积的容器中投入2 mol NO2进行反应:2NO2 2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是( )
A. 2 mol NO、0.75 mol O2
B. 1 mol NO2、1.2 mol NO
C. 2 mol NO
D. 0.7 mol O2
D
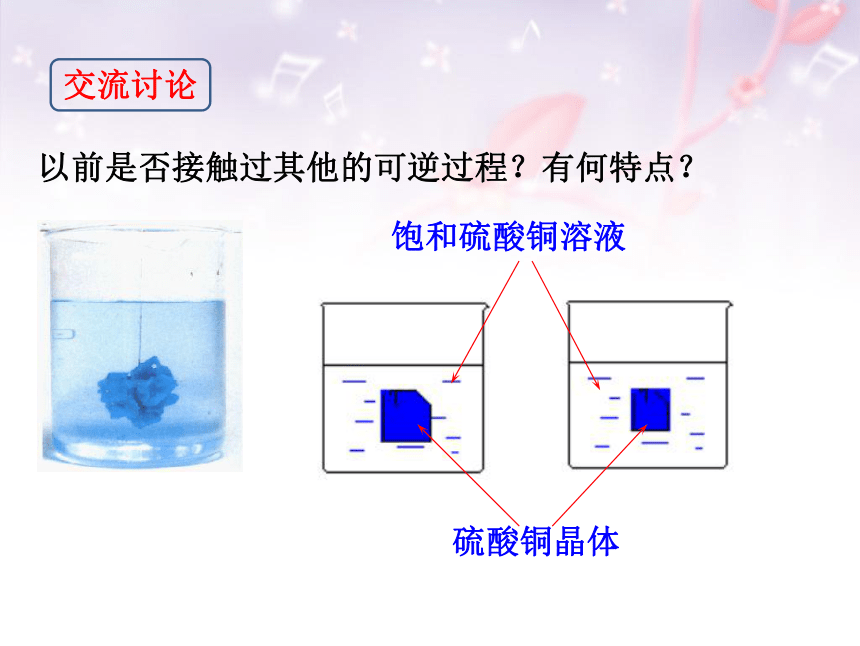
硫酸铜晶体
饱和硫酸铜溶液
以前是否接触过其他的可逆过程?有何特点?
交流讨论
饱和溶液中溶质的溶解与结晶是一对可逆过程。
其中溶质溶解的速率与结晶速率相等,处于一个
动态平衡。
讨论、小结:
固体溶质
溶液中的溶质
溶解
结晶
交流讨论
溶解平衡是动态平衡
当溶解速率与结晶速率相等时,达到溶解平衡状态
二、化学平衡
CO+H2O CO2+H2
高温
时间
速率
O
·
·
时间
浓度
O
·
·
v正
v逆
t1
t1
以小组为单位进行P59的交流与讨论:
反应物
生成物
交流讨论
1. 化学平衡状态的定义
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
注意
对象
条件
状态
结果
可逆反应
一定
v正= v逆
c(B)不变
(动态平衡)
2. 化学平衡状态的特征
动
动态平衡: v(正) ≠0; v(逆) ≠0
等
定
变
v(正)= v(逆) ≠0
c(B) 或 n(B) 或 ω(B) 一定
条件改变→平衡改变
逆
化学平衡的研究对象是可逆反应
3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成n molA,同时生成3n molB
C. A、B、C的物质的量浓度保持不变
D. A、B、C的分子数之比为1 :3 :2
E. 容器中气体的密度保持不变
F. 混合气体的平均摩尔质量保持不变
G. 容器中气体的总压强保持不变
ACF
练习
(1)v正 = v逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。
3. 化学平衡状态的标志
(2)反应混合物中各组成成分的含量保持不变(浓度标志):
① 各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。
4. 下列说法中可以充分说明反应:
P(g)+Q(g) R(g)+S(g) , 在恒温下已
达平衡状态的是 ( )
A. 反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
练习
5.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是 ( )
A. 1个N≡N键断裂的同时,有3个H-H键形成
B. 1个N≡N键断裂的同时,有3个H-H键断裂
C. 1个N≡N键断裂的同时,有6个N-H键断裂
D. 1个N≡N键断裂的同时,有6个N-H键形成
AC
6. 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g) 2C(g)+D(g)
已达平衡状态的是 ( )
A.混合气体的压强 B. 混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC
是 否 平 衡
混合体系中各组分的 含量 各物质的物质的量或物质的量的分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总压强、总体积、总物质的量一定
mA(g) + n B(g) ? pC(g) +q D(g)
平 衡
平 衡
平 衡
不一定
小结
是否平衡
正、逆反应速率关系 在单位时间内消耗了m mol A的同时生成了m mol A
在单位时间内消耗了n mol B的同时消耗了p mol C
在单位时间内生成了n mol B的同时消耗了q mol D(均指v逆)
v(A) v(B) v(C) v(D) = m n p q v正不一定等于v逆
mA(g) + nB(g) ? pC(g) +qD(g)
不一定
不一定
平 衡
平 衡
是否平衡
压强 当m + n ≠ p + q 时,总压力一定(其它条件一定)
当m + n = p + q 时,总压力一定(其它条件一定)
混合气体的平均M 当 m + n ≠ p + q 时,M一定
当 m + n = p + q 时,M一定
mA(g) + nB(g) ? pC(g) +qD(g)
不一定
不一定
平 衡
平 衡
注意化学反应的特点
密度 ρ C(s)+CO2(g) 2CO(g) (ρ一定)
N2(g)+3H2(g) 2NH3(g) (ρ一定)
H2(g)+I2(g) 2HI(g) (ρ一定)
不一定
不一定
平 衡
本节内容结束
第2课时
化学平衡状态
专题2 化学反应速率与化学平衡
第二单元 化学反应的方向与限度
学习目标
1.了解化学反应的可逆性及可逆反应的限度,建立化学平衡的观点。
2.掌握判断化学平衡状态的方法。
高炉炼铁的主要反应为:
Fe2O3+3CO 2Fe +3CO2
从炼铁炉口排出的尾气中含有一定量的CO。100多年
前,人们曾认为这是由于 CO与铁矿石接触时间不够
的缘故。为使反应进行的完全,当时曾耗巨资改建高
炉,以延长 CO和Fe2O3的接触时间,结果尾气中CO
的含量并未减少。你知道这是为什么吗?
你知道吗?
反应Fe2O3+3CO 2Fe +3CO2 为什么不能进行到底?
讨论、小结:
反应Fe2O3+3CO 2Fe +3CO2 的特点是高温下既能向正反应方向进行又能向逆反应方向进行,是可逆反应。
交流讨论
1. 可逆反应
(1)在相同条件下同时向正、反两个方向进行的反应称可逆反应。
3H2 + N2 2NH3
2SO2 + O2 2SO3
不可逆反应:在一定条件下,进行得很彻底或可逆程度很小的反应。
一、可逆反应的概念及其特点
(1)可逆反应的普遍性:大部分化学反应都 是可逆反应。
(2)可逆反应的特点:
①相同条件下,正反应和逆反应同时发生。
②反应物、生成物共同存在。
③可逆反应有一定的限度(反应不能进行到底)。
2. 可逆反应特点
1.下列为可逆反应的是 ( )
A. 氢气与氧气点燃可化合成水,水电解可生成氢气和氧气,因此氢气与氧气的反应是可逆反应。
B. 在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又有分解。
C. 合成氨的反应,在现有技术条件下,其转化率总是达不到百分百。
D. 碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳在常温下生成碳酸钙,因此这二个反应是可逆反应。
练习
BC
2. 在一定条件下,向一固定容积的容器中投入2 mol NO2进行反应:2NO2 2NO+O2,一段时间后测得NO2、NO、O2的物质的量可能是( )
A. 2 mol NO、0.75 mol O2
B. 1 mol NO2、1.2 mol NO
C. 2 mol NO
D. 0.7 mol O2
D
硫酸铜晶体
饱和硫酸铜溶液
以前是否接触过其他的可逆过程?有何特点?
交流讨论
饱和溶液中溶质的溶解与结晶是一对可逆过程。
其中溶质溶解的速率与结晶速率相等,处于一个
动态平衡。
讨论、小结:
固体溶质
溶液中的溶质
溶解
结晶
交流讨论
溶解平衡是动态平衡
当溶解速率与结晶速率相等时,达到溶解平衡状态
二、化学平衡
CO+H2O CO2+H2
高温
时间
速率
O
·
·
时间
浓度
O
·
·
v正
v逆
t1
t1
以小组为单位进行P59的交流与讨论:
反应物
生成物
交流讨论
1. 化学平衡状态的定义
指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
注意
对象
条件
状态
结果
可逆反应
一定
v正= v逆
c(B)不变
(动态平衡)
2. 化学平衡状态的特征
动
动态平衡: v(正) ≠0; v(逆) ≠0
等
定
变
v(正)= v(逆) ≠0
c(B) 或 n(B) 或 ω(B) 一定
条件改变→平衡改变
逆
化学平衡的研究对象是可逆反应
3. 在一定的温度下,可逆反应:A(g)+ 3B(g)
2C(g)达到平衡的标志是 ( )
A. C的生成速率与C的分解速率相等
B. 单位时间生成n molA,同时生成3n molB
C. A、B、C的物质的量浓度保持不变
D. A、B、C的分子数之比为1 :3 :2
E. 容器中气体的密度保持不变
F. 混合气体的平均摩尔质量保持不变
G. 容器中气体的总压强保持不变
ACF
练习
(1)v正 = v逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。
3. 化学平衡状态的标志
(2)反应混合物中各组成成分的含量保持不变(浓度标志):
① 各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。
4. 下列说法中可以充分说明反应:
P(g)+Q(g) R(g)+S(g) , 在恒温下已
达平衡状态的是 ( )
A. 反应容器内压强不随时间变化
B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存
D. 反应容器内总物质的量不随时间而变化
B
练习
5.下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是 ( )
A. 1个N≡N键断裂的同时,有3个H-H键形成
B. 1个N≡N键断裂的同时,有3个H-H键断裂
C. 1个N≡N键断裂的同时,有6个N-H键断裂
D. 1个N≡N键断裂的同时,有6个N-H键形成
AC
6. 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g) 2C(g)+D(g)
已达平衡状态的是 ( )
A.混合气体的压强 B. 混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC
是 否 平 衡
混合体系中各组分的 含量 各物质的物质的量或物质的量的分数一定
各物质的质量或质量分数一定
各气体的体积或体积分数一定
总压强、总体积、总物质的量一定
mA(g) + n B(g) ? pC(g) +q D(g)
平 衡
平 衡
平 衡
不一定
小结
是否平衡
正、逆反应速率关系 在单位时间内消耗了m mol A的同时生成了m mol A
在单位时间内消耗了n mol B的同时消耗了p mol C
在单位时间内生成了n mol B的同时消耗了q mol D(均指v逆)
v(A) v(B) v(C) v(D) = m n p q v正不一定等于v逆
mA(g) + nB(g) ? pC(g) +qD(g)
不一定
不一定
平 衡
平 衡
是否平衡
压强 当m + n ≠ p + q 时,总压力一定(其它条件一定)
当m + n = p + q 时,总压力一定(其它条件一定)
混合气体的平均M 当 m + n ≠ p + q 时,M一定
当 m + n = p + q 时,M一定
mA(g) + nB(g) ? pC(g) +qD(g)
不一定
不一定
平 衡
平 衡
注意化学反应的特点
密度 ρ C(s)+CO2(g) 2CO(g) (ρ一定)
N2(g)+3H2(g) 2NH3(g) (ρ一定)
H2(g)+I2(g) 2HI(g) (ρ一定)
不一定
不一定
平 衡
本节内容结束
