2023化学苏教版选择性必修一 2.3.1 浓度、压强变化对化学平衡的影响 课件(共26张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 2.3.1 浓度、压强变化对化学平衡的影响 课件(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 810.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 21:36:14 | ||
图片预览





文档简介
(共26张PPT)
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第1课时 浓度、压强变化对化学平衡的影响
1. 通过外界条件对可逆反应速率的影响,掌握化学平衡移动的内在规律。
2. 通过实验探究,讨论分析浓度、压强影响平衡移动的规律。
学习目标
当打开一瓶碳酸型饮料后,你能观察到什么现象?你能解释这个现象吗?
你能解释吗?
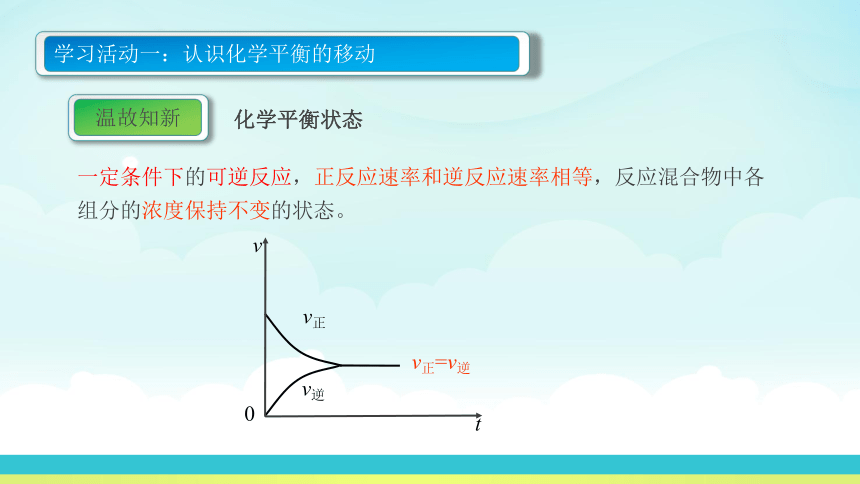
化学平衡状态
一定条件下的可逆反应,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
学习活动一:认识化学平衡的移动
温故知新
v正
v逆
v正=v逆
v
t
0
2. 定义:改变外界条件,可逆反应中旧的化学平衡的破坏,新化学平衡的建立过程叫化学平衡的移动。
1. 研究对象:已建立平衡状态的体系。
化学平衡移动的根本原因:外界条件改变,引起v正、 v逆发生改变,
且: v正≠ v逆≠0,造成化学平衡移动。
化学平衡移动
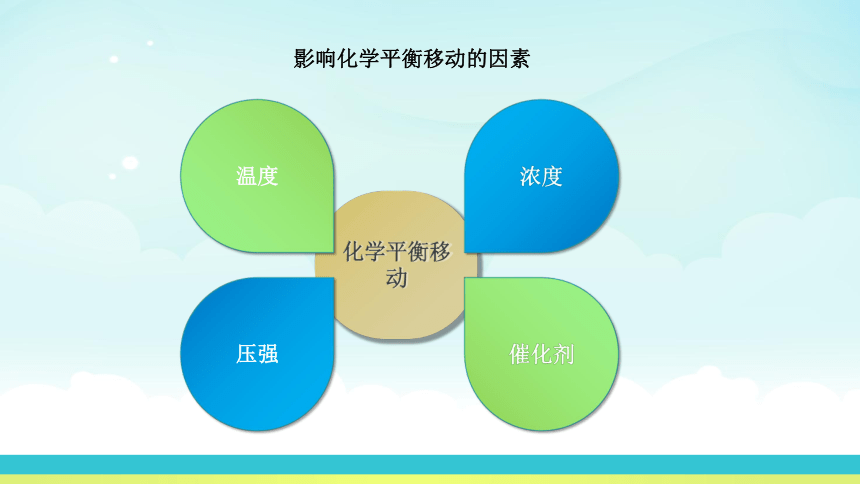
影响化学平衡移动的因素
压强
浓度
温度
催化剂
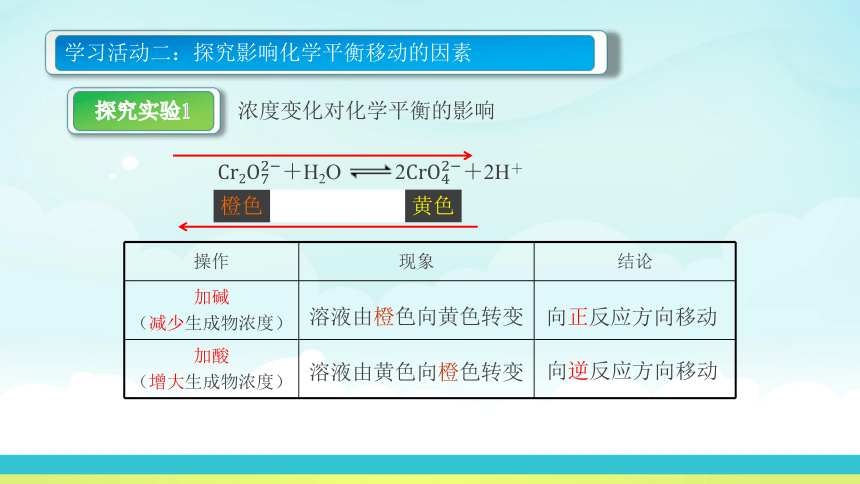
浓度变化对化学平衡的影响
【实验1】向试管中加入4 mL 0.1 mol·L-1 K2Cr2O7溶液,滴加5-6滴1 mol·L-1 NaOH溶液,观察溶液颜色的变化。
【实验2】将上述溶液分成两份,向其中一份中滴加5-6滴1 mol·L-1 HNO3溶液,观察溶液颜色的变化。
+H2O 2+2H+
黄色
橙色
学习活动二:探究影响化学平衡移动的因素
探究实验1
浓度变化对化学平衡的影响
+H2O 2+2H+
黄色
橙色
学习活动二:探究影响化学平衡移动的因素
探究实验1
操作 现象 结论
加碱 (减少生成物浓度)
加酸 (增大生成物浓度)
溶液由橙色向黄色转变
溶液由黄色向橙色转变
向正反应方向移动
向逆反应方向移动
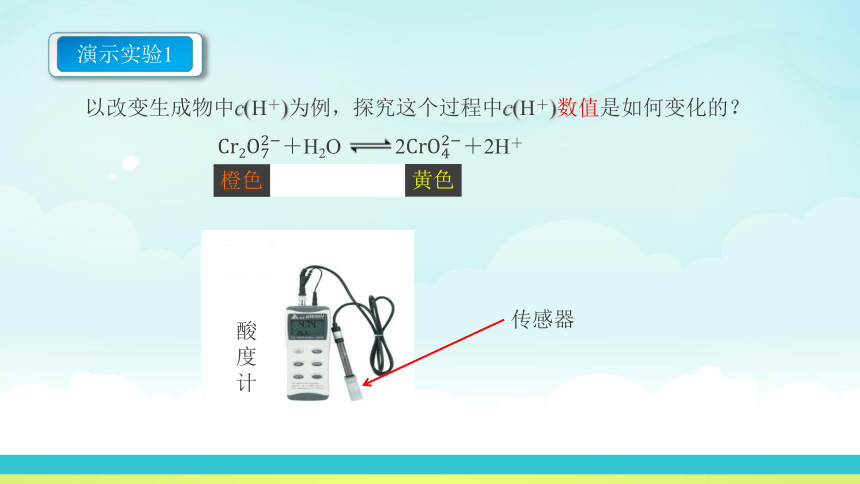
酸度计
以改变生成物中c(H+)为例,探究这个过程中c(H+)数值是如何变化的?
传感器
演示实验1
+H2O 2+2H+
黄色
橙色
其他条件相同时,增大反应物的浓度,反应速率加快。
v正〃= v逆〃
已达到平衡状态的可逆反应
若其他条件不变时,在 t1 时刻
仅增大 H+ 浓度,试绘制速率 (v) 随时间 (t) 变化的曲线。
0
v
t
v正'
v逆
v正=v逆
t1
速率 (v)-时间 (t)图
A + H+ AH+
0
v
t
v正=v逆
t1
已达到平衡状态的可逆反应
若其他条件不变时,在 t1 时刻
仅减小 H+ 浓度,试绘制速率
(v) 随时间 (t) 变化的曲线。
速率 (v)-时间 (t)图
v正〃= v逆〃
v逆
v正'
A + H+ AH+
速率 (v )-时间 (t )图
v正〃= v逆〃
0
v
t
v正'
v逆
v正=v逆
t1
仅增大c(H+)
仅减小c(H+)
0
v
t
v正=v逆
t1
v正〃= v逆〃
v逆
v正'
改变反应条件 平衡移动的方向
在其他条件不变的情况下,改变浓度时平衡移动的方向
增大生成物的浓度
向逆反应方向移动
向正反应方向移动
减小生成物的浓度
归纳
例1.人体血液中的血红蛋白(Hb)易与氧气结合生成HbO2,因此具有输氧能力。CO被人吸入肺中发生反应:HbO2+CO===HbCO+O2,37℃时该反应的化学平衡常数K=220。当HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列有关结论不正确的是( )
A.该反应的化学平衡常数的表达式为
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比等于0.02时,人的智力不会受损
D.把CO中毒的病人放入高压氧舱中解毒,其原理是使上述平衡向左移动
C
【解析】A.平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,反应的方程式为CO+HbO2 O2+HbCO,则平衡常数 ,故A正确;
B.人体吸入的CO越多,CO的浓度增大,平衡向正反应分析移动,与血红蛋白结合的O2越少,故B正确;
C.当吸入的CO与O2浓度之比大于或等于0.02时,根据平衡常数 可知, 智力早就受到伤害了,故C错误;
D.CO中毒的病人放入高压氧仓中,氧气的浓度增大,平衡向左移动,故D正确。
当改变气体体积引起压强改变时,气体的浓度是否发生改变?
想一想
可逆反应 增大压强 减小压强
N2O4 2NO2
向气体分子数减小方向移动
向气体分子增大方向移动
平衡常数
表达式
改变压强对平衡的影响
FeO(s)+CO(g) Fe(s)+CO2(g)
不移动
不移动
用平衡常数推理压强变化对化学平衡的影响。
试一试
N2O4(g) 2NO2(g)
N2O4和NO2
CCl4
红墨水
空气
N2O4和NO2、空气均不易溶于CCl4,也不易与CCl4反应。
结论:增大压强,平衡向气体分子数减小的方向移动
信息提示
演示实验2
增大压强时,化学平衡向什么方向移动?
1.对于反应前后气体分子数不相同的可逆反应:
2.对于反应前后气体分子数相同的可逆反应:
改变压强,
归纳
化学平衡不移动。
在其他条件不变的情况下,改变压强时平衡移动的方向
改变反应条件 平衡移动的方向
向气体分子数减小方向移动
向气体分子数增大方向移动
增大压强
减小压强
例2.在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则在下列关系式中正确的是 ( )
A.p1>p2
B.p1C.m+n>p+q
D.m+n=p+q
B
【解析】图像显示,在压强为p1时,在t2达到平衡,生成物C的体积分数为c1;在压强为p2时,在t1达到平衡,生成物C的体积分数为c2。从横坐标看,t2>t1,说明p2时化学反应速率快,先达到平衡,所以压强p2>p1;从纵坐标看,c1>c2,说明加压使平衡向逆反应方向移动,即p+q>m+n。
CO2(g)+ H2O(l) H2CO3(aq)
你能解释吗?
H+(aq)+(aq)
H2CO3(aq)
当打开一瓶碳酸型饮料后,瓶口会有大量泡沫喷涌而出。你能解释这个现象吗?
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加CO2,平衡 __________,c(CO) ________。
1.在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) H﹥0
(2)增加碳,平衡 ________________。
不移动
正向移动
增大
巩固练习
2. 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①正反应速率一定增大 ② 生成物的产量一定增加 ③ 反应物的转化率一定增大④ 反应物浓度一定降低 ⑤ 正反应速率一定大于逆反应速率
A. ① ② B. ② ⑤ C.③ ⑤ D.④ ⑥
B
3. 在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol HI(a>b),可逆反应2HI(g) H2(g)+I2(g)达到平衡后,下列说法正确的是( )
A.开始时A容器中的反应速率大于B容器中的反应速率
B.平衡时c(I2)A=c(I2)B
C.HI的平衡分解率:αA>αB
D.平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器
A
本节内容结束
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第1课时 浓度、压强变化对化学平衡的影响
1. 通过外界条件对可逆反应速率的影响,掌握化学平衡移动的内在规律。
2. 通过实验探究,讨论分析浓度、压强影响平衡移动的规律。
学习目标
当打开一瓶碳酸型饮料后,你能观察到什么现象?你能解释这个现象吗?
你能解释吗?
化学平衡状态
一定条件下的可逆反应,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
学习活动一:认识化学平衡的移动
温故知新
v正
v逆
v正=v逆
v
t
0
2. 定义:改变外界条件,可逆反应中旧的化学平衡的破坏,新化学平衡的建立过程叫化学平衡的移动。
1. 研究对象:已建立平衡状态的体系。
化学平衡移动的根本原因:外界条件改变,引起v正、 v逆发生改变,
且: v正≠ v逆≠0,造成化学平衡移动。
化学平衡移动
影响化学平衡移动的因素
压强
浓度
温度
催化剂
浓度变化对化学平衡的影响
【实验1】向试管中加入4 mL 0.1 mol·L-1 K2Cr2O7溶液,滴加5-6滴1 mol·L-1 NaOH溶液,观察溶液颜色的变化。
【实验2】将上述溶液分成两份,向其中一份中滴加5-6滴1 mol·L-1 HNO3溶液,观察溶液颜色的变化。
+H2O 2+2H+
黄色
橙色
学习活动二:探究影响化学平衡移动的因素
探究实验1
浓度变化对化学平衡的影响
+H2O 2+2H+
黄色
橙色
学习活动二:探究影响化学平衡移动的因素
探究实验1
操作 现象 结论
加碱 (减少生成物浓度)
加酸 (增大生成物浓度)
溶液由橙色向黄色转变
溶液由黄色向橙色转变
向正反应方向移动
向逆反应方向移动
酸度计
以改变生成物中c(H+)为例,探究这个过程中c(H+)数值是如何变化的?
传感器
演示实验1
+H2O 2+2H+
黄色
橙色
其他条件相同时,增大反应物的浓度,反应速率加快。
v正〃= v逆〃
已达到平衡状态的可逆反应
若其他条件不变时,在 t1 时刻
仅增大 H+ 浓度,试绘制速率 (v) 随时间 (t) 变化的曲线。
0
v
t
v正'
v逆
v正=v逆
t1
速率 (v)-时间 (t)图
A + H+ AH+
0
v
t
v正=v逆
t1
已达到平衡状态的可逆反应
若其他条件不变时,在 t1 时刻
仅减小 H+ 浓度,试绘制速率
(v) 随时间 (t) 变化的曲线。
速率 (v)-时间 (t)图
v正〃= v逆〃
v逆
v正'
A + H+ AH+
速率 (v )-时间 (t )图
v正〃= v逆〃
0
v
t
v正'
v逆
v正=v逆
t1
仅增大c(H+)
仅减小c(H+)
0
v
t
v正=v逆
t1
v正〃= v逆〃
v逆
v正'
改变反应条件 平衡移动的方向
在其他条件不变的情况下,改变浓度时平衡移动的方向
增大生成物的浓度
向逆反应方向移动
向正反应方向移动
减小生成物的浓度
归纳
例1.人体血液中的血红蛋白(Hb)易与氧气结合生成HbO2,因此具有输氧能力。CO被人吸入肺中发生反应:HbO2+CO===HbCO+O2,37℃时该反应的化学平衡常数K=220。当HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列有关结论不正确的是( )
A.该反应的化学平衡常数的表达式为
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比等于0.02时,人的智力不会受损
D.把CO中毒的病人放入高压氧舱中解毒,其原理是使上述平衡向左移动
C
【解析】A.平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,反应的方程式为CO+HbO2 O2+HbCO,则平衡常数 ,故A正确;
B.人体吸入的CO越多,CO的浓度增大,平衡向正反应分析移动,与血红蛋白结合的O2越少,故B正确;
C.当吸入的CO与O2浓度之比大于或等于0.02时,根据平衡常数 可知, 智力早就受到伤害了,故C错误;
D.CO中毒的病人放入高压氧仓中,氧气的浓度增大,平衡向左移动,故D正确。
当改变气体体积引起压强改变时,气体的浓度是否发生改变?
想一想
可逆反应 增大压强 减小压强
N2O4 2NO2
向气体分子数减小方向移动
向气体分子增大方向移动
平衡常数
表达式
改变压强对平衡的影响
FeO(s)+CO(g) Fe(s)+CO2(g)
不移动
不移动
用平衡常数推理压强变化对化学平衡的影响。
试一试
N2O4(g) 2NO2(g)
N2O4和NO2
CCl4
红墨水
空气
N2O4和NO2、空气均不易溶于CCl4,也不易与CCl4反应。
结论:增大压强,平衡向气体分子数减小的方向移动
信息提示
演示实验2
增大压强时,化学平衡向什么方向移动?
1.对于反应前后气体分子数不相同的可逆反应:
2.对于反应前后气体分子数相同的可逆反应:
改变压强,
归纳
化学平衡不移动。
在其他条件不变的情况下,改变压强时平衡移动的方向
改变反应条件 平衡移动的方向
向气体分子数减小方向移动
向气体分子数增大方向移动
增大压强
减小压强
例2.在一定温度下的可逆反应:mA(g)+nB(g) pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则在下列关系式中正确的是 ( )
A.p1>p2
B.p1
D.m+n=p+q
B
【解析】图像显示,在压强为p1时,在t2达到平衡,生成物C的体积分数为c1;在压强为p2时,在t1达到平衡,生成物C的体积分数为c2。从横坐标看,t2>t1,说明p2时化学反应速率快,先达到平衡,所以压强p2>p1;从纵坐标看,c1>c2,说明加压使平衡向逆反应方向移动,即p+q>m+n。
CO2(g)+ H2O(l) H2CO3(aq)
你能解释吗?
H+(aq)+(aq)
H2CO3(aq)
当打开一瓶碳酸型饮料后,瓶口会有大量泡沫喷涌而出。你能解释这个现象吗?
达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化:
(1)增加CO2,平衡 __________,c(CO) ________。
1.在密闭容器中进行下列反应
CO2(g)+C(s) 2CO(g) H﹥0
(2)增加碳,平衡 ________________。
不移动
正向移动
增大
巩固练习
2. 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①正反应速率一定增大 ② 生成物的产量一定增加 ③ 反应物的转化率一定增大④ 反应物浓度一定降低 ⑤ 正反应速率一定大于逆反应速率
A. ① ② B. ② ⑤ C.③ ⑤ D.④ ⑥
B
3. 在容积相同的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol HI(a>b),可逆反应2HI(g) H2(g)+I2(g)达到平衡后,下列说法正确的是( )
A.开始时A容器中的反应速率大于B容器中的反应速率
B.平衡时c(I2)A=c(I2)B
C.HI的平衡分解率:αA>αB
D.平衡时,I2蒸气在混合气体中的体积分数:A容器>B容器
A
本节内容结束
