2023化学苏教版选择性必修一 2.3.2 温度变化对化学平衡的影响 勒夏特列原理 课件(共23张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 2.3.2 温度变化对化学平衡的影响 勒夏特列原理 课件(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 918.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 21:37:49 | ||
图片预览






文档简介
(共23张PPT)
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第2课时 温度变化对化学平衡的影响 勒夏特列原理
1. 通过温度对可逆反应速率的影响,理解并掌握温度影响化学平衡移动的规律。
2. 了解催化剂影响化学反应速率的实质,并进一步探讨对化学平衡的影响,从而了解催化剂在化工生产中的应用。
学习目标
有的同学认为,在KSCN溶液与的FeCl3溶液的反应平衡体系中加入KCl晶体会对化学平衡有影响,而且平衡会逆向移动。你同意他的观点吗?
3SCN-+ Fe3+ Fe(SCN)3
此平衡中K+与Cl—没有参加反应
观点错误
一、温度变化对化学平衡的影响
(粉红色)
(蓝色)
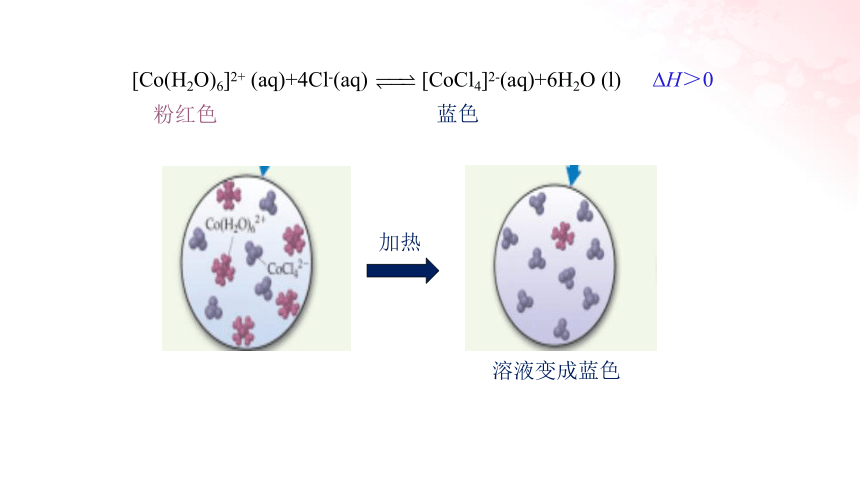
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O
H>0
温度变化,颜色发生改变
化学平衡状态是否发生了改变?
知识梳理
粉红色
蓝色
加热
溶液变成蓝色
H>0
[Co(H2O)6]2+ (aq)+4Cl-(aq) [CoCl4]2-(aq)+6H2O (l)
步骤 溶液的颜色 平衡移动的方向
室温 紫色
热水
冷水
溶液变蓝
溶液变粉红色
向吸热反应方向移动
向放热反应方向移动
升温
降温
蓝色
吸热
放热
粉红色
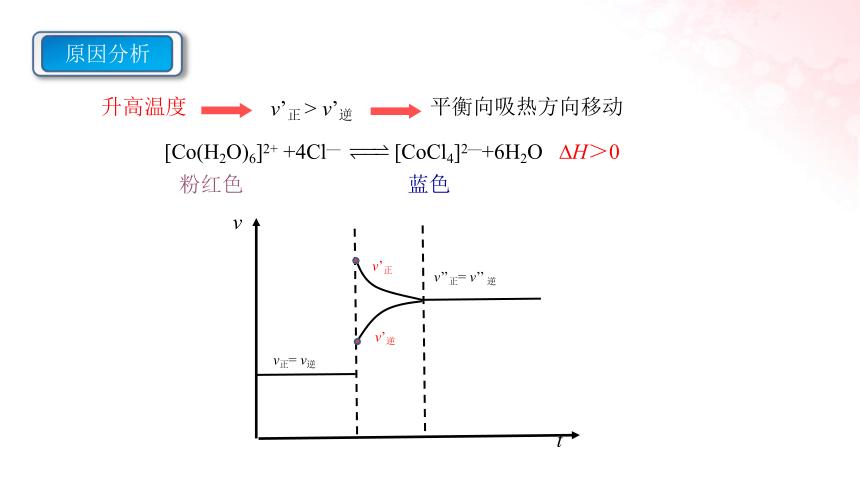
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
升高温度
平衡向吸热方向移动
v’正 > v’逆
原因分析
v
t
v正= v逆
v’正
v’逆
v’’正= v’’ 逆
蓝色
粉红色
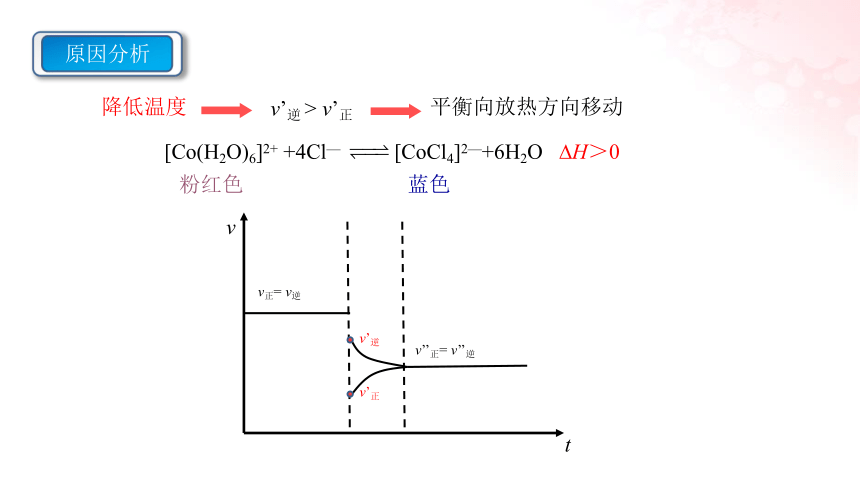
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
降低温度
平衡向放热方向移动
v’逆 > v’正
原因分析
蓝色
粉红色
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
v
t
v正= v逆
v’正
v’逆
v’’正= v’’逆
1. 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。
2. 在其它条件不变的情况下,升高温度,正逆速率都增大。
3. 在其它条件不变的情况下,升高温度,正逆速率增大倍数不同,可由平衡移动方向反推。
归纳
催化剂型号
氨浓度稳定时所需时间/h
出口氨的体积分数/%
A20-1
74-1
A110-1
DNCA
16~20
12~16
10~12
6~8
12.50
12.59
12.47
12.52
测试条件:压力8.2 MPa,空速1×104 h-1,温度425℃。
摘自《DNCA型低温低压氨合成催化剂研制及工业应用》
——杨万成 孙汝君
二、催化剂对化学平衡的影响
(1)使用催化剂,对化学平衡无影响。
(2)催化剂能缩短平衡到达的时间。
催化剂的作用
v正= v逆
v正
v逆
t1
t(s)
v
(mol·L-1·s-1)
0
t2
v”正 = v”逆
使用正催化剂
催化剂能同等程度地改变正、逆反应速率,不影响化学平衡的移动。
不改变反应混合物的百分含量;改变达到平衡的时间。
含量
t
t1
t2
追溯历史
如果改变影响化学平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
勒夏特列
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理。
①是“减弱”这种改变,不是“消除”这种改变;
②只适用于改变影响平衡的一个条件。
注意:
(如果改变多个条件时,要具体问题具体分析。)
1. 适用范围
适用于任何动态平衡体系
2. 常见条件
浓度、压强、温度三种条件变化
3. 移动结果
仅能削弱外界条件的影响,但不能消除影响。
4. 原理应用
选择恰当的温度、浓度、压强、催化剂等工艺条件,既有高产率(平衡移动决定)又能缩短生产周期(速率决定)。
三、化学平衡移动原理(勒夏特列原理)
一、温度对化学平衡的影响
1. 升高温度,反应速率加快,吸热反应增大的倍数大于放热反应增大的倍数,平衡向吸热的方向移动。
2. 降低温度,反应速率减慢,放热反应减小的倍数大于吸热反应减小的倍数,平衡向放热的方向移动。
知识小结
1. 适用范围
适用于任何动态平衡体系
2. 常见条件
浓度、压强、温度三种条件变化
3. 移动结果
仅能削弱外界条件的影响,但不能消除影响。
4. 原理应用
选择恰当的温度、浓度、压强、催化剂等工艺条件,既有高产率(平衡移动决定)又能缩短生产周期(速率决定)。
二、平衡移动原理
1. 已知反应 N2(g)+3H2(g) 2NH3(g) H=-92.4 kJ·mol-1,利用有关知识分析采取这些措施的原因。
(1)向反应器中注入过量N2
(2)采用适当的催化剂
(3)在高压下进行反应
(4)在较高温度下进行反应
平衡正向移动,提高反应物的转化率
增大反应速率,提高单位时间内的产率
反应速率加快,反应物的转化率提高
反应速率加快
巩固练习
2. 对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系的压强
C.升高温度 D.使用催化剂
C
3.下列各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为( )
A
A B C D
4. 在密闭容器中的可逆反应:CO(g)+ NO2(g) CO2(g)+NO(g) H<0 达平衡后,只改变下列的一个条件,填写有关的空白:
①增大容器的体积,平衡 ,c(NO2)将 ,反应混合物的颜色 。
②升高温度,平衡 ,体系的压强 。
③加入催化剂,平衡 ,NO2的物质的量 。
④通入O2,反应体系的颜色 ,NO的物质的量
。
⑤通入N2 ,体系压强 ,平衡 。
不移动
减小
变浅
逆向移动
增大
不移动
不变
先变深,后变浅
先减少,后增多
增大
不移动
本节内容结束
专题2 化学反应速率与化学平衡
第三单元 化学平衡的移动
第2课时 温度变化对化学平衡的影响 勒夏特列原理
1. 通过温度对可逆反应速率的影响,理解并掌握温度影响化学平衡移动的规律。
2. 了解催化剂影响化学反应速率的实质,并进一步探讨对化学平衡的影响,从而了解催化剂在化工生产中的应用。
学习目标
有的同学认为,在KSCN溶液与的FeCl3溶液的反应平衡体系中加入KCl晶体会对化学平衡有影响,而且平衡会逆向移动。你同意他的观点吗?
3SCN-+ Fe3+ Fe(SCN)3
此平衡中K+与Cl—没有参加反应
观点错误
一、温度变化对化学平衡的影响
(粉红色)
(蓝色)
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O
H>0
温度变化,颜色发生改变
化学平衡状态是否发生了改变?
知识梳理
粉红色
蓝色
加热
溶液变成蓝色
H>0
[Co(H2O)6]2+ (aq)+4Cl-(aq) [CoCl4]2-(aq)+6H2O (l)
步骤 溶液的颜色 平衡移动的方向
室温 紫色
热水
冷水
溶液变蓝
溶液变粉红色
向吸热反应方向移动
向放热反应方向移动
升温
降温
蓝色
吸热
放热
粉红色
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
升高温度
平衡向吸热方向移动
v’正 > v’逆
原因分析
v
t
v正= v逆
v’正
v’逆
v’’正= v’’ 逆
蓝色
粉红色
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
降低温度
平衡向放热方向移动
v’逆 > v’正
原因分析
蓝色
粉红色
[Co(H2O)6]2+ +4Cl— [CoCl4]2—+6H2O H>0
v
t
v正= v逆
v’正
v’逆
v’’正= v’’逆
1. 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。
2. 在其它条件不变的情况下,升高温度,正逆速率都增大。
3. 在其它条件不变的情况下,升高温度,正逆速率增大倍数不同,可由平衡移动方向反推。
归纳
催化剂型号
氨浓度稳定时所需时间/h
出口氨的体积分数/%
A20-1
74-1
A110-1
DNCA
16~20
12~16
10~12
6~8
12.50
12.59
12.47
12.52
测试条件:压力8.2 MPa,空速1×104 h-1,温度425℃。
摘自《DNCA型低温低压氨合成催化剂研制及工业应用》
——杨万成 孙汝君
二、催化剂对化学平衡的影响
(1)使用催化剂,对化学平衡无影响。
(2)催化剂能缩短平衡到达的时间。
催化剂的作用
v正= v逆
v正
v逆
t1
t(s)
v
(mol·L-1·s-1)
0
t2
v”正 = v”逆
使用正催化剂
催化剂能同等程度地改变正、逆反应速率,不影响化学平衡的移动。
不改变反应混合物的百分含量;改变达到平衡的时间。
含量
t
t1
t2
追溯历史
如果改变影响化学平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
勒夏特列
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理。
①是“减弱”这种改变,不是“消除”这种改变;
②只适用于改变影响平衡的一个条件。
注意:
(如果改变多个条件时,要具体问题具体分析。)
1. 适用范围
适用于任何动态平衡体系
2. 常见条件
浓度、压强、温度三种条件变化
3. 移动结果
仅能削弱外界条件的影响,但不能消除影响。
4. 原理应用
选择恰当的温度、浓度、压强、催化剂等工艺条件,既有高产率(平衡移动决定)又能缩短生产周期(速率决定)。
三、化学平衡移动原理(勒夏特列原理)
一、温度对化学平衡的影响
1. 升高温度,反应速率加快,吸热反应增大的倍数大于放热反应增大的倍数,平衡向吸热的方向移动。
2. 降低温度,反应速率减慢,放热反应减小的倍数大于吸热反应减小的倍数,平衡向放热的方向移动。
知识小结
1. 适用范围
适用于任何动态平衡体系
2. 常见条件
浓度、压强、温度三种条件变化
3. 移动结果
仅能削弱外界条件的影响,但不能消除影响。
4. 原理应用
选择恰当的温度、浓度、压强、催化剂等工艺条件,既有高产率(平衡移动决定)又能缩短生产周期(速率决定)。
二、平衡移动原理
1. 已知反应 N2(g)+3H2(g) 2NH3(g) H=-92.4 kJ·mol-1,利用有关知识分析采取这些措施的原因。
(1)向反应器中注入过量N2
(2)采用适当的催化剂
(3)在高压下进行反应
(4)在较高温度下进行反应
平衡正向移动,提高反应物的转化率
增大反应速率,提高单位时间内的产率
反应速率加快,反应物的转化率提高
反应速率加快
巩固练习
2. 对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系的压强
C.升高温度 D.使用催化剂
C
3.下列各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为( )
A
A B C D
4. 在密闭容器中的可逆反应:CO(g)+ NO2(g) CO2(g)+NO(g) H<0 达平衡后,只改变下列的一个条件,填写有关的空白:
①增大容器的体积,平衡 ,c(NO2)将 ,反应混合物的颜色 。
②升高温度,平衡 ,体系的压强 。
③加入催化剂,平衡 ,NO2的物质的量 。
④通入O2,反应体系的颜色 ,NO的物质的量
。
⑤通入N2 ,体系压强 ,平衡 。
不移动
减小
变浅
逆向移动
增大
不移动
不变
先变深,后变浅
先减少,后增多
增大
不移动
本节内容结束
