实验7粗盐的提纯同步练习(有答案)仁爱版化学九年级下册
文档属性
| 名称 | 实验7粗盐的提纯同步练习(有答案)仁爱版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 157.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 21:49:07 | ||
图片预览




文档简介
实验7粗盐的提纯同步练习仁爱版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列实验操作或方法能达到实验目的是( )
选项 实验目的 实验操作或方法
A 鉴别稀硫酸和浓盐酸溶液 用小木棍分别蘸取液体
B 从粗盐中得到纯净的氯化钠 溶解、过滤、洗涤、干燥
C 检验氢氧化钠变质的情况 先加过量的氯化钡,过滤后向滤液中加入酚酞
D 除去 CO2 中含有的少量 CO 点燃
A.A B.B C.C D.D
2.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥砂,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液.下列操作顺序中最合适的是
A.②④⑤①③ B.⑤④②③① C.⑤②④③① D.②⑤④①③
3.某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液 B.Y为Na2CO3
C.Z为稀盐酸 D.步骤②与④可交换
4.关于粗盐提纯的实验,说法正确的是( )
A.粗盐不可以放在烧杯里称量
B.蒸发皿不可以直接加热
C.蒸发时发现有固体开始析出,即停止加热
D.涉及的分离操作有溶解、过滤和蒸发
5.在“粗盐中难溶性杂质去除”实验中,操作错误的是
A.称量时,在托盘天平左右两盘垫上相同质量的纸片
B.溶解时,用玻璃棒搅拌加快粗盐溶解
C.过滤时,用玻璃棒搅拌漏斗内的液体加快过滤
D.蒸发时,当蒸发皿中出现较多固体时停止加热
6.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
7.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
8.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
9.粗盐初步提纯的操作步骤如图所示,相关说法错误的是( )
A.溶解时玻璃棒用于搅拌
B.过滤时玻璃棒用于引流
C.蒸发至滤液被蒸干后再移去酒精灯
D.图中“操作1”是称量
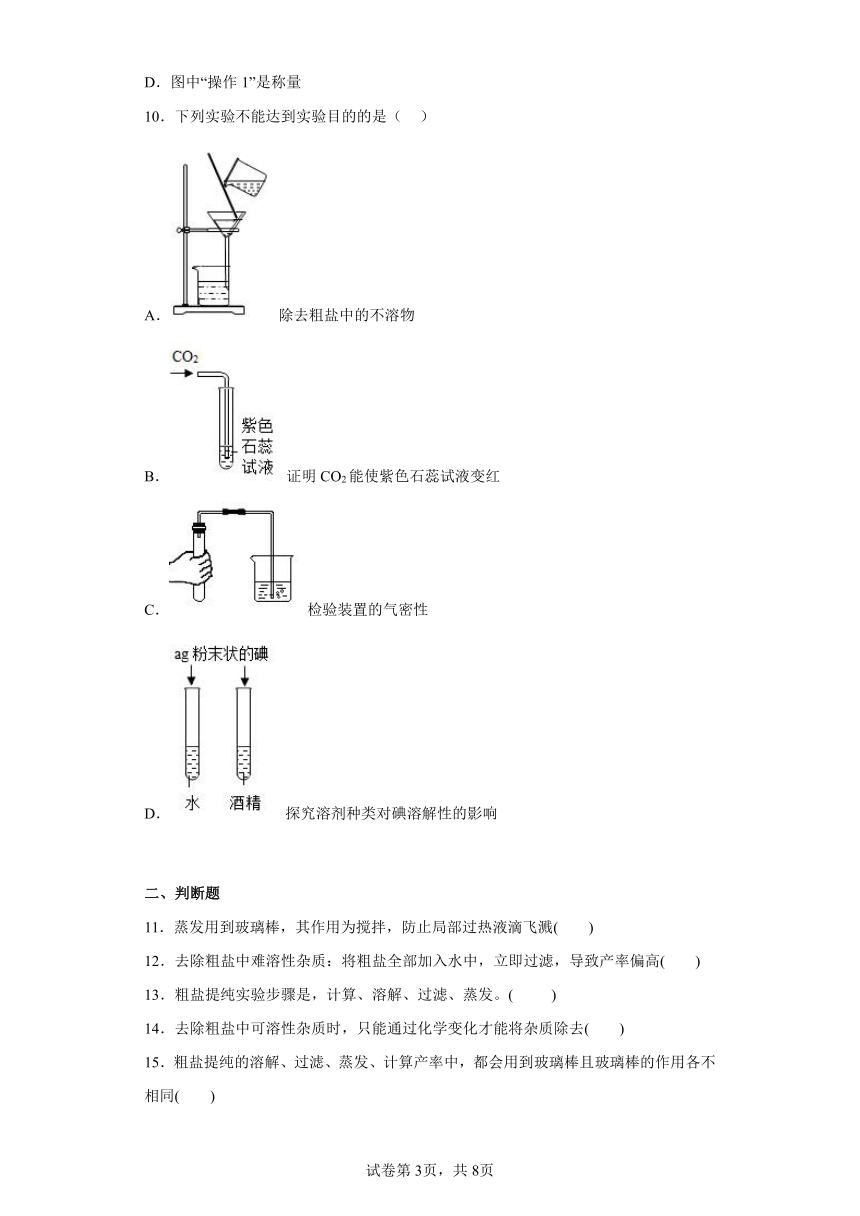
10.下列实验不能达到实验目的的是( )
A. 除去粗盐中的不溶物
B. 证明CO2能使紫色石蕊试液变红
C. 检验装置的气密性
D. 探究溶剂种类对碘溶解性的影响
二、判断题
11.蒸发用到玻璃棒,其作用为搅拌,防止局部过热液滴飞溅( )
12.去除粗盐中难溶性杂质:将粗盐全部加入水中,立即过滤,导致产率偏高( )
13.粗盐提纯实验步骤是,计算、溶解、过滤、蒸发。( )
14.去除粗盐中可溶性杂质时,只能通过化学变化才能将杂质除去( )
15.粗盐提纯的溶解、过滤、蒸发、计算产率中,都会用到玻璃棒且玻璃棒的作用各不相同( )
三、填空题
16.如图是两种常见物质的溶解度曲线,请回答:
(1)t1℃时,两物质中溶解度较大的是_______。
(2)t2℃时,硝酸钾饱和溶液中溶质的质量分数________氯化钾饱和溶液中溶质质量的分数(填“>”、“=”或“<”)。
(3)t3℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的______(填“饱和”或“不饱和”)溶液。保持温度不变,向该烧杯中再加入10g水,充分搅拌后,氯化钾溶液中溶质的质量分数__(填“变大”“不变”或“变小”)。
(4)现有t3℃时等质量的硝酸钾、氯化钾饱和溶液,加热蒸发等质量的水后恢复至t3℃,剩余溶液的质量关系大小为硝酸钾溶液______氯化钾溶液(填“>”、“=”或“<”)。
(5)某同学配制15g溶质质量分数为10%的氯化钾溶液。配制过程有以下步骤:a.称量及量取b.计算c.溶解d.装瓶贴标签,正确顺序是_______(填序号):将15g10%的氯化钾溶液配成含氯化钾0.3%的溶液,得到氯化钾溶液______g。
17.下图是去除粗盐中难溶性杂质实验的三步操作。
A.溶解 B. C.过滤
(1)B的操作名称是______。
(2)三步操作的正确顺序是______(填序号)。
(3)B中,用玻璃棒不断搅拌的目的是_______。
18.粗盐提纯各操作注意事项:
(1)称量时:______使用时要调节平衡,读数要准确,取药品要规范,不撒落。
(2)溶解时:搅拌要匀速,不能过快,防止______。
(3)过滤时:要规范装置和操作,做到“______”。
(4)蒸发时:不断搅拌,防止______;______时,停止加热。
转移时:要全部转移进行准确称量。
19.结合《粗盐中难溶性杂质的去除》实验活动,回答问题。
(1)粗盐的溶解:粗盐的溶解操作中,用玻璃棒搅拌的主要原因是___________;
(2)过滤:过滤后,从外观上看更加澄清的是___________(选填“过滤前的液体”或“滤液”);
(3)蒸发:将滤液倒入蒸发皿时不小心洒出少许,滤液蒸发操作中,当观察到___________现象时,就可以停止加热;
(4)计算产率:按上述操作,精盐的产率比理论值___________(选填“偏大”、“偏小”或“不变”)。
20.连云港海洋资源丰富,应用前景广阔。
(1)海水晒盐。下图是利用海水提取粗盐的过程:
①“蒸发池”中质量逐渐减少的物质是_______(填化学式)。
②实验室里除去粗盐中难溶性杂质一般步骤为溶解、过滤、蒸发,这三种基本操作中都要使用的玻璃仪器是_______。
③析出晶体后的“母液”是氯化钠的_______(选填“饱和溶液”或“不饱和溶液”)。母液中含有MgC12,向母液中加入澄清石灰水有白色沉淀生成,该复分解反应的化学方程式为_______。
(2)海底探物。海底埋藏着大量的“可燃冰”,其主要成分是甲烷水合物(由甲烷分子和水分子组成),还含有少量的CO2等气体。
①下列说法正确的是_______(填字母)。
a.可燃冰和干冰都属于混合物
b.可燃冰与煤相比是较清洁燃料
c.可燃冰和石油都属于可再生能源
②利用CH4和H2O进行催化重整制氢气,反应前后分子变化的微观示意图如图所示。其中“乙→丙”发生反应的化学方程式为_______。
四、综合应用题
21.氯化钠是重要的工业原料,在生产、生活中具有广泛的用途。
(1)如图所示是钠元素和氯元素在元素周期表中的部分信息,下列有关说法正确的是 (填字母)
A.钠属于非金属元素 B.钠原子的中子数为11
C.氯元素的原子序数为17 D.氯的相对原子质量为35.45g
(2)同学们在实验室用氯化钠固体配制100g溶质质量分数为5%的氯化钠溶液,操作步骤如下图所示。
①该实验的正确操作步骤是______(填字母)。
②需要称取氯化钠的质量为______g.
③实验结束后对所配制的溶液进行检测发现溶质质量分数偏小,写出一种可能的原因:________。
(3)某粗盐水中含有杂质MgCl2、CaCl2,为得到NaCl固体,兴趣小组的同学设计了如下实验流程。
①操作b中需要的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和_____。
②步骤Ⅰ中发生反应的化学方程式为______。
③进行操作a后所得滤液中的溶质是_____(填化学式)。
(4)市售的食用纯碱往往含有少量氯化钠,小组同学取某品牌食用纯碱11g,加入盛有100g稀盐酸的烧杯中,恰好完全反应,称量烧杯内物质的总质量为106.6g。计算11g该食用纯碱中Na2CO3的质量_____。
22.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是______;
(2)操作①②③都要用到的一种玻璃仪器是_____,在操作③中,使用这种玻璃仪器的目的是____________.
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是_______(只写一种原因).
(4)用提纯所得的氯化钠溶液配制100g6%的氯化钠溶液,若实际所配溶液溶质质量分数大于6%,可能的原因是________(填字母编号).
a、称量氯化钠所用天平砝码沾有杂质;b、用量筒取水时俯视读数;c、用量筒取水时仰视读数;d、配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04g/cm3),配制16g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液______ml(结果保留小数点后一位).
23.氯化钠是食盐的主要成分,广泛应用于生产生活。
(1)氯化钠是重要的调味品也是重要的化工原料。工业上电解饱和食盐水可制得氢氧化钠、氢气和氯气,写出该反应的化学方程式________。
(2)海水晒盐可获得粗盐,制得的粗盐中常含有泥沙等杂质。要除去粗盐中泥沙等难溶性杂质可使用下列六步操作,正确的操作顺序为______ (填序号)。操作④中判断停止加热的依据是________。
(3)要除去粗盐中MgCl2、CaCl2、Na2SO4等可溶性杂质,得到纯净的NaCl,还需要依次加入过量的NaOH溶液,过量的BaCl2溶液以及过量的Na2CO3溶液,过滤后再加入过量的稀盐酸等。用化学方程式说明加入过量Na2CO3溶液的作用:Na2CO3+CaCl2=2NaCl+CaCO3↓、________。稀盐酸一般在沉淀过滤后加入,原因是______。
(4)已知,20℃时,氯化钠的溶解度为36.0g。20℃时,将20g氯化钠放入盛有50g蒸馏水的烧杯中,充分搅拌后所得溶液的溶质质量分数为______(精确到0.1%)。若将上述烧杯内的物质配成农业选种所需的NaCl溶液(溶质质量分数为16%),采用的最简便的方法是_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.D
5.C
6.A
7.A
8.C
9.C
10.B
11.正确
12.错误
13.错误
14.错误
15.正确
16.(1)氯化钾
(2)=
(3) 饱和 不变
(4)<
(5) bacd 500
17.(1)蒸发
(2)ACB
(3)防止因局部温度过高,造成液滴飞溅
18.(1)托盘天平
(2)有液体溅出
(3)一贴二低三靠
(4) 局部温度过高,造成液滴飞溅 出现较多固体
19.(1)加速溶解
(2)滤液
(3)大部分固体析出
(4)偏小
20.(1) H2O 玻璃棒 饱和溶液
(2) b
21.(1)C
(2) CBDEA 5 量取水时仰视量筒读数
(3) 蒸发皿 Na2CO3、NaOH和NaCl
(4)解:设11g该食用纯碱中Na2CO3的质量是x。
生成二氧化碳质量=(11g+100g) 106.6g=4.4g
答:碳酸钠是10.6g。
22. 过滤 玻璃棒 防止液体外溅 蒸发溶液时液体外溅了一部分等 ab##ba 7.7
23.(1)
(2) ①⑤②③⑥④ 当蒸发皿中出现较多固体时
(3) 稀盐酸会与沉淀反应,再次转化为可溶性杂质
(4) 26.5% 加入62.5g水
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列实验操作或方法能达到实验目的是( )
选项 实验目的 实验操作或方法
A 鉴别稀硫酸和浓盐酸溶液 用小木棍分别蘸取液体
B 从粗盐中得到纯净的氯化钠 溶解、过滤、洗涤、干燥
C 检验氢氧化钠变质的情况 先加过量的氯化钡,过滤后向滤液中加入酚酞
D 除去 CO2 中含有的少量 CO 点燃
A.A B.B C.C D.D
2.为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥砂,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液.下列操作顺序中最合适的是
A.②④⑤①③ B.⑤④②③① C.⑤②④③① D.②⑤④①③
3.某同学为除去食盐水中的Na2SO4杂质,进行了以下实验:
下列有关说法错误的是( )
A.X为BaCl2溶液 B.Y为Na2CO3
C.Z为稀盐酸 D.步骤②与④可交换
4.关于粗盐提纯的实验,说法正确的是( )
A.粗盐不可以放在烧杯里称量
B.蒸发皿不可以直接加热
C.蒸发时发现有固体开始析出,即停止加热
D.涉及的分离操作有溶解、过滤和蒸发
5.在“粗盐中难溶性杂质去除”实验中,操作错误的是
A.称量时,在托盘天平左右两盘垫上相同质量的纸片
B.溶解时,用玻璃棒搅拌加快粗盐溶解
C.过滤时,用玻璃棒搅拌漏斗内的液体加快过滤
D.蒸发时,当蒸发皿中出现较多固体时停止加热
6.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
7.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
8.下图是某实验小组做粗盐提纯实验的部分操作示意图。下列有关实验叙述错误的是
A.④中缺少玻璃棒引流溶液
B.①中玻璃棒的作用是搅拌,加速粗盐溶解
C.上述操作顺序为③①②④
D.当②蒸发皿中出现较多固体时,停止加热
9.粗盐初步提纯的操作步骤如图所示,相关说法错误的是( )
A.溶解时玻璃棒用于搅拌
B.过滤时玻璃棒用于引流
C.蒸发至滤液被蒸干后再移去酒精灯
D.图中“操作1”是称量
10.下列实验不能达到实验目的的是( )
A. 除去粗盐中的不溶物
B. 证明CO2能使紫色石蕊试液变红
C. 检验装置的气密性
D. 探究溶剂种类对碘溶解性的影响
二、判断题
11.蒸发用到玻璃棒,其作用为搅拌,防止局部过热液滴飞溅( )
12.去除粗盐中难溶性杂质:将粗盐全部加入水中,立即过滤,导致产率偏高( )
13.粗盐提纯实验步骤是,计算、溶解、过滤、蒸发。( )
14.去除粗盐中可溶性杂质时,只能通过化学变化才能将杂质除去( )
15.粗盐提纯的溶解、过滤、蒸发、计算产率中,都会用到玻璃棒且玻璃棒的作用各不相同( )
三、填空题
16.如图是两种常见物质的溶解度曲线,请回答:
(1)t1℃时,两物质中溶解度较大的是_______。
(2)t2℃时,硝酸钾饱和溶液中溶质的质量分数________氯化钾饱和溶液中溶质质量的分数(填“>”、“=”或“<”)。
(3)t3℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的______(填“饱和”或“不饱和”)溶液。保持温度不变,向该烧杯中再加入10g水,充分搅拌后,氯化钾溶液中溶质的质量分数__(填“变大”“不变”或“变小”)。
(4)现有t3℃时等质量的硝酸钾、氯化钾饱和溶液,加热蒸发等质量的水后恢复至t3℃,剩余溶液的质量关系大小为硝酸钾溶液______氯化钾溶液(填“>”、“=”或“<”)。
(5)某同学配制15g溶质质量分数为10%的氯化钾溶液。配制过程有以下步骤:a.称量及量取b.计算c.溶解d.装瓶贴标签,正确顺序是_______(填序号):将15g10%的氯化钾溶液配成含氯化钾0.3%的溶液,得到氯化钾溶液______g。
17.下图是去除粗盐中难溶性杂质实验的三步操作。
A.溶解 B. C.过滤
(1)B的操作名称是______。
(2)三步操作的正确顺序是______(填序号)。
(3)B中,用玻璃棒不断搅拌的目的是_______。
18.粗盐提纯各操作注意事项:
(1)称量时:______使用时要调节平衡,读数要准确,取药品要规范,不撒落。
(2)溶解时:搅拌要匀速,不能过快,防止______。
(3)过滤时:要规范装置和操作,做到“______”。
(4)蒸发时:不断搅拌,防止______;______时,停止加热。
转移时:要全部转移进行准确称量。
19.结合《粗盐中难溶性杂质的去除》实验活动,回答问题。
(1)粗盐的溶解:粗盐的溶解操作中,用玻璃棒搅拌的主要原因是___________;
(2)过滤:过滤后,从外观上看更加澄清的是___________(选填“过滤前的液体”或“滤液”);
(3)蒸发:将滤液倒入蒸发皿时不小心洒出少许,滤液蒸发操作中,当观察到___________现象时,就可以停止加热;
(4)计算产率:按上述操作,精盐的产率比理论值___________(选填“偏大”、“偏小”或“不变”)。
20.连云港海洋资源丰富,应用前景广阔。
(1)海水晒盐。下图是利用海水提取粗盐的过程:
①“蒸发池”中质量逐渐减少的物质是_______(填化学式)。
②实验室里除去粗盐中难溶性杂质一般步骤为溶解、过滤、蒸发,这三种基本操作中都要使用的玻璃仪器是_______。
③析出晶体后的“母液”是氯化钠的_______(选填“饱和溶液”或“不饱和溶液”)。母液中含有MgC12,向母液中加入澄清石灰水有白色沉淀生成,该复分解反应的化学方程式为_______。
(2)海底探物。海底埋藏着大量的“可燃冰”,其主要成分是甲烷水合物(由甲烷分子和水分子组成),还含有少量的CO2等气体。
①下列说法正确的是_______(填字母)。
a.可燃冰和干冰都属于混合物
b.可燃冰与煤相比是较清洁燃料
c.可燃冰和石油都属于可再生能源
②利用CH4和H2O进行催化重整制氢气,反应前后分子变化的微观示意图如图所示。其中“乙→丙”发生反应的化学方程式为_______。
四、综合应用题
21.氯化钠是重要的工业原料,在生产、生活中具有广泛的用途。
(1)如图所示是钠元素和氯元素在元素周期表中的部分信息,下列有关说法正确的是 (填字母)
A.钠属于非金属元素 B.钠原子的中子数为11
C.氯元素的原子序数为17 D.氯的相对原子质量为35.45g
(2)同学们在实验室用氯化钠固体配制100g溶质质量分数为5%的氯化钠溶液,操作步骤如下图所示。
①该实验的正确操作步骤是______(填字母)。
②需要称取氯化钠的质量为______g.
③实验结束后对所配制的溶液进行检测发现溶质质量分数偏小,写出一种可能的原因:________。
(3)某粗盐水中含有杂质MgCl2、CaCl2,为得到NaCl固体,兴趣小组的同学设计了如下实验流程。
①操作b中需要的仪器有铁架台(含铁圈)、酒精灯、玻璃棒和_____。
②步骤Ⅰ中发生反应的化学方程式为______。
③进行操作a后所得滤液中的溶质是_____(填化学式)。
(4)市售的食用纯碱往往含有少量氯化钠,小组同学取某品牌食用纯碱11g,加入盛有100g稀盐酸的烧杯中,恰好完全反应,称量烧杯内物质的总质量为106.6g。计算11g该食用纯碱中Na2CO3的质量_____。
22.同学们在实验室对含有泥沙的粗盐进行提纯,实验的基本流程如下:
(1)操作②的名称是______;
(2)操作①②③都要用到的一种玻璃仪器是_____,在操作③中,使用这种玻璃仪器的目的是____________.
(3)计算所获得的氯化钠产率,发现产率偏低,由实验不当导致的可能原因是_______(只写一种原因).
(4)用提纯所得的氯化钠溶液配制100g6%的氯化钠溶液,若实际所配溶液溶质质量分数大于6%,可能的原因是________(填字母编号).
a、称量氯化钠所用天平砝码沾有杂质;b、用量筒取水时俯视读数;c、用量筒取水时仰视读数;d、配制溶液的烧杯用蒸馏水润洗过
(5)若用6%的氯化钠溶液(密度为1.04g/cm3),配制16g质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液______ml(结果保留小数点后一位).
23.氯化钠是食盐的主要成分,广泛应用于生产生活。
(1)氯化钠是重要的调味品也是重要的化工原料。工业上电解饱和食盐水可制得氢氧化钠、氢气和氯气,写出该反应的化学方程式________。
(2)海水晒盐可获得粗盐,制得的粗盐中常含有泥沙等杂质。要除去粗盐中泥沙等难溶性杂质可使用下列六步操作,正确的操作顺序为______ (填序号)。操作④中判断停止加热的依据是________。
(3)要除去粗盐中MgCl2、CaCl2、Na2SO4等可溶性杂质,得到纯净的NaCl,还需要依次加入过量的NaOH溶液,过量的BaCl2溶液以及过量的Na2CO3溶液,过滤后再加入过量的稀盐酸等。用化学方程式说明加入过量Na2CO3溶液的作用:Na2CO3+CaCl2=2NaCl+CaCO3↓、________。稀盐酸一般在沉淀过滤后加入,原因是______。
(4)已知,20℃时,氯化钠的溶解度为36.0g。20℃时,将20g氯化钠放入盛有50g蒸馏水的烧杯中,充分搅拌后所得溶液的溶质质量分数为______(精确到0.1%)。若将上述烧杯内的物质配成农业选种所需的NaCl溶液(溶质质量分数为16%),采用的最简便的方法是_________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.D
5.C
6.A
7.A
8.C
9.C
10.B
11.正确
12.错误
13.错误
14.错误
15.正确
16.(1)氯化钾
(2)=
(3) 饱和 不变
(4)<
(5) bacd 500
17.(1)蒸发
(2)ACB
(3)防止因局部温度过高,造成液滴飞溅
18.(1)托盘天平
(2)有液体溅出
(3)一贴二低三靠
(4) 局部温度过高,造成液滴飞溅 出现较多固体
19.(1)加速溶解
(2)滤液
(3)大部分固体析出
(4)偏小
20.(1) H2O 玻璃棒 饱和溶液
(2) b
21.(1)C
(2) CBDEA 5 量取水时仰视量筒读数
(3) 蒸发皿 Na2CO3、NaOH和NaCl
(4)解:设11g该食用纯碱中Na2CO3的质量是x。
生成二氧化碳质量=(11g+100g) 106.6g=4.4g
答:碳酸钠是10.6g。
22. 过滤 玻璃棒 防止液体外溅 蒸发溶液时液体外溅了一部分等 ab##ba 7.7
23.(1)
(2) ①⑤②③⑥④ 当蒸发皿中出现较多固体时
(3) 稀盐酸会与沉淀反应,再次转化为可溶性杂质
(4) 26.5% 加入62.5g水
答案第1页,共2页
答案第1页,共2页
