2023化学苏教版选择性必修一 3.1.2 电离平衡常数 强酸与弱酸的比较 课件(共38张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 3.1.2 电离平衡常数 强酸与弱酸的比较 课件(共38张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 967.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 22:26:06 | ||
图片预览











文档简介
(共38张PPT)
第2课时 电离平衡常数 强酸与弱酸的比较
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
学习目标
1.了解弱电解质的电离平衡常数概念和电离平衡常数与电离程度的关系。
2.了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱。
核心素养
变化观念与平衡思想:
能利用电离常数比较弱电解质的强弱、判断电离平衡移动的方向。
证据推理与模型认知:
能收集相关证据,利用证据建立 “强酸制弱酸”的思维模型。
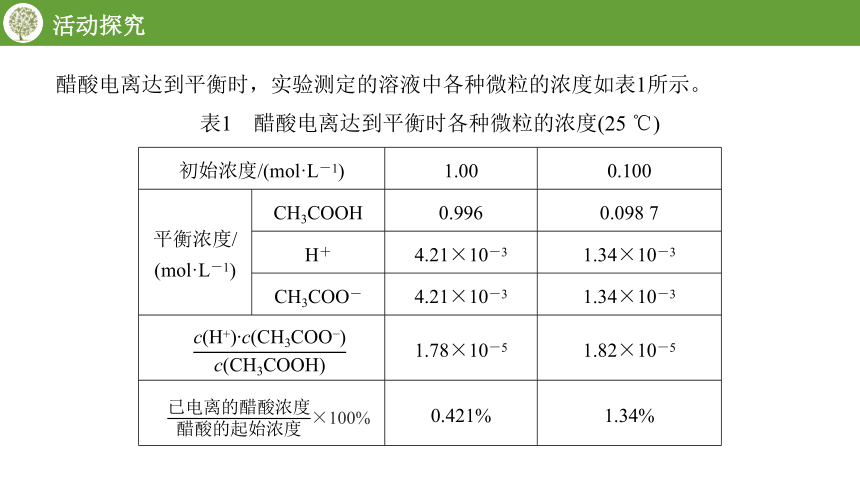
活动探究
初始浓度/(mol·L-1) 1.00 0.100
平衡浓度/ (mol·L-1) CH3COOH 0.996 0.098 7
H+ 4.21×10-3 1.34×10-3
CH3COO- 4.21×10-3 1.34×10-3
1.78×10-5 1.82×10-5
0.421% 1.34%
醋酸电离达到平衡时,实验测定的溶液中各种微粒的浓度如表1所示。
表1 醋酸电离达到平衡时各种微粒的浓度(25 ℃)
×100%
CH3COOH H2CO3 H3BO3
1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 5.81×10-10
表2 几种弱酸的电离平衡常数(25 ℃)
思考交流
归纳总结
一、弱电解质的电离平衡常数和电离度
1.电离常数的概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的弱电解质分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示(弱酸通常用Ka表示,弱碱通常用Kb表示)。
巩固练习
B
B
能力提升
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 2.95×10-8
25 ℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
提示:弱酸的电离平衡常数越大,酸性相对越强,由于K(CH3COOH)>Ka1(H2CO3) >K(HClO),则酸性由强到弱的顺序:CH3COOH>H2CO3>HClO。
举一反三
D
上一级电离产生的H+对下一级电离起抑制作用
增大
K值越大,电离出的氢离子浓度越大,所以酸性越强
H3PO4
Ka1 Ka2 Ka3
HS-
当堂检测
C
2.25 ℃时不断将水滴入0.1 mol·L-1的氨水中,下列图像变化合理的是 ( )
C
B
弱酸 HCOOH HCN H2CO3
电离常数/ (25 ℃) Ka=1.8×10-4 Ka=4.93×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为
______________________________。
(2)向NaCN溶液中通入CO2气体能否制得HCN?______。若能写出反应的化学
方程式;若不能,此问可不答。___________________________________。
(3)同浓度的HCOO-、、、CN-结合H+的能力由强到弱的顺序是
____________________________________________________________________。
4.已知氢氰酸及部分弱酸的电离常数如下表所示:
HCOOH>H2CO3>HCN
能
NaCN+H2O+CO2===HCN+NaHCO3
>CN->>HCOO-
弱酸 HCOOH HCN H2CO3
电离常数/ (25 ℃) Ka=1.8×10-4 Ka=4.93×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11
4.已知氢氰酸及部分弱酸的电离常数如下表所示:
(4)①升高0.1 mol·L-1 HCN溶液的温度,HCN的电离程度如何变化?
____________________________________________________。
②加水稀释,如何变化?________________________________。
升高温度,HCN的电离程度增大
加水稀释,增大
本节内容结束
第2课时 电离平衡常数 强酸与弱酸的比较
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
学习目标
1.了解弱电解质的电离平衡常数概念和电离平衡常数与电离程度的关系。
2.了解常见弱酸和弱碱的电离常数大小,能比较它们的电离能力强弱。
核心素养
变化观念与平衡思想:
能利用电离常数比较弱电解质的强弱、判断电离平衡移动的方向。
证据推理与模型认知:
能收集相关证据,利用证据建立 “强酸制弱酸”的思维模型。
活动探究
初始浓度/(mol·L-1) 1.00 0.100
平衡浓度/ (mol·L-1) CH3COOH 0.996 0.098 7
H+ 4.21×10-3 1.34×10-3
CH3COO- 4.21×10-3 1.34×10-3
1.78×10-5 1.82×10-5
0.421% 1.34%
醋酸电离达到平衡时,实验测定的溶液中各种微粒的浓度如表1所示。
表1 醋酸电离达到平衡时各种微粒的浓度(25 ℃)
×100%
CH3COOH H2CO3 H3BO3
1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 5.81×10-10
表2 几种弱酸的电离平衡常数(25 ℃)
思考交流
归纳总结
一、弱电解质的电离平衡常数和电离度
1.电离常数的概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的弱电解质分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示(弱酸通常用Ka表示,弱碱通常用Kb表示)。
巩固练习
B
B
能力提升
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 2.95×10-8
25 ℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
提示:弱酸的电离平衡常数越大,酸性相对越强,由于K(CH3COOH)>Ka1(H2CO3) >K(HClO),则酸性由强到弱的顺序:CH3COOH>H2CO3>HClO。
举一反三
D
上一级电离产生的H+对下一级电离起抑制作用
增大
K值越大,电离出的氢离子浓度越大,所以酸性越强
H3PO4
Ka1 Ka2 Ka3
HS-
当堂检测
C
2.25 ℃时不断将水滴入0.1 mol·L-1的氨水中,下列图像变化合理的是 ( )
C
B
弱酸 HCOOH HCN H2CO3
电离常数/ (25 ℃) Ka=1.8×10-4 Ka=4.93×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11
(1)依据表格中三种酸的电离常数,判断三种酸酸性强弱的顺序为
______________________________。
(2)向NaCN溶液中通入CO2气体能否制得HCN?______。若能写出反应的化学
方程式;若不能,此问可不答。___________________________________。
(3)同浓度的HCOO-、、、CN-结合H+的能力由强到弱的顺序是
____________________________________________________________________。
4.已知氢氰酸及部分弱酸的电离常数如下表所示:
HCOOH>H2CO3>HCN
能
NaCN+H2O+CO2===HCN+NaHCO3
>CN->>HCOO-
弱酸 HCOOH HCN H2CO3
电离常数/ (25 ℃) Ka=1.8×10-4 Ka=4.93×10-10 Ka1=4.3×10-7
Ka2=5.6×10-11
4.已知氢氰酸及部分弱酸的电离常数如下表所示:
(4)①升高0.1 mol·L-1 HCN溶液的温度,HCN的电离程度如何变化?
____________________________________________________。
②加水稀释,如何变化?________________________________。
升高温度,HCN的电离程度增大
加水稀释,增大
本节内容结束
