2023化学苏教版选择性必修一 3.1.3 水的电离平衡 课件(共17张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 3.1.3 水的电离平衡 课件(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 894.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 22:27:56 | ||
图片预览






文档简介
(共17张PPT)
第3课时 水的电离平衡
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
一、水的电离
水是一种极弱的电解质,能微弱的电离:
知识梳理
H2O+H2O H3O++OH-
H2O H++OH-
所以K电离× c(H2O)= c (H+)×c (OH-)
Kw为一个新的常数,称为水的离子积常数。
水的浓度为常数, K电离也是常数
= Kw
电离常数: K电离=
c(H+)×c(OH-)
c(H2O)
H2O H++OH-
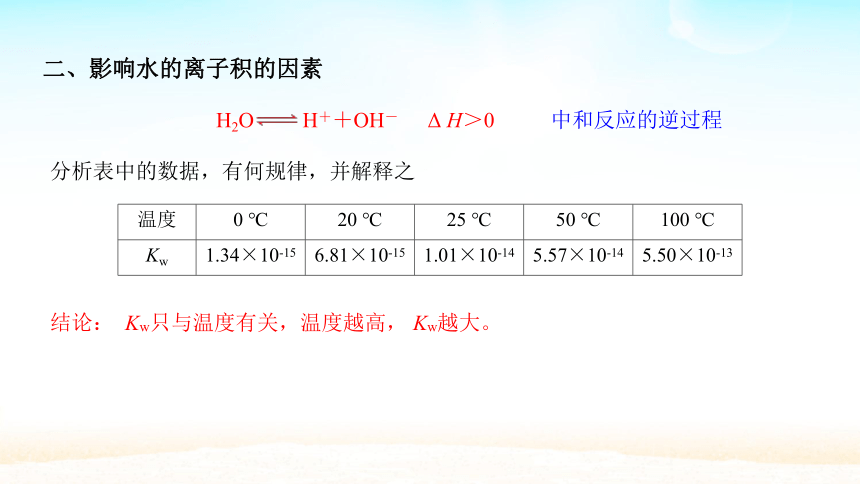
分析表中的数据,有何规律,并解释之
结论:
Kw只与温度有关,温度越高, Kw越大。
Δ H>0
中和反应的逆过程
二、影响水的离子积的因素
H2O H++OH-
温度 0 ℃ 20 ℃ 25 ℃ 50 ℃ 100 ℃
Kw 1.34×10-15 6.81×10-15 1.01×10-14 5.57×10-14 5.50×10-13
思考:
1.Kw = c(H+)×c(OH-)公式只适用于纯水吗?
2.公式中的c(H+)和c(OH-)指的是由水电离的c(H+)和c(OH-)吗?
溶液 pH 溶液中c(H+) mol/L 溶液中c(OH-) mol/L c(H+)· c(OH-)
纯水 7
0.1 mol/L NaOH溶液 13
已知:25℃下Kw= 1.0×10-14
1×10-7
1×10-13
1×10-7
0.1
1.0×10-14
1.0×10-14
水的离子积既适用于纯水,又适用于其他电解质稀溶液;常温下任何稀溶液,
Kw=c(H+)×c(OH-)=1×10-14,Kw中的c(OH-) 、c(H+ )指溶液中总的离子浓度。
已知:25℃下Kw =1.0×10-14,任何溶液中水电离出的c水(H+) =c水(OH-)
1.0.1 mol/L的HCl溶液中,求由水电离出来的c水(H+) ?
HCl=== H+ + Cl-
c(H+)=0.1 mol/L
c水(OH-)=1×10-13 mol/L
c水(H+)=c水(OH-)=1×10-13 mol/L
Kw=c(H+)×c(OH-)=1×10-14
酸溶液中由水电离的c水(H+),要看溶液中的c(OH-)。
H2O H+ + OH-
NaOH === Na+ + OH-
c(OH-)=1 mol/L
c水(H+)=1×10-14 mol/L
c水(OH-)=c水(H+)=1×10-14 mol/L
碱溶液中由水电离的c水(OH-) ,要看溶液中的c(H+)。
2.25℃时,Kw=1×10-14,1 mol/L的NaOH溶液中,求由水电离出来的c(OH-) ?
H2O H+ + OH-
Kw=c(H+)×c(OH-)=1×10-14
课堂练习:
1.25℃时,Kw=1×10-14,求纯水中c(H+)、c(OH-)?
2.100℃时,纯水中c(OH-) =1×10-6 mol/L,求c(H+)、Kw?
c(H+) =c(OH-) =1×10-7 mol/L
c(H+) =c(OH-) =1×10-6 mol/L
Kw=c(H+)×c(OH-) =1×10-12
思考:
影响水的电离平衡移动的因素有哪些
温度、改变c(H+)或c(OH-)
三、影响水的电离平衡移动的因素
H2O H+ + OH-
平衡移动方向 电离程度 c(H+) c(OH-) Kw
升温
加活泼金属
加酸 (可电离出H+)
加碱 (可电离出OH-)
加弱碱阳离子 (可与OH-反应)
加弱酸阴离子 (可与H+反应)
H2O H+ + OH-
右移
增大
增大
增大
增大
右移
增大
减小
增大
不变
左移
减小
增大
减小
不变
左移
减小
减小
增大
不变
右移
增大
增大
减小
不变
右移
增大
减小
增大
不变
增大c(OH- )(加碱)
增大c(H+)(加酸或强酸酸式盐)
减小c(H+) :加含 、S2-、 CH3COO-、的盐
减小c(OH- ) :加含 、Fe3+、 Cu2+、 Al3+的盐
升高温度
降低温度
抑制水电离
促进水电离
知识小结
B
当堂检测
1.下列物质加入水中,不影响水的电离平衡的是 ( )
A.H2SO4 B.NaCl
C. NaOH D.CH3COONa
2.最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一,下列关于水的说法中正确的是 ( )
A.水的离子积仅适用于纯水
B .水的电离需要通直流电
C.升高温度水的离子积增大
D.加入电解质一定会破坏水的电离平衡
C
3.25℃时,水中存在电离平衡:2H2O H3O++OH- Δ H>0。下列叙述正确的是 ( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NH4C1固体,抑制水的电离
C.向水中加入少量NaOH固体,促进水的电离
D.向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大, Kw不变
D
4 .已知水在25℃和100℃时,电离平衡曲线如图所示:
(1)25℃时水的电离平衡曲线应为____ (填“A”或
“B”),请说明理由____________________________
______________________________________________。
(2)下列措施能影响水的电离平衡,并使溶液中的c(H﹢)>c(OH﹣)的是_____
(填序号)。
A.向纯水中投入少量Na2O2固体 B.将水加热至煮沸
C.向水中通入CO2 D.向水中加入NaCl
A
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
C
本节内容结束
第3课时 水的电离平衡
专题3 水溶液中的离子反应
第一单元 弱电解质的电离平衡
一、水的电离
水是一种极弱的电解质,能微弱的电离:
知识梳理
H2O+H2O H3O++OH-
H2O H++OH-
所以K电离× c(H2O)= c (H+)×c (OH-)
Kw为一个新的常数,称为水的离子积常数。
水的浓度为常数, K电离也是常数
= Kw
电离常数: K电离=
c(H+)×c(OH-)
c(H2O)
H2O H++OH-
分析表中的数据,有何规律,并解释之
结论:
Kw只与温度有关,温度越高, Kw越大。
Δ H>0
中和反应的逆过程
二、影响水的离子积的因素
H2O H++OH-
温度 0 ℃ 20 ℃ 25 ℃ 50 ℃ 100 ℃
Kw 1.34×10-15 6.81×10-15 1.01×10-14 5.57×10-14 5.50×10-13
思考:
1.Kw = c(H+)×c(OH-)公式只适用于纯水吗?
2.公式中的c(H+)和c(OH-)指的是由水电离的c(H+)和c(OH-)吗?
溶液 pH 溶液中c(H+) mol/L 溶液中c(OH-) mol/L c(H+)· c(OH-)
纯水 7
0.1 mol/L NaOH溶液 13
已知:25℃下Kw= 1.0×10-14
1×10-7
1×10-13
1×10-7
0.1
1.0×10-14
1.0×10-14
水的离子积既适用于纯水,又适用于其他电解质稀溶液;常温下任何稀溶液,
Kw=c(H+)×c(OH-)=1×10-14,Kw中的c(OH-) 、c(H+ )指溶液中总的离子浓度。
已知:25℃下Kw =1.0×10-14,任何溶液中水电离出的c水(H+) =c水(OH-)
1.0.1 mol/L的HCl溶液中,求由水电离出来的c水(H+) ?
HCl=== H+ + Cl-
c(H+)=0.1 mol/L
c水(OH-)=1×10-13 mol/L
c水(H+)=c水(OH-)=1×10-13 mol/L
Kw=c(H+)×c(OH-)=1×10-14
酸溶液中由水电离的c水(H+),要看溶液中的c(OH-)。
H2O H+ + OH-
NaOH === Na+ + OH-
c(OH-)=1 mol/L
c水(H+)=1×10-14 mol/L
c水(OH-)=c水(H+)=1×10-14 mol/L
碱溶液中由水电离的c水(OH-) ,要看溶液中的c(H+)。
2.25℃时,Kw=1×10-14,1 mol/L的NaOH溶液中,求由水电离出来的c(OH-) ?
H2O H+ + OH-
Kw=c(H+)×c(OH-)=1×10-14
课堂练习:
1.25℃时,Kw=1×10-14,求纯水中c(H+)、c(OH-)?
2.100℃时,纯水中c(OH-) =1×10-6 mol/L,求c(H+)、Kw?
c(H+) =c(OH-) =1×10-7 mol/L
c(H+) =c(OH-) =1×10-6 mol/L
Kw=c(H+)×c(OH-) =1×10-12
思考:
影响水的电离平衡移动的因素有哪些
温度、改变c(H+)或c(OH-)
三、影响水的电离平衡移动的因素
H2O H+ + OH-
平衡移动方向 电离程度 c(H+) c(OH-) Kw
升温
加活泼金属
加酸 (可电离出H+)
加碱 (可电离出OH-)
加弱碱阳离子 (可与OH-反应)
加弱酸阴离子 (可与H+反应)
H2O H+ + OH-
右移
增大
增大
增大
增大
右移
增大
减小
增大
不变
左移
减小
增大
减小
不变
左移
减小
减小
增大
不变
右移
增大
增大
减小
不变
右移
增大
减小
增大
不变
增大c(OH- )(加碱)
增大c(H+)(加酸或强酸酸式盐)
减小c(H+) :加含 、S2-、 CH3COO-、的盐
减小c(OH- ) :加含 、Fe3+、 Cu2+、 Al3+的盐
升高温度
降低温度
抑制水电离
促进水电离
知识小结
B
当堂检测
1.下列物质加入水中,不影响水的电离平衡的是 ( )
A.H2SO4 B.NaCl
C. NaOH D.CH3COONa
2.最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一,下列关于水的说法中正确的是 ( )
A.水的离子积仅适用于纯水
B .水的电离需要通直流电
C.升高温度水的离子积增大
D.加入电解质一定会破坏水的电离平衡
C
3.25℃时,水中存在电离平衡:2H2O H3O++OH- Δ H>0。下列叙述正确的是 ( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量NH4C1固体,抑制水的电离
C.向水中加入少量NaOH固体,促进水的电离
D.向水中加入少量NaHSO4固体,抑制水的电离,c(H+)增大, Kw不变
D
4 .已知水在25℃和100℃时,电离平衡曲线如图所示:
(1)25℃时水的电离平衡曲线应为____ (填“A”或
“B”),请说明理由____________________________
______________________________________________。
(2)下列措施能影响水的电离平衡,并使溶液中的c(H﹢)>c(OH﹣)的是_____
(填序号)。
A.向纯水中投入少量Na2O2固体 B.将水加热至煮沸
C.向水中通入CO2 D.向水中加入NaCl
A
水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
C
本节内容结束
