2023化学苏教版选择性必修一 3.2.1 溶液的酸碱性与pH 课件(共25张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 3.2.1 溶液的酸碱性与pH 课件(共25张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 513.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 22:29:06 | ||
图片预览








文档简介
(共25张PPT)
第1课时 溶液的酸碱性与pH
专题3 水溶液中的离子反应
第二单元 溶液的酸碱性
思考:
已知:pH=﹣lg c(H+),T ℃时,若溶液中c(H﹢)=10-7 mol/L。
1.该溶液pH为多少?
2.该溶液一定为中性吗?
pH = 7
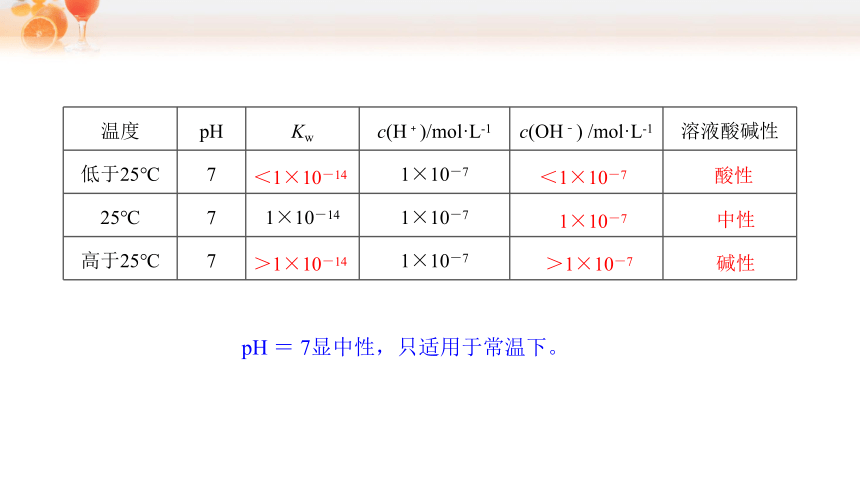
温度 pH Kw c(H﹢)/mol·L-1 c(OH﹣) /mol·L-1 溶液酸碱性
低于25℃ 7 1×10-7
25℃ 7 1×10-14 1×10-7
高于25℃ 7 1×10-7
<1×10-14
>1×10-14
<1×10-7
>1×10-7
酸性
中性
碱性
1×10-7
pH = 7显中性,只适用于常温下。
一、溶液的酸碱性
中性溶液
酸性溶液
碱性溶液
c(H﹢)=c(OH﹣)
c(H﹢)>c(OH﹣)
c(H﹢)< c(OH﹣)
在酸性、碱性、中性溶液中,H﹢和OH﹣是共存的,只是H﹢和OH﹣浓度的相对大小不同。
1.判断依据
知识梳理
(2)当表示较小的如c(H﹢)=10-12 mol/L时,很麻烦,用H﹢物质的量浓度的负对数来表示:pH =﹣lg c(H﹢)
c(H﹢)
10-12 mol/L
lg c(H﹢)
﹣12
-lg c(H﹢)
12
(1)当c(H﹢)浓度较大时,我们通常表示成1 mol/L、2 mol/L等。
2.表示方法
一般规律
25 ℃(常温情况下)
c(H﹢) >10-7 mol/L
c(H﹢)<10-7 mol/L
c(H﹢)=10-7 mol/L
pH=7
pH<7
pH>7
3.溶液的pH与酸碱性强弱的关系
中性
酸性
碱性
c(H﹢)=c(OH﹣)
c(H﹢)>c(OH﹣)
c(H﹢)< c(OH﹣)
常温下:pH<7,溶液呈酸性,pH越小,溶液的酸性越强。
pH=7,溶液呈中性
pH>7,溶液呈碱性,pH越大,溶液的碱性越强。
(1)定性测定:酸碱指示剂法。
酸碱指示剂一般是弱的有机酸或弱的有机碱。
4.溶液酸碱性的测定方法
HIn(红色) H﹢+In﹣(蓝色)
以HIn代表石蕊分子:
3.1~4.4
5.0~8.0
8.2~10.0
指示剂的变色范围
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
①pH试纸
使用方法:
用洁净、干燥的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比。
广泛pH试纸
精密pH试纸
只能测整数值
可测小数点后一位
(2)定量测定
通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。
②pH计
1.单一溶液的pH计算
①求25 ℃时0.05 mol/L H2SO4溶液的pH。
②25 ℃时,将0.4 g NaOH溶于水制成1000 mL溶液,求所得溶液的pH。
方法总结:
酸性溶液:先求c(H﹢), 再pH=﹣lg c(H﹢)
碱性溶液:先求c(OH﹣) ,再c(H﹢)=Kw/c(OH﹣) ,
最后 pH=﹣lg c(H﹢)
二、溶液pH的计算
1
12
2.酸碱稀释后的pH计算
(1)强酸的稀释
稀释前溶液 加水稀释倍数 稀释后pH
pH=4的 稀盐酸 10倍
100倍
1000倍
5
6
接近7
强酸的稀释规律:强酸pH=a,加水稀释10n倍,则pH =a+n。(增大后不超过7)
2.酸碱稀释后的pH计算
稀释前溶液 加水稀释倍数 稀释后PH
pH=10的 稀氢氧化钠 10倍
100倍
1000倍
9
8
接近7
强碱的稀释规律:强碱pH=b,加水稀释10n倍,则pH=b-n。(降低后不低于7)
(2)强碱的稀释
思考:
① pH=3的醋酸,加水稀释10倍,pH怎么变化?
② pH=9的氨水,加水稀释100倍, pH怎么变化?
弱电解质的稀释规律:
弱酸pH=a,加水稀释10n倍,则a<pH<a+n 。(增大后不超过7)
弱碱pH=b,加水稀释10n倍,则b-n<pH<b。(减小后不低于7)
3<pH<4
7<pH<9
(1)强酸与强酸混合
①在25 ℃时,pH=1的盐酸溶液1 L和pH=4的盐酸溶液1000 L混合后pH等于多少?
c1V1+c2V2
V1+V2
c(H﹢)总=
分析:两溶液混合后,溶液仍显酸性,溶液中H﹢占主要
0.1 mol/L×1 L+1×10-4 mol/L×1000 L
1 L+1000 L
=
pH=3.7
3.酸碱混合后的pH计算
②在25 ℃时,pH等于1的盐酸溶液和pH等于4的盐酸溶液等体积混合pH等于多少?
③在25 ℃时,pH等于2的盐酸溶液和pH等于6的盐酸溶液等体积混合pH等于多少?
1.3
2.3
规律:两强酸混合,抓住 H﹢进行计算。
①若不等体积混合:先求 ,再求pH。
②若等体积混合,且Δ pH≥2 :pH混=pH小+0.3
c1V1+c2V2
V1+V2
c(H﹢)总=
在25℃时,pH等于9和pH等于13的两种氢氧化钠溶液等体积混合pH等于多少?
分析:两溶液混合后,溶液仍显碱性,溶液中OH﹣占主要
≈0.05 mol/L
c(H﹢)=KW÷c(OH﹣)=2×10-13 mol/L
(2)强碱与强碱混合
c1V1+c2V2
V1+V2
c(OH﹣)总=
1×10-5 mol/L×1 L+0.1 mol/L×1 L
1 L+1 L
=
pH=12.7
规律:两强碱混合,抓住 OH- 进行计算。
①若不等体积混合:先求
再求c(H﹢),最后求pH。
②若等体积混合,且Δ pH≥2 :pH混=pH大-0.3
c1V1+c2V2
V1+V2
c(OH﹣)总=
(3)强酸与强碱混合
(本质为酸碱中和)
组别 碱 酸 中和后酸碱性 计算方法 溶液中c(H﹢) mol/L pH
① 100 mL 0.4 mol/L 100 mL 0.6 mol/L
② 100 mL 0.4 mol/L
③ 100 mL 0.2 mol/L
酸性
碱性
中性
c酸V酸-c碱V碱
V酸+V碱
c(H﹢)=
c碱V碱-c酸V酸
V碱+V酸
c(OH﹣)=
c(H﹢)=KW/c(OH﹣)
1×10-7
0.1
1×10-13
1
7
13
规律:强酸与强碱溶液混合求pH。
①两者恰好反应时, pH=7
②酸过量时,求出反应后溶液中的c(H﹢),再求出pH
③碱过量时,先求出反应后溶液中的c(OH﹣),再根据Kw求出c(H﹢) ,然后求pH
1.pH试纸使用操作中正确的是( )
A.将pH试纸的一端浸入溶液,观察颜色的变化
B.将pH试纸浸入溶液一会儿,再取出跟标准比色卡对比
C.用洁净的玻璃棒蘸取被测溶液,滴在pH试纸上,待颜色变化后立即与比色
卡对比
D.先将pH试纸用蒸馏水润湿,再用洁净的玻璃棒蘸取被测溶液,滴在pH试纸
上,颜色变化后与比色卡对比
C
当堂检测
3.下列溶液在常温下酸性最强的是( )
A.pH=4的溶液
B.1 L 溶液里溶有22.4 mL(标准状况下)HCl的溶液
C.c(OH﹣)=10-12 mol·L-1的溶液
D.c(H﹢)=10-3 mol·L-1的溶液
2.甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H﹢)与乙溶液中c(H﹢)之比为( )
A.100 B.1/100 C.3 D.1/3
C
B
4.室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
C
5.常温下,甲溶液pH=2,乙溶液pH=12, 当两者等体积混和后,有关pH值变化的叙述正确的是( )
A.pH>7 B.pH=7
C.pH<7 D.前面三种情况都有可能
D
6.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
C
本节内容结束
第1课时 溶液的酸碱性与pH
专题3 水溶液中的离子反应
第二单元 溶液的酸碱性
思考:
已知:pH=﹣lg c(H+),T ℃时,若溶液中c(H﹢)=10-7 mol/L。
1.该溶液pH为多少?
2.该溶液一定为中性吗?
pH = 7
温度 pH Kw c(H﹢)/mol·L-1 c(OH﹣) /mol·L-1 溶液酸碱性
低于25℃ 7 1×10-7
25℃ 7 1×10-14 1×10-7
高于25℃ 7 1×10-7
<1×10-14
>1×10-14
<1×10-7
>1×10-7
酸性
中性
碱性
1×10-7
pH = 7显中性,只适用于常温下。
一、溶液的酸碱性
中性溶液
酸性溶液
碱性溶液
c(H﹢)=c(OH﹣)
c(H﹢)>c(OH﹣)
c(H﹢)< c(OH﹣)
在酸性、碱性、中性溶液中,H﹢和OH﹣是共存的,只是H﹢和OH﹣浓度的相对大小不同。
1.判断依据
知识梳理
(2)当表示较小的如c(H﹢)=10-12 mol/L时,很麻烦,用H﹢物质的量浓度的负对数来表示:pH =﹣lg c(H﹢)
c(H﹢)
10-12 mol/L
lg c(H﹢)
﹣12
-lg c(H﹢)
12
(1)当c(H﹢)浓度较大时,我们通常表示成1 mol/L、2 mol/L等。
2.表示方法
一般规律
25 ℃(常温情况下)
c(H﹢) >10-7 mol/L
c(H﹢)<10-7 mol/L
c(H﹢)=10-7 mol/L
pH=7
pH<7
pH>7
3.溶液的pH与酸碱性强弱的关系
中性
酸性
碱性
c(H﹢)=c(OH﹣)
c(H﹢)>c(OH﹣)
c(H﹢)< c(OH﹣)
常温下:pH<7,溶液呈酸性,pH越小,溶液的酸性越强。
pH=7,溶液呈中性
pH>7,溶液呈碱性,pH越大,溶液的碱性越强。
(1)定性测定:酸碱指示剂法。
酸碱指示剂一般是弱的有机酸或弱的有机碱。
4.溶液酸碱性的测定方法
HIn(红色) H﹢+In﹣(蓝色)
以HIn代表石蕊分子:
3.1~4.4
5.0~8.0
8.2~10.0
指示剂的变色范围
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
①pH试纸
使用方法:
用洁净、干燥的玻璃棒蘸取待测液滴在干燥的pH试纸上,试纸上显出颜色后马上跟标准比色卡相对比。
广泛pH试纸
精密pH试纸
只能测整数值
可测小数点后一位
(2)定量测定
通过电子仪器,把仪器的探棒放入溶液即可在显示屏上读出数据,该法精确度高。
②pH计
1.单一溶液的pH计算
①求25 ℃时0.05 mol/L H2SO4溶液的pH。
②25 ℃时,将0.4 g NaOH溶于水制成1000 mL溶液,求所得溶液的pH。
方法总结:
酸性溶液:先求c(H﹢), 再pH=﹣lg c(H﹢)
碱性溶液:先求c(OH﹣) ,再c(H﹢)=Kw/c(OH﹣) ,
最后 pH=﹣lg c(H﹢)
二、溶液pH的计算
1
12
2.酸碱稀释后的pH计算
(1)强酸的稀释
稀释前溶液 加水稀释倍数 稀释后pH
pH=4的 稀盐酸 10倍
100倍
1000倍
5
6
接近7
强酸的稀释规律:强酸pH=a,加水稀释10n倍,则pH =a+n。(增大后不超过7)
2.酸碱稀释后的pH计算
稀释前溶液 加水稀释倍数 稀释后PH
pH=10的 稀氢氧化钠 10倍
100倍
1000倍
9
8
接近7
强碱的稀释规律:强碱pH=b,加水稀释10n倍,则pH=b-n。(降低后不低于7)
(2)强碱的稀释
思考:
① pH=3的醋酸,加水稀释10倍,pH怎么变化?
② pH=9的氨水,加水稀释100倍, pH怎么变化?
弱电解质的稀释规律:
弱酸pH=a,加水稀释10n倍,则a<pH<a+n 。(增大后不超过7)
弱碱pH=b,加水稀释10n倍,则b-n<pH<b。(减小后不低于7)
3<pH<4
7<pH<9
(1)强酸与强酸混合
①在25 ℃时,pH=1的盐酸溶液1 L和pH=4的盐酸溶液1000 L混合后pH等于多少?
c1V1+c2V2
V1+V2
c(H﹢)总=
分析:两溶液混合后,溶液仍显酸性,溶液中H﹢占主要
0.1 mol/L×1 L+1×10-4 mol/L×1000 L
1 L+1000 L
=
pH=3.7
3.酸碱混合后的pH计算
②在25 ℃时,pH等于1的盐酸溶液和pH等于4的盐酸溶液等体积混合pH等于多少?
③在25 ℃时,pH等于2的盐酸溶液和pH等于6的盐酸溶液等体积混合pH等于多少?
1.3
2.3
规律:两强酸混合,抓住 H﹢进行计算。
①若不等体积混合:先求 ,再求pH。
②若等体积混合,且Δ pH≥2 :pH混=pH小+0.3
c1V1+c2V2
V1+V2
c(H﹢)总=
在25℃时,pH等于9和pH等于13的两种氢氧化钠溶液等体积混合pH等于多少?
分析:两溶液混合后,溶液仍显碱性,溶液中OH﹣占主要
≈0.05 mol/L
c(H﹢)=KW÷c(OH﹣)=2×10-13 mol/L
(2)强碱与强碱混合
c1V1+c2V2
V1+V2
c(OH﹣)总=
1×10-5 mol/L×1 L+0.1 mol/L×1 L
1 L+1 L
=
pH=12.7
规律:两强碱混合,抓住 OH- 进行计算。
①若不等体积混合:先求
再求c(H﹢),最后求pH。
②若等体积混合,且Δ pH≥2 :pH混=pH大-0.3
c1V1+c2V2
V1+V2
c(OH﹣)总=
(3)强酸与强碱混合
(本质为酸碱中和)
组别 碱 酸 中和后酸碱性 计算方法 溶液中c(H﹢) mol/L pH
① 100 mL 0.4 mol/L 100 mL 0.6 mol/L
② 100 mL 0.4 mol/L
③ 100 mL 0.2 mol/L
酸性
碱性
中性
c酸V酸-c碱V碱
V酸+V碱
c(H﹢)=
c碱V碱-c酸V酸
V碱+V酸
c(OH﹣)=
c(H﹢)=KW/c(OH﹣)
1×10-7
0.1
1×10-13
1
7
13
规律:强酸与强碱溶液混合求pH。
①两者恰好反应时, pH=7
②酸过量时,求出反应后溶液中的c(H﹢),再求出pH
③碱过量时,先求出反应后溶液中的c(OH﹣),再根据Kw求出c(H﹢) ,然后求pH
1.pH试纸使用操作中正确的是( )
A.将pH试纸的一端浸入溶液,观察颜色的变化
B.将pH试纸浸入溶液一会儿,再取出跟标准比色卡对比
C.用洁净的玻璃棒蘸取被测溶液,滴在pH试纸上,待颜色变化后立即与比色
卡对比
D.先将pH试纸用蒸馏水润湿,再用洁净的玻璃棒蘸取被测溶液,滴在pH试纸
上,颜色变化后与比色卡对比
C
当堂检测
3.下列溶液在常温下酸性最强的是( )
A.pH=4的溶液
B.1 L 溶液里溶有22.4 mL(标准状况下)HCl的溶液
C.c(OH﹣)=10-12 mol·L-1的溶液
D.c(H﹢)=10-3 mol·L-1的溶液
2.甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H﹢)与乙溶液中c(H﹢)之比为( )
A.100 B.1/100 C.3 D.1/3
C
B
4.室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
C
5.常温下,甲溶液pH=2,乙溶液pH=12, 当两者等体积混和后,有关pH值变化的叙述正确的是( )
A.pH>7 B.pH=7
C.pH<7 D.前面三种情况都有可能
D
6.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
C
本节内容结束
