2023化学苏教版选择性必修一 3.3.2 盐类水解的影响因素及应用 课件(共60张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 3.3.2 盐类水解的影响因素及应用 课件(共60张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 22:32:40 | ||
图片预览











文档简介
专题3 水溶液中的离子反应
第三单元 盐类的水解
第2课时 盐类水解的影响因素及应用
学习目标
1.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响。
2.了解盐类水解在生产、生活中的应用。
3.通过了解盐类水解的应用,进一步体会化学对社会发展的作用。
核心素养
变化观念与平衡思想:
知道反应条件对盐类水解平衡的影响,能用化学平衡的原理分析影响盐类水解的因素。
证据推理与模型认知:
能定性、定量搜集证据建立盐类水解及盐类水解应用的认知模型,并能利用模型解决常见问题。
活动探究
归纳总结
一、盐类水解的影响因素
1.盐类水解的特征
(1)盐类的水解反应是吸热反应。
(2)加水稀释能促进盐类的水解。
2.影响盐类水解的因素
(1)内因
①主要因素是盐本身的性质,组成盐的酸根离子对应的酸越弱或阳离子对应的碱越弱,水解程度就越大(越弱越水解)。
例如,酸性:HF>CH3COOH,则水解程度:NaF(主要)
(微弱)
CO32?+H2O HCO3?+OH –
?
HCO3?+H2O H2CO3+OH –
?
②多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是第一步水解产生的OH-对第二步水解有抑制作用,并且正盐阴离子与H+结合能力比酸式盐阴离子结合能力强。例如,Na2CO3溶液中
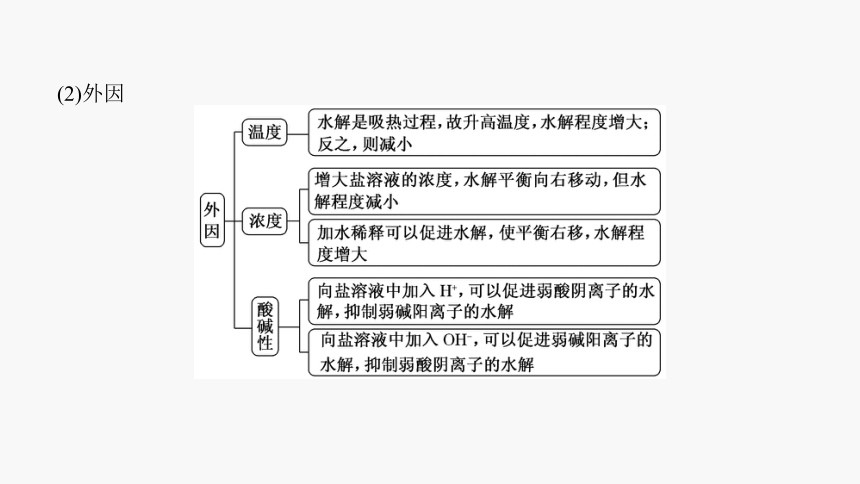
(2)外因
(1)能水解的盐的浓度越大,水解程度越小,但其溶液的酸性(或碱性)比稀溶液的酸性(或碱性)强。
(2)越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
[名师点拨]
巩固练习
1.下列关于FeCl3水解的说法错误的是 ( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,
平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的
水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时
Fe3+的水解程度比20 ℃时的小
D.为了抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
B
活动探究
?
实验现象
实验1
?
实验2
?
完成下列实验,观察实验现象并记录在下表中。
[实验1]取一只250 mL锥形瓶,向其中加入20 mL饱和Al2(SO4)3溶液,再加入
30 mL饱和NaHCO3溶液。
[实验2]取A、B两只100 mL烧杯,各加入50 mL带有悬浮颗粒的水。向A烧杯中加入5 mL饱和明矾溶液,再滴加5滴饱和NaHCO3溶液,轻轻搅拌后静置,10 min后与B烧杯比较。
盐类水解的应用实验
1.盐类水解在工农业生产和生活中的应用
应用
举例
泡沫灭火
器原理
化肥的施用
铵态氮肥(溶液显酸性)与草木灰(溶液显碱性)不得混合施用
热的纯碱溶
液清洗油污
归纳总结
二、盐类水解的应用
应用
举例
明矾净水
Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附性,可作净水剂
除锈剂
巩固练习
D
B
活动探究
2.盐类水解在化学实验中的应用
归纳总结
二、盐类水解的应用
应用
举例
判断溶液的
酸碱性
配制或贮存易水解的盐溶液
实验室配制FeCl3溶液、AlCl3溶液、SnCl2溶液时,要在溶液中加少量盐酸,抑制Fe3+、Al3+、Sn2+的水解,否则会产生沉淀。同理在配制CuSO4溶液时,常加几滴稀H2SO4来抑制Cu2+的水解
应用
举例
判断盐溶液蒸干产物
加热蒸干AlCl3溶液,因为水解产物之一为挥发性的盐酸,不断挥发出氯化氢气体,导致水解平衡不断向右移动,最后彻底水解,蒸干后得到Al(OH)3,进一步灼烧得到Al2O3
胶体的制备
制备Fe(OH)3胶体的离子反应:Fe3++3H2O Fe(OH)3(胶体)+3H+
物质的提纯
除去MgCl2溶液中的Fe3+,可加入MgO、Mg(OH)2或MgCO3
离子共存的判断
△
应用
举例
试剂的保存
在实验室中盛放Na2CO3、CH3COONa、Na2S等溶液的试剂瓶不能用玻璃塞,应用橡皮塞或软木塞。因这些盐水解生成的NaOH会腐蚀玻璃生成Na2SiO3,使瓶口和瓶塞黏在一起
某些较活泼的金属与强酸弱碱盐溶液反应
将Mg粉放入NH4Cl溶液中可产生H2:Mg+2NH+4+2H2O 2NH3·H2O+H2↑+Mg2+
利用盐的水解除杂
除去MgCl2酸性溶液中的Fe3+,可在加热搅拌条件下加入过量MgCO3 (或MgO)过滤。Fe3++3H2O Fe(OH)3+3H+、MgCO3+2H+=== Mg2++CO2↑+H2O。加入MgCO3(或MgO),破坏了Fe3+的水解平衡,在加热搅拌条件下使其水解完全,生成Fe(OH)3沉淀而除去Fe3+
巩固练习
B
A
能力提升
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是 ( )
A.Na2SO3溶液中存在水解平衡:SO32?+H2O HSO3?+OH-
B.④的pH与①不同,是SO32?浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw相等
?
1.测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
C
提示:Na2SO3是强碱弱酸盐,在水溶液中存在水解平衡:SO32?+H2O HSO3?+OH-,A项正确。提示:①与④的温度相同,但pH不同,主要是由于Na2SO3被氧化为Na2SO4,从而使溶液的碱性减弱,pH减小,B项正确。提示:①→③的过程中,温度升高使水解平衡正向移动,而SO32?的浓度逐渐减小,使水解平衡逆向移动,故温度和浓度对水解平衡移动方向的影响不一致,C项错误。提示:①与④的温度相同,故Kw相同,D项正确。
?
2019年中国地质大学(武汉)新校区开展了“身边的化学”年度秀,让同学们“get”生活妙招,如“一杯矿泉水摇身成为草莓牛奶”、“自制护手霜”,这次该校化学院“Chemistry Show——身边的化学”年度秀活动,吸引数百名师生围观。
请同学们利用化学知识来分析下列问题的化学原理:
(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是什么?
提示:抑制Cu2+的水解。
(2)FeCl3净水的原理是___________________________________(用离子方程式表示);将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(写化学式)。
(3)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是_____________
______________________ (用离子方程式表示);灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是________________________________(用离子方程式表示);当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为__________________________________。
Al2O3
Fe3++3H2O Fe(OH)3(胶体)+3H+
HCO3?+H2O
?
H2CO3+OH-
Al3++3H2O Al(OH)3+3H+
3HCO3?+Al3+===Al(OH)3↓+3CO2↑
?
归纳总结
在分析影响盐类水解的因素时要考虑盐本身的性质,特别要注意盐是否易被氧化、受热易分解等,同时,当多个条件共同影响盐类水解平衡移动时,要结合题目信息综合分析,看以哪一种因素影响为主。
举一反三
B
D
B
温度/℃
10
20
30
加热煮沸后冷却到50 ℃
pH
8.3
8.4
8.5
8.8
(1)甲同学认为,该溶液的pH升高的原因是温度升高,HCO3?的水解程度增大,故碱性增强,该反应的离子方程式为__________________________________。
(2)乙同学认为,该溶液的pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
?
4.加热NaHCO3饱和溶液,测得该溶液的pH变化如表所示:
大于
HCO3?+H2O H2CO3+OH-
?
(3)丙同学认为甲、乙同学的判断都不充分。丙同学认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)同学判断正确。试剂X是________(填字母)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________(填“>”“<”或“=”)8.3,则甲同学判断正确。
乙
B
=
当堂检测
B
微粒
H+
OH-
CH3COO-
CH3COOH
物质的量浓度
增大
减小
减小
增大
2.向CH3COONa稀溶液中加入(或通入)少许X,其溶液中部分微粒的浓度变化如表所示(溶液温度不变)。由此判断X是 ( )
A .氢氧化钠 B.氯化氢
C.蒸馏水 D.磷酸钠
【解析】向CH3COONa稀溶液中加入少许氢氧化钠,c(OH-)增大;加入少许蒸馏水,c(CH3COOH)减小;加入少许磷酸钠,抑制CH3COO-的水解,c(CH3COO-)增大。
B
Fe2+易被氧化,需要加入少量的铁粉防止亚铁离子被氧化,与盐的水解无关。
B
A
5.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为
___________________________________________________。
CH3COO-+H2O CH3COOH+OH-,使溶液显碱性
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为________、________、________、________(填“左”“右”或“不移动”)。
BD
右
右
左
左
6.(1)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(2)用离子方程式表示泡沫灭火器的灭火原理:
__________________________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是_________________
___________________________________________________________________。
MgCO3与Fe3+水解产生的H+反应,促进了Fe3+的水解,使Fe3+转化为 Fe(OH)3沉淀而除去
Fe2O3
Al3++3HCO3?===Al(OH)3↓+3CO2↑
?
本节内容结束
第三单元 盐类的水解
第2课时 盐类水解的影响因素及应用
学习目标
1.了解影响盐类水解平衡的因素,能多角度、动态地分析外界条件对盐类水解平衡的影响。
2.了解盐类水解在生产、生活中的应用。
3.通过了解盐类水解的应用,进一步体会化学对社会发展的作用。
核心素养
变化观念与平衡思想:
知道反应条件对盐类水解平衡的影响,能用化学平衡的原理分析影响盐类水解的因素。
证据推理与模型认知:
能定性、定量搜集证据建立盐类水解及盐类水解应用的认知模型,并能利用模型解决常见问题。
活动探究
归纳总结
一、盐类水解的影响因素
1.盐类水解的特征
(1)盐类的水解反应是吸热反应。
(2)加水稀释能促进盐类的水解。
2.影响盐类水解的因素
(1)内因
①主要因素是盐本身的性质,组成盐的酸根离子对应的酸越弱或阳离子对应的碱越弱,水解程度就越大(越弱越水解)。
例如,酸性:HF>CH3COOH,则水解程度:NaF
(微弱)
CO32?+H2O HCO3?+OH –
?
HCO3?+H2O H2CO3+OH –
?
②多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是第一步水解产生的OH-对第二步水解有抑制作用,并且正盐阴离子与H+结合能力比酸式盐阴离子结合能力强。例如,Na2CO3溶液中
(2)外因
(1)能水解的盐的浓度越大,水解程度越小,但其溶液的酸性(或碱性)比稀溶液的酸性(或碱性)强。
(2)越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
[名师点拨]
巩固练习
1.下列关于FeCl3水解的说法错误的是 ( )
A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,
平衡均向右移动
B.浓度为5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的
水解程度前者小于后者
C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时
Fe3+的水解程度比20 ℃时的小
D.为了抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸
C
B
活动探究
?
实验现象
实验1
?
实验2
?
完成下列实验,观察实验现象并记录在下表中。
[实验1]取一只250 mL锥形瓶,向其中加入20 mL饱和Al2(SO4)3溶液,再加入
30 mL饱和NaHCO3溶液。
[实验2]取A、B两只100 mL烧杯,各加入50 mL带有悬浮颗粒的水。向A烧杯中加入5 mL饱和明矾溶液,再滴加5滴饱和NaHCO3溶液,轻轻搅拌后静置,10 min后与B烧杯比较。
盐类水解的应用实验
1.盐类水解在工农业生产和生活中的应用
应用
举例
泡沫灭火
器原理
化肥的施用
铵态氮肥(溶液显酸性)与草木灰(溶液显碱性)不得混合施用
热的纯碱溶
液清洗油污
归纳总结
二、盐类水解的应用
应用
举例
明矾净水
Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附性,可作净水剂
除锈剂
巩固练习
D
B
活动探究
2.盐类水解在化学实验中的应用
归纳总结
二、盐类水解的应用
应用
举例
判断溶液的
酸碱性
配制或贮存易水解的盐溶液
实验室配制FeCl3溶液、AlCl3溶液、SnCl2溶液时,要在溶液中加少量盐酸,抑制Fe3+、Al3+、Sn2+的水解,否则会产生沉淀。同理在配制CuSO4溶液时,常加几滴稀H2SO4来抑制Cu2+的水解
应用
举例
判断盐溶液蒸干产物
加热蒸干AlCl3溶液,因为水解产物之一为挥发性的盐酸,不断挥发出氯化氢气体,导致水解平衡不断向右移动,最后彻底水解,蒸干后得到Al(OH)3,进一步灼烧得到Al2O3
胶体的制备
制备Fe(OH)3胶体的离子反应:Fe3++3H2O Fe(OH)3(胶体)+3H+
物质的提纯
除去MgCl2溶液中的Fe3+,可加入MgO、Mg(OH)2或MgCO3
离子共存的判断
△
应用
举例
试剂的保存
在实验室中盛放Na2CO3、CH3COONa、Na2S等溶液的试剂瓶不能用玻璃塞,应用橡皮塞或软木塞。因这些盐水解生成的NaOH会腐蚀玻璃生成Na2SiO3,使瓶口和瓶塞黏在一起
某些较活泼的金属与强酸弱碱盐溶液反应
将Mg粉放入NH4Cl溶液中可产生H2:Mg+2NH+4+2H2O 2NH3·H2O+H2↑+Mg2+
利用盐的水解除杂
除去MgCl2酸性溶液中的Fe3+,可在加热搅拌条件下加入过量MgCO3 (或MgO)过滤。Fe3++3H2O Fe(OH)3+3H+、MgCO3+2H+=== Mg2++CO2↑+H2O。加入MgCO3(或MgO),破坏了Fe3+的水解平衡,在加热搅拌条件下使其水解完全,生成Fe(OH)3沉淀而除去Fe3+
巩固练习
B
A
能力提升
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是 ( )
A.Na2SO3溶液中存在水解平衡:SO32?+H2O HSO3?+OH-
B.④的pH与①不同,是SO32?浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw相等
?
1.测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
C
提示:Na2SO3是强碱弱酸盐,在水溶液中存在水解平衡:SO32?+H2O HSO3?+OH-,A项正确。提示:①与④的温度相同,但pH不同,主要是由于Na2SO3被氧化为Na2SO4,从而使溶液的碱性减弱,pH减小,B项正确。提示:①→③的过程中,温度升高使水解平衡正向移动,而SO32?的浓度逐渐减小,使水解平衡逆向移动,故温度和浓度对水解平衡移动方向的影响不一致,C项错误。提示:①与④的温度相同,故Kw相同,D项正确。
?
2019年中国地质大学(武汉)新校区开展了“身边的化学”年度秀,让同学们“get”生活妙招,如“一杯矿泉水摇身成为草莓牛奶”、“自制护手霜”,这次该校化学院“Chemistry Show——身边的化学”年度秀活动,吸引数百名师生围观。
请同学们利用化学知识来分析下列问题的化学原理:
(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是什么?
提示:抑制Cu2+的水解。
(2)FeCl3净水的原理是___________________________________(用离子方程式表示);将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(写化学式)。
(3)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈碱性的原因是_____________
______________________ (用离子方程式表示);灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是________________________________(用离子方程式表示);当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为__________________________________。
Al2O3
Fe3++3H2O Fe(OH)3(胶体)+3H+
HCO3?+H2O
?
H2CO3+OH-
Al3++3H2O Al(OH)3+3H+
3HCO3?+Al3+===Al(OH)3↓+3CO2↑
?
归纳总结
在分析影响盐类水解的因素时要考虑盐本身的性质,特别要注意盐是否易被氧化、受热易分解等,同时,当多个条件共同影响盐类水解平衡移动时,要结合题目信息综合分析,看以哪一种因素影响为主。
举一反三
B
D
B
温度/℃
10
20
30
加热煮沸后冷却到50 ℃
pH
8.3
8.4
8.5
8.8
(1)甲同学认为,该溶液的pH升高的原因是温度升高,HCO3?的水解程度增大,故碱性增强,该反应的离子方程式为__________________________________。
(2)乙同学认为,该溶液的pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
?
4.加热NaHCO3饱和溶液,测得该溶液的pH变化如表所示:
大于
HCO3?+H2O H2CO3+OH-
?
(3)丙同学认为甲、乙同学的判断都不充分。丙同学认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)同学判断正确。试剂X是________(填字母)。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
②将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________(填“>”“<”或“=”)8.3,则甲同学判断正确。
乙
B
=
当堂检测
B
微粒
H+
OH-
CH3COO-
CH3COOH
物质的量浓度
增大
减小
减小
增大
2.向CH3COONa稀溶液中加入(或通入)少许X,其溶液中部分微粒的浓度变化如表所示(溶液温度不变)。由此判断X是 ( )
A .氢氧化钠 B.氯化氢
C.蒸馏水 D.磷酸钠
【解析】向CH3COONa稀溶液中加入少许氢氧化钠,c(OH-)增大;加入少许蒸馏水,c(CH3COOH)减小;加入少许磷酸钠,抑制CH3COO-的水解,c(CH3COO-)增大。
B
Fe2+易被氧化,需要加入少量的铁粉防止亚铁离子被氧化,与盐的水解无关。
B
A
5.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
(1)含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为
___________________________________________________。
CH3COO-+H2O CH3COOH+OH-,使溶液显碱性
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是________(填字母)。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为________、________、________、________(填“左”“右”或“不移动”)。
BD
右
右
左
左
6.(1)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(2)用离子方程式表示泡沫灭火器的灭火原理:
__________________________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是_________________
___________________________________________________________________。
MgCO3与Fe3+水解产生的H+反应,促进了Fe3+的水解,使Fe3+转化为 Fe(OH)3沉淀而除去
Fe2O3
Al3++3HCO3?===Al(OH)3↓+3CO2↑
?
本节内容结束
