1.质量守恒定律及其应用 (含解析) ---2022-2023学年沪教版初中化学九年级上册期末必刷常考题
文档属性
| 名称 | 1.质量守恒定律及其应用 (含解析) ---2022-2023学年沪教版初中化学九年级上册期末必刷常考题 |  | |
| 格式 | doc | ||
| 文件大小 | 330.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 08:09:46 | ||
图片预览



文档简介
化学沪教版九年级期末必刷常考题
1.质量守恒定律及其应用
一.选择题(共16小题)
1.(2022秋 甘井子区期中)AgNO3见光时易分解出一种有刺激性气味的气体,该气体可能是( )
A.N2 B.SO2 C.NO2 D.H2S
2.(2022秋 碑林区校级期中)下列说法不符合质量守恒定律的是( )
A.蜡烛燃烧固体质量减轻
B.铜丝在火焰上灼烧后固体质量增加
C.硫在密闭容器中燃烧,反应前后原子的种类不发生改变
D.Cu2(OH)2CO3受热分解生成CuO、H2O、SO2三种物质
3.(2022秋 铁锋区期中)黑火药是我国古代重要发明,由木炭、硫粉和硝酸钾按一定比例混合而成。其爆炸原理可用化学方程式表示为:2KNO3+3C+SK2S+X↑+3CO2↑,下列说法错误的是( )
A.X的化学式为N2
B.该反应前后元素种类不变
C.参加反应的C和S的质量比为9:8
D.K2S的化学名称为硫酸钾
4.(2022秋 青岛期中)下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
5.(2022秋 铁锋区期中)下列叙述能用质量守恒定律解释且正确的是( )
A.水结成冰前后,质量保持不变
B.氢气燃烧,参加反应的氢气和氧气的体积之和等于生成液态水的体积
C.1克碳与1克氧气完全反应生成2克二氧化碳
D.蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
6.(2022秋 开福区校级期中)化学反应前后,下列各项中,肯定没有变化的是( )
①原子数目;
②原子的种类;
③物质的种类;
④分子的种类;
⑤元素的种类;
⑥物质的总质量。
A.①②⑤⑥ B.①③⑤⑥ C.②③⑤⑥ D.③④⑥
7.(2022秋 天山区期中)某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
A.②③ B.③④ C.②③④ D.①②③④
8.(2022秋 太原期中)同学们在化学实验室里进行了质量守恒定律的验证实验,并将实验数据绘制成以下图形(各物质的数据均为其在反应前或反应后所有物质中的质量分数),由图形数据分析出的结论正确的是( )
A.图中x的数值为9 B.乙是该反应的催化剂
C.丁是该反应的生成物 D.丙、丁质量变化比为8:9
9.(2022秋 金秀县校级期中)将一定量的丙醇(C3H8O)和氧气置于封闭的容器中引燃,测得反应前后各物质的质量如下表所示:
物质 丙醇 氧气 水 二氧化碳 一氧化碳
反应前质量/g a 12.8 0 0 0
反应后质量/g 0 0 7.2 8.8 b
列判断不符合事实的是(注:氢元素全部转化生成水)( )
A.a=3.2+b
B.该反应是氧化反应
C.参加反应的丙醇与氧气的化学计量数之比是2:9
D.生成物中碳元素与氢元素的质量比为9:2
10.(2022 渝中区模拟)密闭容器中只发生了反应:甲+乙→丙+丁,各物质的质量变化如表所示,对表中数据的推测正确的是( )
物质 甲 乙 丙 丁
反应前的质量 10 10 0 0
反应中的质量 m1 m2 m3 l.5
反应后的质量 8 m4 3 3
A.m1+m2=20 B.m1+m4=10 C.m1:m2=1:2 D.m2:m3=16:3
11.(2022秋 高明区期中)已知反应CO2+3H2X+CH3OH,则X的化学式为( )
A.CH4 B.H2O C.CO D.C2H5OH
12.(2022秋 长垣市期中)分别分解高锰酸钾、氯酸钾、过氧化氢三种物质都能制得氧气。这说明三种物质的组成中都含有( )
A.氧元素 B.氧分子 C.氧气 D.氧原子
13.(2022秋 天门期中)“北斗三号”全球卫星导航系统组网成功,标志着中国航天事业迈向了新高度。火箭发射用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,反应的化学方程式为C2H8N2+2N2O4═3N2+4X+2CO2,则X的化学式为( )
A.NH3 B.H2O C.O2 D.NO2
14.(2022秋 黄岛区校级月考)在A+B=C+D的反应中,9.8gA和8gB完全反应生成14.2gC,同时得到D的质量为( )
A.1.8g B.3.6g C.7.2g D.14.4g
15.(2022秋 红桥区期中)化学反应方程式是解决宏、微、符三重表征的重要化学用语,根据化学方程式中元素守恒、原子守恒原则,分析Fe+4HNO3=Fe(NO3)3+X↑+2H2O中X的化学式为( )
A.N2 B.N2O C.NO D.NO2
16.(2022秋 铁锋区期中)某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,关于该物质的组成有下列判断:
①一定含有碳、氢元素 ②一定不含氧元素 ③一定含有氧元素 ④可能含有氧元素 ⑤该可燃物分子中碳、氧原子个数比为1:2 ⑥该可燃物分子中碳、氢原子个数比为1:3,其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
二.填空题(共1小题)
17.(2022春 渝北区校级月考)化学用语是化学的灵魂。请用恰当的化学用语表示:
(1)世界上年产量最高的金属 。
(2)2个氢氧根离子 。
(3)“84”消毒液的消毒原理是:NaClO+X+H2O═NaHCO3+HClO,生成的HClO具有杀菌作用。化学方程式中X的化学式为 ,HClO中氯元素的化合价为 。
三.实验题(共3小题)
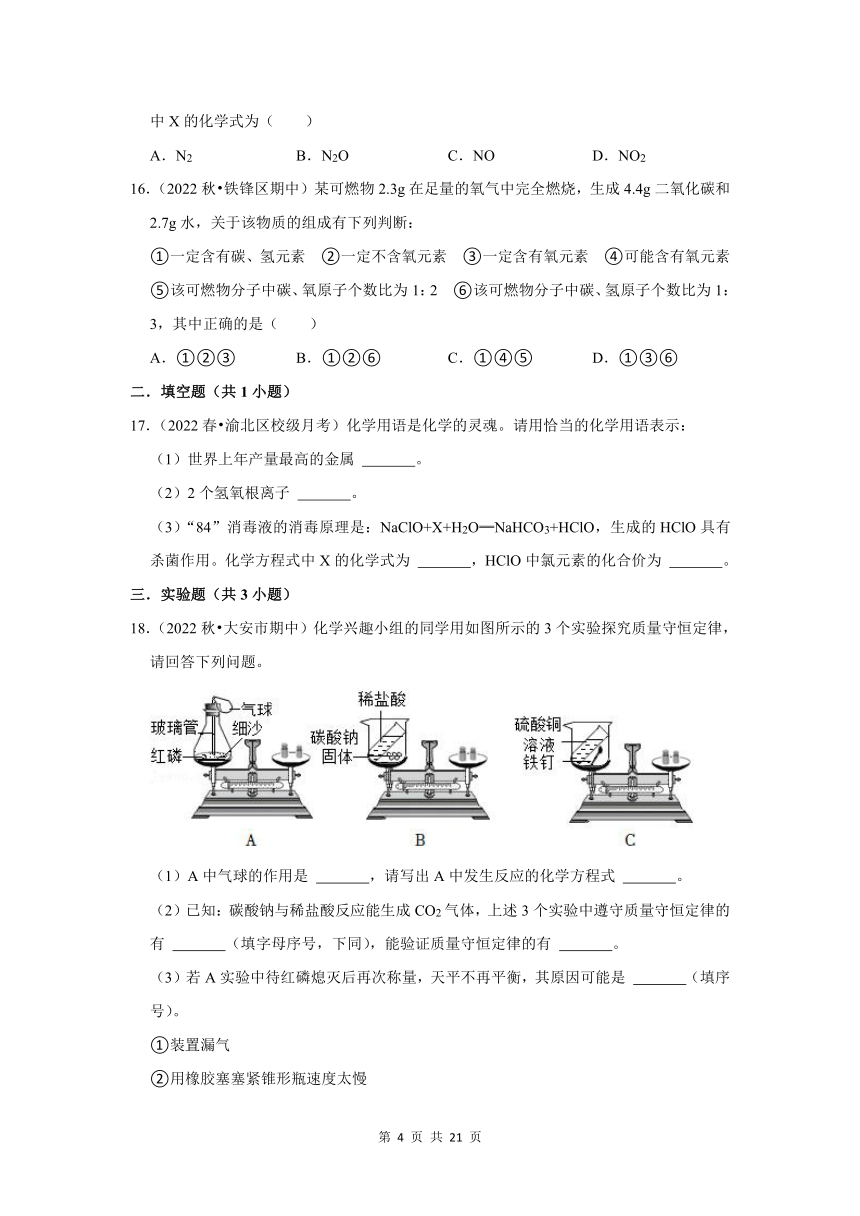
18.(2022秋 大安市期中)化学兴趣小组的同学用如图所示的3个实验探究质量守恒定律,请回答下列问题。
(1)A中气球的作用是 ,请写出A中发生反应的化学方程式 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 (填字母序号,下同),能验证质量守恒定律的有 。
(3)若A实验中待红磷熄灭后再次称量,天平不再平衡,其原因可能是 (填序号)。
①装置漏气
②用橡胶塞塞紧锥形瓶速度太慢
③红磷太少
④没有等锥形瓶冷却就再次称量
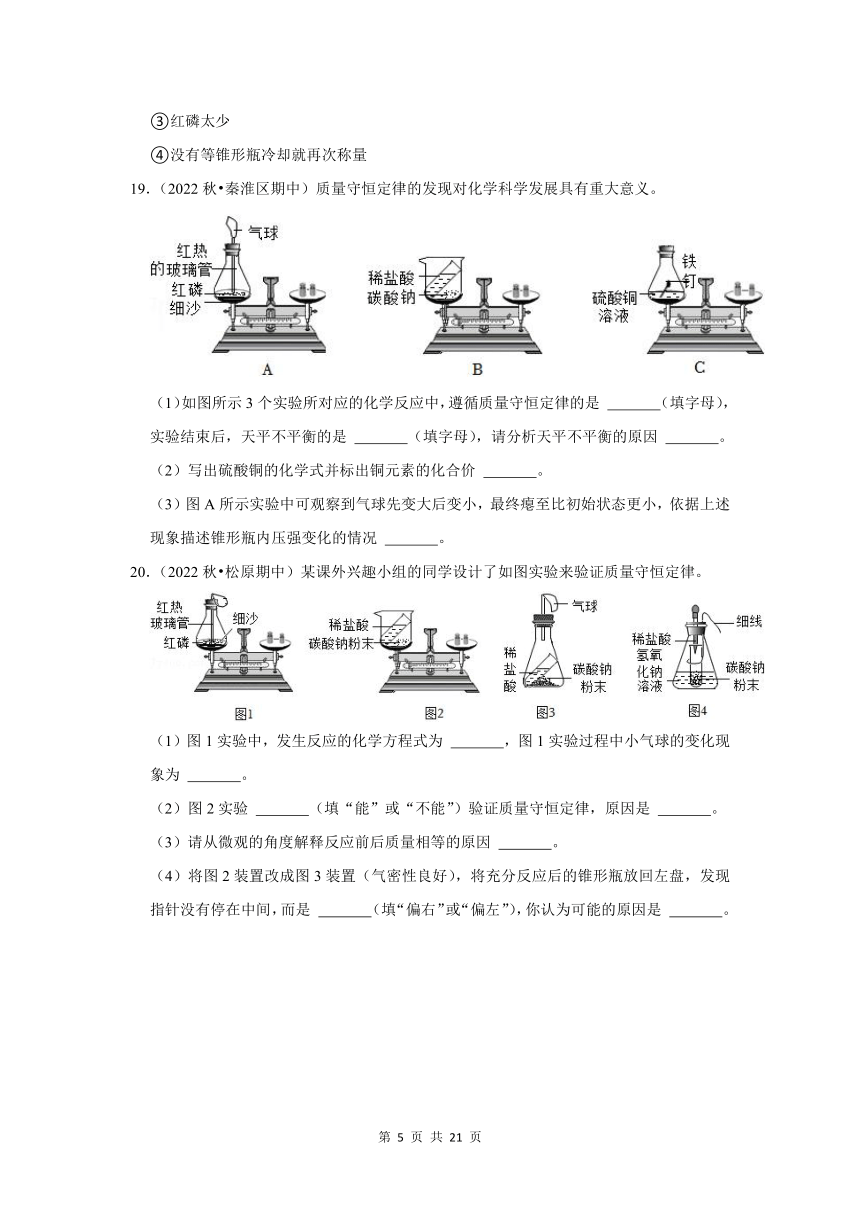
19.(2022秋 秦淮区期中)质量守恒定律的发现对化学科学发展具有重大意义。
(1)如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是 (填字母),实验结束后,天平不平衡的是 (填字母),请分析天平不平衡的原因 。
(2)写出硫酸铜的化学式并标出铜元素的化合价 。
(3)图A所示实验中可观察到气球先变大后变小,最终瘪至比初始状态更小,依据上述现象描述锥形瓶内压强变化的情况 。
20.(2022秋 松原期中)某课外兴趣小组的同学设计了如图实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为 ,图1实验过程中小气球的变化现象为 。
(2)图2实验 (填“能”或“不能”)验证质量守恒定律,原因是 。
(3)请从微观的角度解释反应前后质量相等的原因 。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是 (填“偏右”或“偏左”),你认为可能的原因是 。
化学沪教版九年级期末必刷常考题质量守恒定律及其应用
参考答案与试题解析
一.选择题(共16小题)
1.(2022秋 甘井子区期中)AgNO3见光时易分解出一种有刺激性气味的气体,该气体可能是( )
A.N2 B.SO2 C.NO2 D.H2S
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:硝酸银(AgNO3)见光分解,生成银、氧气和一种有刺激性气味的气体,该气体可能是氮元素组成的氮气,也可能是氮元素和氧元素组成的氧化物,不可能是二氧化硫、硫化氢,这是因为反应物中不含有硫元素、氢元素,氮气是一种无色无味的气体,氮元素和氧元素组成的氧化物包括一氧化氮和二氧化氮,一氧化氮是一种无色无味的气体,二氧化氮是一种红棕色气体,并且有刺激性气味,因此该气体可能是二氧化氮。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.(2022秋 碑林区校级期中)下列说法不符合质量守恒定律的是( )
A.蜡烛燃烧固体质量减轻
B.铜丝在火焰上灼烧后固体质量增加
C.硫在密闭容器中燃烧,反应前后原子的种类不发生改变
D.Cu2(OH)2CO3受热分解生成CuO、H2O、SO2三种物质
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律的内容进行分析解答即可。
【解答】解:A、蜡烛燃烧固体质量减轻,是因为生成的二氧化碳和水逸散到空气中,符合质量守恒定律,A不符合题意;
B、铜丝在火焰上灼烧后固体质量增加,是因为铜与氧气结合变成了氧化铜,增加的是氧元素的质量,符合质量守恒定律,B不符合题意;
C、硫在密闭容器中燃烧生成二氧化硫,化学反应前后,原子的种类和数目不变,不C符合题意;
D、根据质量守恒定律,化学反应前后,元素的种类不变,反应物中不含硫元素,不可能生成二氧化硫,D符合题意。
故选:D。
【点评】加强对质量守恒定律的内容的掌握是正确解答本题的关键。
3.(2022秋 铁锋区期中)黑火药是我国古代重要发明,由木炭、硫粉和硝酸钾按一定比例混合而成。其爆炸原理可用化学方程式表示为:2KNO3+3C+SK2S+X↑+3CO2↑,下列说法错误的是( )
A.X的化学式为N2
B.该反应前后元素种类不变
C.参加反应的C和S的质量比为9:8
D.K2S的化学名称为硫酸钾
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】A、由质量守恒定律:反应前后,原子种类、数目均不变,进行分析
B、由质量守恒定律:反应前后,元素种类不变,进行分析;
C、根据化学方程式中各物质的质量比的计算进行分析;
D、根据物质的名称分析。
【解答】解:A、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前钾、氮、氧、硫、碳原子个数分别为2、2、6、1、3,反应后的生成物中钾、氮、氧、硫、碳原子个数分别为2、0、6、1、3,根据反应前后原子种类、数目不变,则每个X分子由2个氮原子构成,则物质X的化学式为N2,故选项说法正确;
B、由质量守恒定律:反应前后,元素种类不变,故选项说法正确;
C、根据方程式可知,参与反应的碳和硫的质量比为(3×12):32=9:8,故选项说法正确;
D、K2S的化学名称为硫化钾,故选项说法错误;
故选:D。
【点评】本题难度不大,掌握化学反应前后原子守恒、化合物中正负化合价代数和为零等是正确解答本题的关键。
4.(2022秋 青岛期中)下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】要想验证质量守恒定律,必须注意这两点,1.必须是化学反应;2.有气体参加或生成的反应必须在密闭容器内进行。
【解答】解:A.酒精与水无法发生化学反应,不能直接用于验证质量守恒定律,故错误;
B.蜡烛燃烧是化学反应,但该反应有气体生成,应在密闭容器内进行,不能直接用于验证质量守恒定律,故错误;
C.过氧化氢溶液在二氧化锰做催化剂的条件下生成水和氧气,该反应是化学反应,且有气体生成,应在密闭容器内进行,不能直接用于验证质量守恒定律,故错误;
D.氢氧化钠与硫酸铜发生化学反应,生成硫酸钠和氢氧化铜沉淀,该反应无需在密闭容器内进行,该反应可以直接用于验证质量守恒定律,故正确;
故选:D。
【点评】掌握验证质量守恒定律的两点注意事项是解答本题的关键。
5.(2022秋 铁锋区期中)下列叙述能用质量守恒定律解释且正确的是( )
A.水结成冰前后,质量保持不变
B.氢气燃烧,参加反应的氢气和氧气的体积之和等于生成液态水的体积
C.1克碳与1克氧气完全反应生成2克二氧化碳
D.蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】质量守恒定律是物质在发生化学变化中表现出来的一种规律,适用于化学变化;物质发生物理变化,则不适用于质量守恒定律来解释;是化学变化时也要对反应前后物质的质量关系进行计算判断,即反应时是否符合固定的质量比,据此分析问题即可。
【解答】解:A、水结成冰为物理变化,故不能用质量守恒定律解释,故A不正确。
B、氢气燃烧,参加反应的氢气和氧气的质量之和等于生成液态水的质量,故B不正确;
C、碳和氧气恰好反应的质量比为3:8,1克碳与1克氧气完全反应,碳并没有完全参加反应,故不会生成2克二氧化碳,故C不正确;
D、蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和,符合质量守恒定律,故可用质量守恒定律解释,故D正确;
故选:D。
【点评】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;掌握化学变化和物理变化的判别。
6.(2022秋 开福区校级期中)化学反应前后,下列各项中,肯定没有变化的是( )
①原子数目;
②原子的种类;
③物质的种类;
④分子的种类;
⑤元素的种类;
⑥物质的总质量。
A.①②⑤⑥ B.①③⑤⑥ C.②③⑤⑥ D.③④⑥
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类、质量不变,原子的种类、总个数不变分析。
【解答】解:化学反应前后,原子的种类、质量和个数不变,元素的种类和质量不变,物质的总质量不变,但物质的种类和分子的种类肯定改变,则肯定没有变化的是①②⑤⑥;
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类、质量不变,原子的种类、总个数不变。
7.(2022秋 天山区期中)某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
A.②③ B.③④ C.②③④ D.①②③④
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律的内容以及化学式的计算的知识进行分析解答即可。
【解答】解:某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水,则该物质一定含有碳元素和氢元素,且反应前后碳元素和氢元素的质量不变;
故碳元素的质量为:4.4g×=1.2g;
氢元素的质量为:3.6g×=0.4g
故碳和氢元素的质量和为1.2g+0.4g=1.6g=物质的质量,故该物质中一定不含有氧元素;
该物质的一个分子中碳、氢原子的个数比为:=1:4;
故选:C。
【点评】加强对质量守恒定律的内容的掌握是正确解答本题的关键。
8.(2022秋 太原期中)同学们在化学实验室里进行了质量守恒定律的验证实验,并将实验数据绘制成以下图形(各物质的数据均为其在反应前或反应后所有物质中的质量分数),由图形数据分析出的结论正确的是( )
A.图中x的数值为9 B.乙是该反应的催化剂
C.丁是该反应的生成物 D.丙、丁质量变化比为8:9
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据图示中物质质量分数的变化分析,增多的为生成物,减少的为反应物,不变的可能为反应的催化剂,也可能不参加反应。
【解答】解:由图可知,甲质量分数减少为反应物,乙质量分数不变,可能为反应的催化剂,也可能不参加反应,丙质量分数增大,为生成物,根据质量守恒定律
x%=1﹣10%﹣30%﹣41%=19%,x=19,据此分析;
A、x%=1﹣10%﹣30%﹣41%=19%,x=19,不符合题意;
B、化学反应前后,乙的质量不变,乙可能是催化剂,也可能是不参与反应的杂质,不符合题意;
C、反应后,丁的质量减小,丁是反应物,不符合题意;
D、丙、丁质量变化比为:(41%﹣25%):(48%﹣30%)=8:9,符合题意;
故选:D。
【点评】本题考查了质量守恒定律的应用,物质质量分数的变化,增多的为生成物,减少的为反应物,不变的可能为反应的催化剂,也可能不参加反应。
9.(2022秋 金秀县校级期中)将一定量的丙醇(C3H8O)和氧气置于封闭的容器中引燃,测得反应前后各物质的质量如下表所示:
物质 丙醇 氧气 水 二氧化碳 一氧化碳
反应前质量/g a 12.8 0 0 0
反应后质量/g 0 0 7.2 8.8 b
列判断不符合事实的是(注:氢元素全部转化生成水)( )
A.a=3.2+b
B.该反应是氧化反应
C.参加反应的丙醇与氧气的化学计量数之比是2:9
D.生成物中碳元素与氢元素的质量比为9:2
【考点】质量守恒定律及其应用;氧化反应.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律计算出a的值,然后利用质量增加的为生成物,质量减少的为反应物,分析出反应物、生成物,书写方程式进行分析。
【解答】解:A、根据质量守恒定律,a+12.8=7.2+8.8+b,则a=3.2+b,此选项说法正确,不符合题意;
B、由表中的数据可知,该反应是丙醇在氧气中燃烧生成水、二氧化碳和一氧化碳,故是氧化反应,此选项说法正确,不符合题意;
C、根据质量守恒定律,氢元素全部转化生成水,则7.2g水中氢元素的质量为:7.2g×=0.8g,则7.2g水中氧元素的质量为:7.2g﹣0.8g=6.4g,丙醇的质量a为:0.8g÷=6g,参加反应的丙醇与氧气化学计量数比为::=1:4,此选项说法不正确,符合题意;
D、生成物中碳元素都存在于丙酮中,丙醇中碳的质量:6g×=3.6g,生成物中碳元素的质量为3.6g,生成物中氢元素都转移到水中,生成物中氢元素质量为7.2g×=0.8g,两者的比为:3.6g:0.8g=9:2,此选项说法正确,不符合题意;
故选:C。
【点评】本题考查了质量守恒定律的应用,根据化学反应前后元素的质量和种类不变、物质的总质量不变解答即可。
10.(2022 渝中区模拟)密闭容器中只发生了反应:甲+乙→丙+丁,各物质的质量变化如表所示,对表中数据的推测正确的是( )
物质 甲 乙 丙 丁
反应前的质量 10 10 0 0
反应中的质量 m1 m2 m3 l.5
反应后的质量 8 m4 3 3
A.m1+m2=20 B.m1+m4=10 C.m1:m2=1:2 D.m2:m3=16:3
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:根据题意有:参加反应的甲10﹣8=2,则参加反应的乙的质量为3+3﹣2=4,则m4=10﹣4=6;故甲、乙、丙、丁反应的质量比为2:4:3:3;所以参加反应的甲、乙、丙的质量为1,2,1.5;故m1=10﹣1=9,m2=10﹣2=8,m3=1.5;
A、根据以上分析,m1+m2=9+8=17;该选项说法不正确;
B、根据题意有:m1+m4=9+6=15;,该选项说法不正确;
C、根据以上分析,m1:m2=9:8;,该选项说法不正确;
D、根据以上分析,m2:m3=8:1.5=16:3;,该选项说法正确;
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
11.(2022秋 高明区期中)已知反应CO2+3H2X+CH3OH,则X的化学式为( )
A.CH4 B.H2O C.CO D.C2H5OH
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断X的化学式。
【解答】解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前碳、氢、氧原子个数分别为1、6、2,反应后的生成物中碳、氢、氧原子个数分别为1、4、1,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O。
故选:B。
【点评】本题难度不大,掌握化学反应前后原子守恒是正确解答此类题的关键。
12.(2022秋 长垣市期中)分别分解高锰酸钾、氯酸钾、过氧化氢三种物质都能制得氧气。这说明三种物质的组成中都含有( )
A.氧元素 B.氧分子 C.氧气 D.氧原子
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,化学反应前后元素的种类不变来分析。
【解答】解:根据质量守恒定律,化学反应前后元素的种类不变,氧气是由氧元素组成的,要能制得氧气,反应物中必须含有氧元素。
故选:A。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
13.(2022秋 天门期中)“北斗三号”全球卫星导航系统组网成功,标志着中国航天事业迈向了新高度。火箭发射用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,反应的化学方程式为C2H8N2+2N2O4═3N2+4X+2CO2,则X的化学式为( )
A.NH3 B.H2O C.O2 D.NO2
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,化学反应前后原子的种类和数目不变来分析。
【解答】解:根据质量守恒定律,化学反应前后原子的种类和数目不变。由反应的化学方程式:C2H8N2+2N2O4═3N2+4X+2CO2可知,反应物中含C、H、N、O的个数分别是2、8、6、8,生成物中含C、H、N、O的个数分别是2、0、6、4,则X中含由8个H、4个O,所以X的化学式为:H2O。
故选:B。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
14.(2022秋 黄岛区校级月考)在A+B=C+D的反应中,9.8gA和8gB完全反应生成14.2gC,同时得到D的质量为( )
A.1.8g B.3.6g C.7.2g D.14.4g
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:同时得到D的质量为9.8g+8g﹣14.2g=3.6g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.(2022秋 红桥区期中)化学反应方程式是解决宏、微、符三重表征的重要化学用语,根据化学方程式中元素守恒、原子守恒原则,分析Fe+4HNO3=Fe(NO3)3+X↑+2H2O中X的化学式为( )
A.N2 B.N2O C.NO D.NO2
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,反应前后原子的种类数目不变来分析。
【解答】解:由质量守恒定律,反应前后原子的种类、数目不变,由反应的化学方程式Fe+4HNO3=Fe(NO3)3+X↑+2H2O可知,反应前铁、氢、氮、氧原子个数分别为1、4、4、12,反应后的生成物中铁、氢、氮、氧原子个数分别为1、4、3、11,根据反应前后原子种类、数目不变,X分子中含有1个氮原子和1个氧原子,则X的化学式为NO。
故选:C。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
16.(2022秋 铁锋区期中)某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,关于该物质的组成有下列判断:
①一定含有碳、氢元素 ②一定不含氧元素 ③一定含有氧元素 ④可能含有氧元素 ⑤该可燃物分子中碳、氧原子个数比为1:2 ⑥该可燃物分子中碳、氢原子个数比为1:3,其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,反应前后元素种类不变,以及二氧化碳和水的质量求出碳元素和氢元素的质量,与可燃物的质量比较可知该可燃物是否含有氧元素,由碳、氢元素的质量及相对原子质量可知碳、氢原子的个数比来分析。
【解答】解:某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,氧气中含有氧元素,二氧化碳中含有碳、氧元素,水中含有氢、氧元素,则该可燃物中一定含有碳、氢元素;4.4g二氧化碳中碳元素的质量为:4.4g××100%=1.2g,2.7g水中氢元素的质量为:2.7g××100%=0.3g,因为1.2g+0.3g=1.5g<2.3g,则该可燃物中还含有氧元素,其中氧元素的质量为:2.3g﹣1.5g=0.8g;则该可燃物中碳、氢、氧原子个数比为::=2:6:1。
故选:D。
【点评】本题主要考查质量守恒定律的应用,解题的关键是分析题中数据,灵活运用质量守恒定律。
二.填空题(共1小题)
17.(2022春 渝北区校级月考)化学用语是化学的灵魂。请用恰当的化学用语表示:
(1)世界上年产量最高的金属 Fe 。
(2)2个氢氧根离子 2OH﹣ 。
(3)“84”消毒液的消毒原理是:NaClO+X+H2O═NaHCO3+HClO,生成的HClO具有杀菌作用。化学方程式中X的化学式为 CO2 ,HClO中氯元素的化合价为 HO 。
【考点】质量守恒定律及其应用;有关元素化合价的计算;化学符号及其周围数字的意义.
【专题】化学式的计算;化学用语和质量守恒定律.
【分析】(1)铁由原子构成,化学式与元素符号相同。
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个离子,就在其离子符号前加上相应的数字。
(3)根据化学反应前后,原子的质量不变,原子的种类、总个数不变分析;化合价的表示方法,在该元素符号的上方用正负号和数字表示,正负号在前,数字在后。
【解答】解:(1)世界上年产量最高的金属是铁,铁由原子构成,化学式与元素符号相同,表示为Fe;
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个离子,就在其离子符号前加上相应的数字。2个氢氧根离子表示为2OH﹣;
(3)由NaClO+X+H2O═NaHCO3+HClO可知,反应前碳原子、钠原子、氯原子、氢原子、氧原子个数分别为0、1、1、2、2,反应后碳原子、钠原子、氯原子、氢原子、氧原子个数分别为1、1、1、2、4,化学反应前后,原子的质量不变,原子的种类、总个数不变,则X中有1个碳原子,2个氧原子,则X化学式为CO2;HClO中氢元素化合价为+1,氧元素化合价为﹣2,根据化合物中正负化合价代数和为0,氯元素的化合价为+1,表示为HO。
故答案为:(1)Fe;
(2)2OH﹣;
(3)CO2;HO。
【点评】本题难度不大,主要考查同学们对常见化学用语(化学式、化合价、离子符号等)的书写和理解能力。
三.实验题(共3小题)
18.(2022秋 大安市期中)化学兴趣小组的同学用如图所示的3个实验探究质量守恒定律,请回答下列问题。
(1)A中气球的作用是 缓冲气压,防止温度过高,气体冲开橡皮塞 ,请写出A中发生反应的化学方程式 4P+5O22P2O5 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 ABC (填字母序号,下同),能验证质量守恒定律的有 AC 。
(3)若A实验中待红磷熄灭后再次称量,天平不再平衡,其原因可能是 ①②④ (填序号)。
①装置漏气
②用橡胶塞塞紧锥形瓶速度太慢
③红磷太少
④没有等锥形瓶冷却就再次称量
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)A装置中发生的反应是红磷燃烧,该反应现象是放出大量的热,产生白烟,据此解答;
(2)所有的化学反应都遵守质量守恒定律,而有气体参与的化学反应,需要在密闭容器中进行才能验证质量守恒定律;
(3)根据红磷燃烧的实验误差分析解答。
【解答】解:(1)由于红磷燃烧过程中放出大量的热,密闭空间内,气体受热膨胀,压强变大,为了缓冲气压,用一根玻璃管连接气球,平衡内外压强;故填:防止温度过高,气体冲开橡皮塞;4P+5O22P2O5;
(2)上述三个实验都是化学反应,都遵守质量守恒定律,而B实验是碳酸钠与稀盐酸反应能生成CO2气体,需要在密闭容器中进行才能验证质量守恒定律;
(3)①装置漏气,导致锥形瓶内氧气未消耗完全,无法验证参加反应的氧气的质量是多少,故反应结束后,无法使天平平衡;
②用橡胶塞塞紧锥形瓶速度太慢,相当于装置漏气,故反应结束后,天平也无法平衡;
③质量守恒定律是指参加反应的各物质的总质量等于反应后生成的各物质的总质量,红磷太少不影响;
④没有等锥形瓶冷却就再次称量,此时气体受热膨胀,参与的氧气的质量偏小,造成天平不平衡;
故选:①②④。
故答案为:(1)缓冲气压,防止温度过高,气体冲开橡皮塞;4P+5O22P2O5;
(2)ABC;AC;
(3)①②④。
【点评】本题难度系数偏大,考查学生对质量守恒定律的实验探究的掌握,需要积累多个易错题才能准确作答。
19.(2022秋 秦淮区期中)质量守恒定律的发现对化学科学发展具有重大意义。
(1)如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是 ABC (填字母),实验结束后,天平不平衡的是 B (填字母),请分析天平不平衡的原因 反应在烧杯中进行,生成的二氧化碳逸散到空气中 。
(2)写出硫酸铜的化学式并标出铜元素的化合价 4 。
(3)图A所示实验中可观察到气球先变大后变小,最终瘪至比初始状态更小,依据上述现象描述锥形瓶内压强变化的情况 锥形瓶内的压强先变大后变小,最终压强小于初始压强 。
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)根据所有的化学反应都遵循质量守恒定律,以及B实验是在烧杯中进行,生成的二氧化碳逸散到空气中来分析;
(2)根据化学式的书写,以及化合价原则来分析;
(3)根据图A所示实验中,红磷燃烧放热,瓶内气体受热膨胀,反应结束恢复到室温后,锥形瓶内氧气被消耗来分析。
【解答】解:(1)所有的化学反应都遵循质量守恒定律,如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是ABC;实验结束后,由于B实验是在烧杯中进行,生成的二氧化碳逸散到空气中,导致左盘的质量减小,天平不平衡;而A、C的实验都是在密闭容器中进行,所以天平仍然保持平衡。
(2)根据化合价原则,化合物中各元素化合价代数和为0,硫酸铜中硫酸根整体显﹣2价,所以硫酸铜中铜元素的化合价为+2,表示为:4。
(3)图A所示实验中,红磷燃烧放热,瓶内气体受热膨胀,反应结束恢复到室温后,锥形瓶内氧气被消耗,所以锥形瓶内的压强先变大后变小,最终压强小于初始压强。
故答案为:
(1)ABC;B;反应在烧杯中进行,生成的二氧化碳逸散到空气中;
(2)4;
(3)锥形瓶内的压强先变大后变小,最终压强小于初始压强。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.(2022秋 松原期中)某课外兴趣小组的同学设计了如图实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为 4P+5O22P2O5 ,图1实验过程中小气球的变化现象为 先变大后变瘪 。
(2)图2实验 不能 (填“能”或“不能”)验证质量守恒定律,原因是 反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等 。
(3)请从微观的角度解释反应前后质量相等的原因 化学反应前后原子的种类、数目和质量没有发生改变 。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是 偏右 (填“偏右”或“偏左”),你认为可能的原因是 气球膨胀之后所受浮力增大 。
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)根据红磷和氧气在点燃的条件下生成五氧化二磷,该反应放热同时消耗瓶内氧气来分析;
(2)根据图2实验不是在密闭容器中进行,生成的二氧化碳会逸散到空气中来分析;
(3)根据原子是化学变化中的最小粒子,化学反应前后原子的种类、数目和质量没有发生改变来分析;
(4)根据气球膨胀之后所受浮力增大来分析。
【解答】解:(1)图1实验中,发生的反应为红磷和氧气在点燃的条件下生成五氧化二磷,化学方程式为:4P+5O22P2O5;红磷燃烧放热,使压强增大,气球膨胀变大,反应结束后温度降低,而燃烧消耗了装置内的氧气,气球缩小变瘪,所以过程中小气球的变化现象为:先变大后变瘪。
(2)图2实验不能验证质量守恒定律,原因是:反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等。
(3)原子是化学变化中的最小粒子,所以反应前后质量相等的原因是:化学反应前后原子的种类、数目和质量没有发生改变。
(4)将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是偏右;可能的原因是:气球膨胀之后所受浮力增大。
故答案为:
(1)4P+5O22P2O5;先变大后变瘪;
(2)不能;反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等;
(3)化学反应前后原子的种类、数目和质量没有发生改变;
(4)偏右;气球膨胀之后所受浮力增大。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变
1.质量守恒定律及其应用
一.选择题(共16小题)
1.(2022秋 甘井子区期中)AgNO3见光时易分解出一种有刺激性气味的气体,该气体可能是( )
A.N2 B.SO2 C.NO2 D.H2S
2.(2022秋 碑林区校级期中)下列说法不符合质量守恒定律的是( )
A.蜡烛燃烧固体质量减轻
B.铜丝在火焰上灼烧后固体质量增加
C.硫在密闭容器中燃烧,反应前后原子的种类不发生改变
D.Cu2(OH)2CO3受热分解生成CuO、H2O、SO2三种物质
3.(2022秋 铁锋区期中)黑火药是我国古代重要发明,由木炭、硫粉和硝酸钾按一定比例混合而成。其爆炸原理可用化学方程式表示为:2KNO3+3C+SK2S+X↑+3CO2↑,下列说法错误的是( )
A.X的化学式为N2
B.该反应前后元素种类不变
C.参加反应的C和S的质量比为9:8
D.K2S的化学名称为硫酸钾
4.(2022秋 青岛期中)下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
5.(2022秋 铁锋区期中)下列叙述能用质量守恒定律解释且正确的是( )
A.水结成冰前后,质量保持不变
B.氢气燃烧,参加反应的氢气和氧气的体积之和等于生成液态水的体积
C.1克碳与1克氧气完全反应生成2克二氧化碳
D.蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
6.(2022秋 开福区校级期中)化学反应前后,下列各项中,肯定没有变化的是( )
①原子数目;
②原子的种类;
③物质的种类;
④分子的种类;
⑤元素的种类;
⑥物质的总质量。
A.①②⑤⑥ B.①③⑤⑥ C.②③⑤⑥ D.③④⑥
7.(2022秋 天山区期中)某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
A.②③ B.③④ C.②③④ D.①②③④
8.(2022秋 太原期中)同学们在化学实验室里进行了质量守恒定律的验证实验,并将实验数据绘制成以下图形(各物质的数据均为其在反应前或反应后所有物质中的质量分数),由图形数据分析出的结论正确的是( )
A.图中x的数值为9 B.乙是该反应的催化剂
C.丁是该反应的生成物 D.丙、丁质量变化比为8:9
9.(2022秋 金秀县校级期中)将一定量的丙醇(C3H8O)和氧气置于封闭的容器中引燃,测得反应前后各物质的质量如下表所示:
物质 丙醇 氧气 水 二氧化碳 一氧化碳
反应前质量/g a 12.8 0 0 0
反应后质量/g 0 0 7.2 8.8 b
列判断不符合事实的是(注:氢元素全部转化生成水)( )
A.a=3.2+b
B.该反应是氧化反应
C.参加反应的丙醇与氧气的化学计量数之比是2:9
D.生成物中碳元素与氢元素的质量比为9:2
10.(2022 渝中区模拟)密闭容器中只发生了反应:甲+乙→丙+丁,各物质的质量变化如表所示,对表中数据的推测正确的是( )
物质 甲 乙 丙 丁
反应前的质量 10 10 0 0
反应中的质量 m1 m2 m3 l.5
反应后的质量 8 m4 3 3
A.m1+m2=20 B.m1+m4=10 C.m1:m2=1:2 D.m2:m3=16:3
11.(2022秋 高明区期中)已知反应CO2+3H2X+CH3OH,则X的化学式为( )
A.CH4 B.H2O C.CO D.C2H5OH
12.(2022秋 长垣市期中)分别分解高锰酸钾、氯酸钾、过氧化氢三种物质都能制得氧气。这说明三种物质的组成中都含有( )
A.氧元素 B.氧分子 C.氧气 D.氧原子
13.(2022秋 天门期中)“北斗三号”全球卫星导航系统组网成功,标志着中国航天事业迈向了新高度。火箭发射用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,反应的化学方程式为C2H8N2+2N2O4═3N2+4X+2CO2,则X的化学式为( )
A.NH3 B.H2O C.O2 D.NO2
14.(2022秋 黄岛区校级月考)在A+B=C+D的反应中,9.8gA和8gB完全反应生成14.2gC,同时得到D的质量为( )
A.1.8g B.3.6g C.7.2g D.14.4g
15.(2022秋 红桥区期中)化学反应方程式是解决宏、微、符三重表征的重要化学用语,根据化学方程式中元素守恒、原子守恒原则,分析Fe+4HNO3=Fe(NO3)3+X↑+2H2O中X的化学式为( )
A.N2 B.N2O C.NO D.NO2
16.(2022秋 铁锋区期中)某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,关于该物质的组成有下列判断:
①一定含有碳、氢元素 ②一定不含氧元素 ③一定含有氧元素 ④可能含有氧元素 ⑤该可燃物分子中碳、氧原子个数比为1:2 ⑥该可燃物分子中碳、氢原子个数比为1:3,其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
二.填空题(共1小题)
17.(2022春 渝北区校级月考)化学用语是化学的灵魂。请用恰当的化学用语表示:
(1)世界上年产量最高的金属 。
(2)2个氢氧根离子 。
(3)“84”消毒液的消毒原理是:NaClO+X+H2O═NaHCO3+HClO,生成的HClO具有杀菌作用。化学方程式中X的化学式为 ,HClO中氯元素的化合价为 。
三.实验题(共3小题)
18.(2022秋 大安市期中)化学兴趣小组的同学用如图所示的3个实验探究质量守恒定律,请回答下列问题。
(1)A中气球的作用是 ,请写出A中发生反应的化学方程式 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 (填字母序号,下同),能验证质量守恒定律的有 。
(3)若A实验中待红磷熄灭后再次称量,天平不再平衡,其原因可能是 (填序号)。
①装置漏气
②用橡胶塞塞紧锥形瓶速度太慢
③红磷太少
④没有等锥形瓶冷却就再次称量
19.(2022秋 秦淮区期中)质量守恒定律的发现对化学科学发展具有重大意义。
(1)如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是 (填字母),实验结束后,天平不平衡的是 (填字母),请分析天平不平衡的原因 。
(2)写出硫酸铜的化学式并标出铜元素的化合价 。
(3)图A所示实验中可观察到气球先变大后变小,最终瘪至比初始状态更小,依据上述现象描述锥形瓶内压强变化的情况 。
20.(2022秋 松原期中)某课外兴趣小组的同学设计了如图实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为 ,图1实验过程中小气球的变化现象为 。
(2)图2实验 (填“能”或“不能”)验证质量守恒定律,原因是 。
(3)请从微观的角度解释反应前后质量相等的原因 。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是 (填“偏右”或“偏左”),你认为可能的原因是 。
化学沪教版九年级期末必刷常考题质量守恒定律及其应用
参考答案与试题解析
一.选择题(共16小题)
1.(2022秋 甘井子区期中)AgNO3见光时易分解出一种有刺激性气味的气体,该气体可能是( )
A.N2 B.SO2 C.NO2 D.H2S
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:硝酸银(AgNO3)见光分解,生成银、氧气和一种有刺激性气味的气体,该气体可能是氮元素组成的氮气,也可能是氮元素和氧元素组成的氧化物,不可能是二氧化硫、硫化氢,这是因为反应物中不含有硫元素、氢元素,氮气是一种无色无味的气体,氮元素和氧元素组成的氧化物包括一氧化氮和二氧化氮,一氧化氮是一种无色无味的气体,二氧化氮是一种红棕色气体,并且有刺激性气味,因此该气体可能是二氧化氮。
故选:C。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.(2022秋 碑林区校级期中)下列说法不符合质量守恒定律的是( )
A.蜡烛燃烧固体质量减轻
B.铜丝在火焰上灼烧后固体质量增加
C.硫在密闭容器中燃烧,反应前后原子的种类不发生改变
D.Cu2(OH)2CO3受热分解生成CuO、H2O、SO2三种物质
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律的内容进行分析解答即可。
【解答】解:A、蜡烛燃烧固体质量减轻,是因为生成的二氧化碳和水逸散到空气中,符合质量守恒定律,A不符合题意;
B、铜丝在火焰上灼烧后固体质量增加,是因为铜与氧气结合变成了氧化铜,增加的是氧元素的质量,符合质量守恒定律,B不符合题意;
C、硫在密闭容器中燃烧生成二氧化硫,化学反应前后,原子的种类和数目不变,不C符合题意;
D、根据质量守恒定律,化学反应前后,元素的种类不变,反应物中不含硫元素,不可能生成二氧化硫,D符合题意。
故选:D。
【点评】加强对质量守恒定律的内容的掌握是正确解答本题的关键。
3.(2022秋 铁锋区期中)黑火药是我国古代重要发明,由木炭、硫粉和硝酸钾按一定比例混合而成。其爆炸原理可用化学方程式表示为:2KNO3+3C+SK2S+X↑+3CO2↑,下列说法错误的是( )
A.X的化学式为N2
B.该反应前后元素种类不变
C.参加反应的C和S的质量比为9:8
D.K2S的化学名称为硫酸钾
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】A、由质量守恒定律:反应前后,原子种类、数目均不变,进行分析
B、由质量守恒定律:反应前后,元素种类不变,进行分析;
C、根据化学方程式中各物质的质量比的计算进行分析;
D、根据物质的名称分析。
【解答】解:A、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前钾、氮、氧、硫、碳原子个数分别为2、2、6、1、3,反应后的生成物中钾、氮、氧、硫、碳原子个数分别为2、0、6、1、3,根据反应前后原子种类、数目不变,则每个X分子由2个氮原子构成,则物质X的化学式为N2,故选项说法正确;
B、由质量守恒定律:反应前后,元素种类不变,故选项说法正确;
C、根据方程式可知,参与反应的碳和硫的质量比为(3×12):32=9:8,故选项说法正确;
D、K2S的化学名称为硫化钾,故选项说法错误;
故选:D。
【点评】本题难度不大,掌握化学反应前后原子守恒、化合物中正负化合价代数和为零等是正确解答本题的关键。
4.(2022秋 青岛期中)下列实验能够直接用于验证质量守恒定律的是( )
A. B.
C. D.
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】要想验证质量守恒定律,必须注意这两点,1.必须是化学反应;2.有气体参加或生成的反应必须在密闭容器内进行。
【解答】解:A.酒精与水无法发生化学反应,不能直接用于验证质量守恒定律,故错误;
B.蜡烛燃烧是化学反应,但该反应有气体生成,应在密闭容器内进行,不能直接用于验证质量守恒定律,故错误;
C.过氧化氢溶液在二氧化锰做催化剂的条件下生成水和氧气,该反应是化学反应,且有气体生成,应在密闭容器内进行,不能直接用于验证质量守恒定律,故错误;
D.氢氧化钠与硫酸铜发生化学反应,生成硫酸钠和氢氧化铜沉淀,该反应无需在密闭容器内进行,该反应可以直接用于验证质量守恒定律,故正确;
故选:D。
【点评】掌握验证质量守恒定律的两点注意事项是解答本题的关键。
5.(2022秋 铁锋区期中)下列叙述能用质量守恒定律解释且正确的是( )
A.水结成冰前后,质量保持不变
B.氢气燃烧,参加反应的氢气和氧气的体积之和等于生成液态水的体积
C.1克碳与1克氧气完全反应生成2克二氧化碳
D.蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】质量守恒定律是物质在发生化学变化中表现出来的一种规律,适用于化学变化;物质发生物理变化,则不适用于质量守恒定律来解释;是化学变化时也要对反应前后物质的质量关系进行计算判断,即反应时是否符合固定的质量比,据此分析问题即可。
【解答】解:A、水结成冰为物理变化,故不能用质量守恒定律解释,故A不正确。
B、氢气燃烧,参加反应的氢气和氧气的质量之和等于生成液态水的质量,故B不正确;
C、碳和氧气恰好反应的质量比为3:8,1克碳与1克氧气完全反应,碳并没有完全参加反应,故不会生成2克二氧化碳,故C不正确;
D、蜡烛燃烧,生成物的质量之和等于蜡烛减少的质量与消耗氧气的质量之和,符合质量守恒定律,故可用质量守恒定律解释,故D正确;
故选:D。
【点评】根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;掌握化学变化和物理变化的判别。
6.(2022秋 开福区校级期中)化学反应前后,下列各项中,肯定没有变化的是( )
①原子数目;
②原子的种类;
③物质的种类;
④分子的种类;
⑤元素的种类;
⑥物质的总质量。
A.①②⑤⑥ B.①③⑤⑥ C.②③⑤⑥ D.③④⑥
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类、质量不变,原子的种类、总个数不变分析。
【解答】解:化学反应前后,原子的种类、质量和个数不变,元素的种类和质量不变,物质的总质量不变,但物质的种类和分子的种类肯定改变,则肯定没有变化的是①②⑤⑥;
故选:A。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类、质量不变,原子的种类、总个数不变。
7.(2022秋 天山区期中)某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水。则下列说法正确的是( )
①该物质中一定含有氧元素
②该物质中一定不含氧元素
③该物质中一定含有碳、氢元素
④该物质的一个分子中碳、氢原子的个数比为1:4
A.②③ B.③④ C.②③④ D.①②③④
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律的内容以及化学式的计算的知识进行分析解答即可。
【解答】解:某物质1.6克在空气中充分燃烧共生成4.4克二氧化碳和3.6克水,则该物质一定含有碳元素和氢元素,且反应前后碳元素和氢元素的质量不变;
故碳元素的质量为:4.4g×=1.2g;
氢元素的质量为:3.6g×=0.4g
故碳和氢元素的质量和为1.2g+0.4g=1.6g=物质的质量,故该物质中一定不含有氧元素;
该物质的一个分子中碳、氢原子的个数比为:=1:4;
故选:C。
【点评】加强对质量守恒定律的内容的掌握是正确解答本题的关键。
8.(2022秋 太原期中)同学们在化学实验室里进行了质量守恒定律的验证实验,并将实验数据绘制成以下图形(各物质的数据均为其在反应前或反应后所有物质中的质量分数),由图形数据分析出的结论正确的是( )
A.图中x的数值为9 B.乙是该反应的催化剂
C.丁是该反应的生成物 D.丙、丁质量变化比为8:9
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据图示中物质质量分数的变化分析,增多的为生成物,减少的为反应物,不变的可能为反应的催化剂,也可能不参加反应。
【解答】解:由图可知,甲质量分数减少为反应物,乙质量分数不变,可能为反应的催化剂,也可能不参加反应,丙质量分数增大,为生成物,根据质量守恒定律
x%=1﹣10%﹣30%﹣41%=19%,x=19,据此分析;
A、x%=1﹣10%﹣30%﹣41%=19%,x=19,不符合题意;
B、化学反应前后,乙的质量不变,乙可能是催化剂,也可能是不参与反应的杂质,不符合题意;
C、反应后,丁的质量减小,丁是反应物,不符合题意;
D、丙、丁质量变化比为:(41%﹣25%):(48%﹣30%)=8:9,符合题意;
故选:D。
【点评】本题考查了质量守恒定律的应用,物质质量分数的变化,增多的为生成物,减少的为反应物,不变的可能为反应的催化剂,也可能不参加反应。
9.(2022秋 金秀县校级期中)将一定量的丙醇(C3H8O)和氧气置于封闭的容器中引燃,测得反应前后各物质的质量如下表所示:
物质 丙醇 氧气 水 二氧化碳 一氧化碳
反应前质量/g a 12.8 0 0 0
反应后质量/g 0 0 7.2 8.8 b
列判断不符合事实的是(注:氢元素全部转化生成水)( )
A.a=3.2+b
B.该反应是氧化反应
C.参加反应的丙醇与氧气的化学计量数之比是2:9
D.生成物中碳元素与氢元素的质量比为9:2
【考点】质量守恒定律及其应用;氧化反应.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律计算出a的值,然后利用质量增加的为生成物,质量减少的为反应物,分析出反应物、生成物,书写方程式进行分析。
【解答】解:A、根据质量守恒定律,a+12.8=7.2+8.8+b,则a=3.2+b,此选项说法正确,不符合题意;
B、由表中的数据可知,该反应是丙醇在氧气中燃烧生成水、二氧化碳和一氧化碳,故是氧化反应,此选项说法正确,不符合题意;
C、根据质量守恒定律,氢元素全部转化生成水,则7.2g水中氢元素的质量为:7.2g×=0.8g,则7.2g水中氧元素的质量为:7.2g﹣0.8g=6.4g,丙醇的质量a为:0.8g÷=6g,参加反应的丙醇与氧气化学计量数比为::=1:4,此选项说法不正确,符合题意;
D、生成物中碳元素都存在于丙酮中,丙醇中碳的质量:6g×=3.6g,生成物中碳元素的质量为3.6g,生成物中氢元素都转移到水中,生成物中氢元素质量为7.2g×=0.8g,两者的比为:3.6g:0.8g=9:2,此选项说法正确,不符合题意;
故选:C。
【点评】本题考查了质量守恒定律的应用,根据化学反应前后元素的质量和种类不变、物质的总质量不变解答即可。
10.(2022 渝中区模拟)密闭容器中只发生了反应:甲+乙→丙+丁,各物质的质量变化如表所示,对表中数据的推测正确的是( )
物质 甲 乙 丙 丁
反应前的质量 10 10 0 0
反应中的质量 m1 m2 m3 l.5
反应后的质量 8 m4 3 3
A.m1+m2=20 B.m1+m4=10 C.m1:m2=1:2 D.m2:m3=16:3
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:根据题意有:参加反应的甲10﹣8=2,则参加反应的乙的质量为3+3﹣2=4,则m4=10﹣4=6;故甲、乙、丙、丁反应的质量比为2:4:3:3;所以参加反应的甲、乙、丙的质量为1,2,1.5;故m1=10﹣1=9,m2=10﹣2=8,m3=1.5;
A、根据以上分析,m1+m2=9+8=17;该选项说法不正确;
B、根据题意有:m1+m4=9+6=15;,该选项说法不正确;
C、根据以上分析,m1:m2=9:8;,该选项说法不正确;
D、根据以上分析,m2:m3=8:1.5=16:3;,该选项说法正确;
故选:D。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
11.(2022秋 高明区期中)已知反应CO2+3H2X+CH3OH,则X的化学式为( )
A.CH4 B.H2O C.CO D.C2H5OH
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断X的化学式。
【解答】解:由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式,反应前碳、氢、氧原子个数分别为1、6、2,反应后的生成物中碳、氢、氧原子个数分别为1、4、1,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O。
故选:B。
【点评】本题难度不大,掌握化学反应前后原子守恒是正确解答此类题的关键。
12.(2022秋 长垣市期中)分别分解高锰酸钾、氯酸钾、过氧化氢三种物质都能制得氧气。这说明三种物质的组成中都含有( )
A.氧元素 B.氧分子 C.氧气 D.氧原子
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,化学反应前后元素的种类不变来分析。
【解答】解:根据质量守恒定律,化学反应前后元素的种类不变,氧气是由氧元素组成的,要能制得氧气,反应物中必须含有氧元素。
故选:A。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
13.(2022秋 天门期中)“北斗三号”全球卫星导航系统组网成功,标志着中国航天事业迈向了新高度。火箭发射用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,反应的化学方程式为C2H8N2+2N2O4═3N2+4X+2CO2,则X的化学式为( )
A.NH3 B.H2O C.O2 D.NO2
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,化学反应前后原子的种类和数目不变来分析。
【解答】解:根据质量守恒定律,化学反应前后原子的种类和数目不变。由反应的化学方程式:C2H8N2+2N2O4═3N2+4X+2CO2可知,反应物中含C、H、N、O的个数分别是2、8、6、8,生成物中含C、H、N、O的个数分别是2、0、6、4,则X中含由8个H、4个O,所以X的化学式为:H2O。
故选:B。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
14.(2022秋 黄岛区校级月考)在A+B=C+D的反应中,9.8gA和8gB完全反应生成14.2gC,同时得到D的质量为( )
A.1.8g B.3.6g C.7.2g D.14.4g
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:同时得到D的质量为9.8g+8g﹣14.2g=3.6g。
故选:B。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
15.(2022秋 红桥区期中)化学反应方程式是解决宏、微、符三重表征的重要化学用语,根据化学方程式中元素守恒、原子守恒原则,分析Fe+4HNO3=Fe(NO3)3+X↑+2H2O中X的化学式为( )
A.N2 B.N2O C.NO D.NO2
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,反应前后原子的种类数目不变来分析。
【解答】解:由质量守恒定律,反应前后原子的种类、数目不变,由反应的化学方程式Fe+4HNO3=Fe(NO3)3+X↑+2H2O可知,反应前铁、氢、氮、氧原子个数分别为1、4、4、12,反应后的生成物中铁、氢、氮、氧原子个数分别为1、4、3、11,根据反应前后原子种类、数目不变,X分子中含有1个氮原子和1个氧原子,则X的化学式为NO。
故选:C。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变。
16.(2022秋 铁锋区期中)某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,关于该物质的组成有下列判断:
①一定含有碳、氢元素 ②一定不含氧元素 ③一定含有氧元素 ④可能含有氧元素 ⑤该可燃物分子中碳、氧原子个数比为1:2 ⑥该可燃物分子中碳、氢原子个数比为1:3,其中正确的是( )
A.①②③ B.①②⑥ C.①④⑤ D.①③⑥
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】根据质量守恒定律,反应前后元素种类不变,以及二氧化碳和水的质量求出碳元素和氢元素的质量,与可燃物的质量比较可知该可燃物是否含有氧元素,由碳、氢元素的质量及相对原子质量可知碳、氢原子的个数比来分析。
【解答】解:某可燃物2.3g在足量的氧气中完全燃烧,生成4.4g二氧化碳和2.7g水,氧气中含有氧元素,二氧化碳中含有碳、氧元素,水中含有氢、氧元素,则该可燃物中一定含有碳、氢元素;4.4g二氧化碳中碳元素的质量为:4.4g××100%=1.2g,2.7g水中氢元素的质量为:2.7g××100%=0.3g,因为1.2g+0.3g=1.5g<2.3g,则该可燃物中还含有氧元素,其中氧元素的质量为:2.3g﹣1.5g=0.8g;则该可燃物中碳、氢、氧原子个数比为::=2:6:1。
故选:D。
【点评】本题主要考查质量守恒定律的应用,解题的关键是分析题中数据,灵活运用质量守恒定律。
二.填空题(共1小题)
17.(2022春 渝北区校级月考)化学用语是化学的灵魂。请用恰当的化学用语表示:
(1)世界上年产量最高的金属 Fe 。
(2)2个氢氧根离子 2OH﹣ 。
(3)“84”消毒液的消毒原理是:NaClO+X+H2O═NaHCO3+HClO,生成的HClO具有杀菌作用。化学方程式中X的化学式为 CO2 ,HClO中氯元素的化合价为 HO 。
【考点】质量守恒定律及其应用;有关元素化合价的计算;化学符号及其周围数字的意义.
【专题】化学式的计算;化学用语和质量守恒定律.
【分析】(1)铁由原子构成,化学式与元素符号相同。
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个离子,就在其离子符号前加上相应的数字。
(3)根据化学反应前后,原子的质量不变,原子的种类、总个数不变分析;化合价的表示方法,在该元素符号的上方用正负号和数字表示,正负号在前,数字在后。
【解答】解:(1)世界上年产量最高的金属是铁,铁由原子构成,化学式与元素符号相同,表示为Fe;
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。若表示多个离子,就在其离子符号前加上相应的数字。2个氢氧根离子表示为2OH﹣;
(3)由NaClO+X+H2O═NaHCO3+HClO可知,反应前碳原子、钠原子、氯原子、氢原子、氧原子个数分别为0、1、1、2、2,反应后碳原子、钠原子、氯原子、氢原子、氧原子个数分别为1、1、1、2、4,化学反应前后,原子的质量不变,原子的种类、总个数不变,则X中有1个碳原子,2个氧原子,则X化学式为CO2;HClO中氢元素化合价为+1,氧元素化合价为﹣2,根据化合物中正负化合价代数和为0,氯元素的化合价为+1,表示为HO。
故答案为:(1)Fe;
(2)2OH﹣;
(3)CO2;HO。
【点评】本题难度不大,主要考查同学们对常见化学用语(化学式、化合价、离子符号等)的书写和理解能力。
三.实验题(共3小题)
18.(2022秋 大安市期中)化学兴趣小组的同学用如图所示的3个实验探究质量守恒定律,请回答下列问题。
(1)A中气球的作用是 缓冲气压,防止温度过高,气体冲开橡皮塞 ,请写出A中发生反应的化学方程式 4P+5O22P2O5 。
(2)已知:碳酸钠与稀盐酸反应能生成CO2气体,上述3个实验中遵守质量守恒定律的有 ABC (填字母序号,下同),能验证质量守恒定律的有 AC 。
(3)若A实验中待红磷熄灭后再次称量,天平不再平衡,其原因可能是 ①②④ (填序号)。
①装置漏气
②用橡胶塞塞紧锥形瓶速度太慢
③红磷太少
④没有等锥形瓶冷却就再次称量
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)A装置中发生的反应是红磷燃烧,该反应现象是放出大量的热,产生白烟,据此解答;
(2)所有的化学反应都遵守质量守恒定律,而有气体参与的化学反应,需要在密闭容器中进行才能验证质量守恒定律;
(3)根据红磷燃烧的实验误差分析解答。
【解答】解:(1)由于红磷燃烧过程中放出大量的热,密闭空间内,气体受热膨胀,压强变大,为了缓冲气压,用一根玻璃管连接气球,平衡内外压强;故填:防止温度过高,气体冲开橡皮塞;4P+5O22P2O5;
(2)上述三个实验都是化学反应,都遵守质量守恒定律,而B实验是碳酸钠与稀盐酸反应能生成CO2气体,需要在密闭容器中进行才能验证质量守恒定律;
(3)①装置漏气,导致锥形瓶内氧气未消耗完全,无法验证参加反应的氧气的质量是多少,故反应结束后,无法使天平平衡;
②用橡胶塞塞紧锥形瓶速度太慢,相当于装置漏气,故反应结束后,天平也无法平衡;
③质量守恒定律是指参加反应的各物质的总质量等于反应后生成的各物质的总质量,红磷太少不影响;
④没有等锥形瓶冷却就再次称量,此时气体受热膨胀,参与的氧气的质量偏小,造成天平不平衡;
故选:①②④。
故答案为:(1)缓冲气压,防止温度过高,气体冲开橡皮塞;4P+5O22P2O5;
(2)ABC;AC;
(3)①②④。
【点评】本题难度系数偏大,考查学生对质量守恒定律的实验探究的掌握,需要积累多个易错题才能准确作答。
19.(2022秋 秦淮区期中)质量守恒定律的发现对化学科学发展具有重大意义。
(1)如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是 ABC (填字母),实验结束后,天平不平衡的是 B (填字母),请分析天平不平衡的原因 反应在烧杯中进行,生成的二氧化碳逸散到空气中 。
(2)写出硫酸铜的化学式并标出铜元素的化合价 4 。
(3)图A所示实验中可观察到气球先变大后变小,最终瘪至比初始状态更小,依据上述现象描述锥形瓶内压强变化的情况 锥形瓶内的压强先变大后变小,最终压强小于初始压强 。
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)根据所有的化学反应都遵循质量守恒定律,以及B实验是在烧杯中进行,生成的二氧化碳逸散到空气中来分析;
(2)根据化学式的书写,以及化合价原则来分析;
(3)根据图A所示实验中,红磷燃烧放热,瓶内气体受热膨胀,反应结束恢复到室温后,锥形瓶内氧气被消耗来分析。
【解答】解:(1)所有的化学反应都遵循质量守恒定律,如图所示3个实验所对应的化学反应中,遵循质量守恒定律的是ABC;实验结束后,由于B实验是在烧杯中进行,生成的二氧化碳逸散到空气中,导致左盘的质量减小,天平不平衡;而A、C的实验都是在密闭容器中进行,所以天平仍然保持平衡。
(2)根据化合价原则,化合物中各元素化合价代数和为0,硫酸铜中硫酸根整体显﹣2价,所以硫酸铜中铜元素的化合价为+2,表示为:4。
(3)图A所示实验中,红磷燃烧放热,瓶内气体受热膨胀,反应结束恢复到室温后,锥形瓶内氧气被消耗,所以锥形瓶内的压强先变大后变小,最终压强小于初始压强。
故答案为:
(1)ABC;B;反应在烧杯中进行,生成的二氧化碳逸散到空气中;
(2)4;
(3)锥形瓶内的压强先变大后变小,最终压强小于初始压强。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.(2022秋 松原期中)某课外兴趣小组的同学设计了如图实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为 4P+5O22P2O5 ,图1实验过程中小气球的变化现象为 先变大后变瘪 。
(2)图2实验 不能 (填“能”或“不能”)验证质量守恒定律,原因是 反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等 。
(3)请从微观的角度解释反应前后质量相等的原因 化学反应前后原子的种类、数目和质量没有发生改变 。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是 偏右 (填“偏右”或“偏左”),你认为可能的原因是 气球膨胀之后所受浮力增大 。
【考点】质量守恒定律及其应用.
【专题】化学用语和质量守恒定律.
【分析】(1)根据红磷和氧气在点燃的条件下生成五氧化二磷,该反应放热同时消耗瓶内氧气来分析;
(2)根据图2实验不是在密闭容器中进行,生成的二氧化碳会逸散到空气中来分析;
(3)根据原子是化学变化中的最小粒子,化学反应前后原子的种类、数目和质量没有发生改变来分析;
(4)根据气球膨胀之后所受浮力增大来分析。
【解答】解:(1)图1实验中,发生的反应为红磷和氧气在点燃的条件下生成五氧化二磷,化学方程式为:4P+5O22P2O5;红磷燃烧放热,使压强增大,气球膨胀变大,反应结束后温度降低,而燃烧消耗了装置内的氧气,气球缩小变瘪,所以过程中小气球的变化现象为:先变大后变瘪。
(2)图2实验不能验证质量守恒定律,原因是:反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等。
(3)原子是化学变化中的最小粒子,所以反应前后质量相等的原因是:化学反应前后原子的种类、数目和质量没有发生改变。
(4)将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是偏右;可能的原因是:气球膨胀之后所受浮力增大。
故答案为:
(1)4P+5O22P2O5;先变大后变瘪;
(2)不能;反应不是在密闭容器中进行,生成的二氧化碳会逸散到空气中,导致反应前后质量不相等;
(3)化学反应前后原子的种类、数目和质量没有发生改变;
(4)偏右;气球膨胀之后所受浮力增大。
【点评】本题主要考查质量守恒定律,化学反应都遵守质量守恒定律,即参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,化学反应前后,原子的种类、数目不变,元素的种类也不变
同课章节目录
