2023春化学苏教版选择性必修二 2.1.1 原子核外电子的运动特征 课件(共34张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 2.1.1 原子核外电子的运动特征 课件(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 919.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 10:25:19 | ||
图片预览











文档简介
(共34张PPT)
专题2 原子结构与元素性质 第一单元 原子核外电子的运动
第1课时 原子核外电子的运动特征
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。知道电子的运动状态可通过电子云模型来描述。
3.知道电子的运动状态(空间分布及能量)可通过原子轨道来描述,知道原子核外电子的能级高低顺序。
学习目标
证据推理与模型认知:
结合原子结构模型的发展史,体验科学家根据实验证据建构模型,依据新的实验事实修正模型、优化模型的科学探究过程。
宏观辨识与微观探析:
根据电子的特征,知道电子不同于宏观物体,可用统计的方法利用电子云模型描述电子的运动。通过辨识原子结构,认识到核外电子的运动状态可用原子轨道描述,与宏观物质运动状态不同。
核心素养
如图是氢原子的两个光谱,分别是发射光谱和吸收光谱。两者的形成过程有什么区别?
提示:下面的光谱为吸收光谱,是指原子的电子由基态跃迁到激发态吸收能量后形成的光谱(对应暗线)。上面的光谱为发射光谱,它是相反的过程,也就是激发态的电子从高能级跃迁到基态,释放的能量以光的形式释放出来,这就是发射光谱。
活动探究
1.科学家是如何基于实验证据建构和优化原子结构模型的?
提示:
[思考交流]
2.玻尔原子结构模型的内容是什么?
提示:(1)原子核外电子在原子轨道上运动,既不放出能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
(3)原子核外电子可以在能量不同的轨道上发生跃迁。
3.电子云的示意图中的小点表示电子,对吗?
提示:小点代表电子在核外空间区域出现的机会。
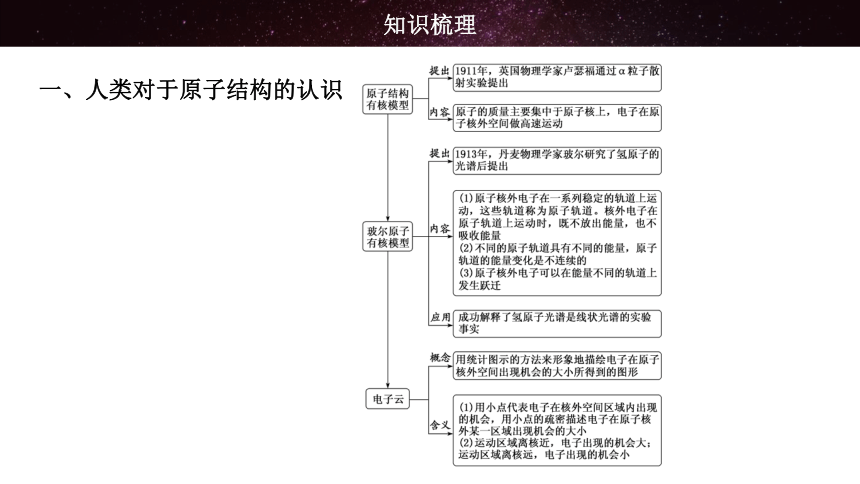
一、人类对于原子结构的认识
知识梳理
1.在物质结构研究的历史上,根据量子论的观点,首先提出原子核外电子在一系列稳定轨道上运动并较好地解释了氢原子光谱的科学家是( )
A.汤姆生 B.卢瑟福
C.道尔顿 D.玻尔
【解析】玻尔引入量子论观点,指出电子在一系列稳定的轨道上运动,这些轨道的能量是不连续的,很好地解释了氢原子光谱。
巩固练习
D
2.中学化学关于原子核外电子排布的研究和认识停留在( )
A.道尔顿原子模型 B.汤姆生原子模型
C.卢瑟福原子模型 D.玻尔原子模型
【解析】中学化学关于原子核外电子排布的研究和认识是能量不同的电子在不同的电子层上运动,与玻尔的核外电子分层排布模型一致。
D
某汽车安全气囊的产气药剂中Na3N是气体发生剂,受热分解产生N2和Na。
已知N原子的第2电子层的p能级上有2px、2py、2pz三个原子轨道。
(1)这三个p轨道上的电子的能量是否相同?
提示:相同。
(2)这三个p轨道的形状是否相同?电子云在空间的伸展方向是否相同?
提示:形状相同。均呈纺锤形,伸展方向不同。
活动探究
1.请画出Al原子的结构示意图,阅读教材并回答每一电子层上各电子的能量都相同吗?如何更准确地描述核外电子的能量高低及空间运动的主要区域?
提示:Al
每一电子层上各电子的能量可能不同,量子力学用原子轨道描述电子在核外空间运动的主要区域,原子轨道的类型不同,能量不同。
[思考交流]
提示:3p>3s>2s。
3.电子层数与原子轨道类型数有什么关系?与原子轨道数目的关系是什么?与最多可容纳的电子数的关系是什么?
提示:第n电子层有n种类型的原子轨道,其原子轨道数目为n2,最多可容纳电子数为2n2。
2.请比较原子轨道2s、3p、3s能量高低。
1.电子层与原子轨道类型的关系
第n电子层中有n种类型原子轨道,如K层有s轨道,L层有s、p轨道,M层有s、p、d轨道。
2.各原子轨道类型与原子轨道数的关系
s、p、d、f轨道分别有1、3、5、7个轨道。
知识梳理
二、原子核外电子的运动特征
电子层 电子层符号 原子轨道类型 原子轨道数目 可容纳的电子数
1 K 1s 1 2
2 L 2s、2p 4 8
3 M 3s、3p、3d 9 18
4 N 4s、4p、4d、4f 16 32
n …… …… n2 2n2
3.电子层和原子轨道的关系
4.不同原子轨道的能量高低关系
1.N电子层含有的原子轨道数是( )
A.4 B.8
C.16 D.32
【解析】N电子层含有的原子轨道数为42=16。
巩固练习
C
【解析】N层包含s、p、d、f轨道,M层包含s、p、d轨道,L层包含s、p轨道,K层只包含s轨道。
2.下列各电子层中不包含p轨道的是( )
A.N B.M
C.L D.K
D
玻尔理论、量子力学理论都是对核外电子运动状态的描述,根据对它们的理解,判断下列叙述正确的是( )
A.因为s轨道的形状是球形的,所以s电子做圆周运动
B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同
C.在同一能级上运动的电子,其运动状态肯定相同
D.原子轨道和电子云都是用来形象地描述电子运动状态的
能力提升
D
提示:s轨道是球形的,这是电子云图的形状,表示电子在核外空间出现的机会大小,而不是电子在做圆周运动,A项错误;p能级有3个原子轨道,相同电子层上的p轨道能量相同,则E(3px)=E(3py)=E(3pz),B项错误;同一能级上的同一轨道上最多排2个电子,两个电子的自旋状态不同,则其运动状态肯定不同,C项错误;原子轨道和电子云都可用来形象地描述电子运动状态,D项正确。
1.原子轨道的图形描述
(1)对象:描述原子中单个电子的空间运动状态。
(2)方法:用直角坐标系表示。
(3)意义:表示原子轨道的三维空间分布。
(4)原子轨道形状
①s原子轨道在三维空间分布的图形为球形,即s原子轨道具有球对称性。电子层数n不同时,s原子轨道的形状相同、大小不同,电子层数越大,s原子轨道的半径越大,如图。
归纳总结
②p原子轨道在三维空间分布的特征:3个p原子轨道分别相对于x、y、z轴对称,轨道的形状为纺锤形。同一能级中3个p原子轨道大小相同,具有轴对称性,它们分别沿x、y、z轴3个相互垂直的方向伸展,如图所示。电子层数n不同时,p原子轨道的形状相同、大小不同。
2.电子云
(1)电子云表示电子在原子核外空间出现的机会大小,不代表电子的实际运动轨迹。
(2)电子云图中的小点不表示实际电子,而是电子在原子核外空间出现机会大小的形象描述。点密集的地方,表示电子在原子核外空间出现的机会大;点稀疏的地方,表示电子在原子核外空间出现的机会小。
1.电子云与原子轨道的形状是原子核外电子运动状态的两种形象化描述,下列有关说法错误的是( )
A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散
B.每个p能级有3个原子轨道,它们相互垂直,能量相同
C.p轨道的能量一定高于s轨道的能量
D.处于同一原子轨道,电子自旋状态有两种
举一反三
【解析】同一电子层上p能级能量高于s能级能量,不同电子层上p能级能量不一定高于s能级能量,如3s>2p。
C
2.下列说法正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道图可表示为
D.3d表示d能级有3个轨道
C
【解析】电子云表示电子在原子核外空间出现机会的大小,1s电子云呈球形,表示1s电子在原子核外空间出现的机会分布呈球形对称,而不是表示电子绕原子核做圆周运动,A项错误;电子云图中小点的疏密程度仅表示电子在此处空间出现机会的大小,B项错误;s能级原子轨道为球形,C项正确;3d表示第三电子层上的d轨道,D项错误。
1.原子结构模型的发展与科学实验紧密相关。下列对应关系错误的是( )
A.道尔顿发现原子——“空心球”模型
B.汤姆生发现电子——“葡萄干布丁”模型
C.卢瑟福进行α粒子散射实验——“核式”模型
D.玻尔解释氢原子光谱——“电子分层排布”模型
当堂检测
A
【解析】道尔顿发现原子——“实心球”模型,故A错误;汤姆生根据实验发现了电子,提出原子的“葡萄干布丁”模型,故B正确;卢瑟福提出原子的核式结构模型,这一模型建立的基础是α粒子散射实验,故C正确;1913年丹麦科学家玻尔根据原子光谱实验,进一步建立起核外电子分层排布的原子结构模型,故D正确。
2.下列有关原子轨道的能量和电子运动状态的说法正确的是( )
A.多电子原子中,原子轨道的能量高低总是遵循nsB.同一原子中的2p能级(即原子轨道)上的电子的运动状态完全相同
C.同一原子中,形状相同的能级(即原子轨道)的能量一定相同
D.多电子原子中,每个能层(即电子层)上电子的能量一定不同
A
【解析】多电子原子中,电子填充原子轨道时,形状相同的原子轨道能量的高低:1s<2s<3s<4s…;同一能级上的原子轨道具有相同的能量:npx=npy=npz,相同电子层上原子轨道能量的高低:ns3.下列能级中,能级符号正确且轨道数为5的是( )
A.2d B.3p
C.4d D.5s
【解析】A项,电子层为2,能级只有s和p,不存在2d能级;B项,3p能级有3个轨道;C项,4d能级有5个轨道;5s能级有2个轨道;故选C。
C
4.下列关于氢原子电子云图的说法正确的是( )
A.通常用小点来表示电子的多少,小点密度大,电子数目多
B.小点密度大,空间出现的机会大
C.通常用小点来表示电子绕核做高速圆周运动
D.电子云图是对电子运动无规律性的描述
B
【解析】小点表示电子在核外空间出现的机会大小,不表示电子数目,故A错误;小点密度大表示电子在该处空间出现的机会大,故B正确;小点表示电子在核外空间出现的机会,不代表电子的运动轨迹,故C错误;电子云图是描述电子在核外空间出现的机会分布的图形,故D错误。
5.(1)日光等白光经棱镜折射后产生的是________光谱。原子光谱则与之不同,它是由不连续特征谱线组成的,称为________光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是________的。
(2)比较下列多电子原子的原子轨道的能量高低(填“<”“>”或“=”):
①2s________3s,②2s________3d,③2px________2py,④4f________6f。
=
连续
线状
量子化
<
<
<
【解析】(1)日光等白光经棱镜折射后产生的光谱为连续光谱。原子光谱是由不连续特征谱线组成的,称为线状光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是量子化的。
(2)相同电子层上原子轨道能量的高低顺序:ns本节内容结束
专题2 原子结构与元素性质 第一单元 原子核外电子的运动
第1课时 原子核外电子的运动特征
1.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。知道电子的运动状态可通过电子云模型来描述。
3.知道电子的运动状态(空间分布及能量)可通过原子轨道来描述,知道原子核外电子的能级高低顺序。
学习目标
证据推理与模型认知:
结合原子结构模型的发展史,体验科学家根据实验证据建构模型,依据新的实验事实修正模型、优化模型的科学探究过程。
宏观辨识与微观探析:
根据电子的特征,知道电子不同于宏观物体,可用统计的方法利用电子云模型描述电子的运动。通过辨识原子结构,认识到核外电子的运动状态可用原子轨道描述,与宏观物质运动状态不同。
核心素养
如图是氢原子的两个光谱,分别是发射光谱和吸收光谱。两者的形成过程有什么区别?
提示:下面的光谱为吸收光谱,是指原子的电子由基态跃迁到激发态吸收能量后形成的光谱(对应暗线)。上面的光谱为发射光谱,它是相反的过程,也就是激发态的电子从高能级跃迁到基态,释放的能量以光的形式释放出来,这就是发射光谱。
活动探究
1.科学家是如何基于实验证据建构和优化原子结构模型的?
提示:
[思考交流]
2.玻尔原子结构模型的内容是什么?
提示:(1)原子核外电子在原子轨道上运动,既不放出能量,也不吸收能量。
(2)不同的原子轨道具有不同的能量,原子轨道的能量变化是不连续的。
(3)原子核外电子可以在能量不同的轨道上发生跃迁。
3.电子云的示意图中的小点表示电子,对吗?
提示:小点代表电子在核外空间区域出现的机会。
一、人类对于原子结构的认识
知识梳理
1.在物质结构研究的历史上,根据量子论的观点,首先提出原子核外电子在一系列稳定轨道上运动并较好地解释了氢原子光谱的科学家是( )
A.汤姆生 B.卢瑟福
C.道尔顿 D.玻尔
【解析】玻尔引入量子论观点,指出电子在一系列稳定的轨道上运动,这些轨道的能量是不连续的,很好地解释了氢原子光谱。
巩固练习
D
2.中学化学关于原子核外电子排布的研究和认识停留在( )
A.道尔顿原子模型 B.汤姆生原子模型
C.卢瑟福原子模型 D.玻尔原子模型
【解析】中学化学关于原子核外电子排布的研究和认识是能量不同的电子在不同的电子层上运动,与玻尔的核外电子分层排布模型一致。
D
某汽车安全气囊的产气药剂中Na3N是气体发生剂,受热分解产生N2和Na。
已知N原子的第2电子层的p能级上有2px、2py、2pz三个原子轨道。
(1)这三个p轨道上的电子的能量是否相同?
提示:相同。
(2)这三个p轨道的形状是否相同?电子云在空间的伸展方向是否相同?
提示:形状相同。均呈纺锤形,伸展方向不同。
活动探究
1.请画出Al原子的结构示意图,阅读教材并回答每一电子层上各电子的能量都相同吗?如何更准确地描述核外电子的能量高低及空间运动的主要区域?
提示:Al
每一电子层上各电子的能量可能不同,量子力学用原子轨道描述电子在核外空间运动的主要区域,原子轨道的类型不同,能量不同。
[思考交流]
提示:3p>3s>2s。
3.电子层数与原子轨道类型数有什么关系?与原子轨道数目的关系是什么?与最多可容纳的电子数的关系是什么?
提示:第n电子层有n种类型的原子轨道,其原子轨道数目为n2,最多可容纳电子数为2n2。
2.请比较原子轨道2s、3p、3s能量高低。
1.电子层与原子轨道类型的关系
第n电子层中有n种类型原子轨道,如K层有s轨道,L层有s、p轨道,M层有s、p、d轨道。
2.各原子轨道类型与原子轨道数的关系
s、p、d、f轨道分别有1、3、5、7个轨道。
知识梳理
二、原子核外电子的运动特征
电子层 电子层符号 原子轨道类型 原子轨道数目 可容纳的电子数
1 K 1s 1 2
2 L 2s、2p 4 8
3 M 3s、3p、3d 9 18
4 N 4s、4p、4d、4f 16 32
n …… …… n2 2n2
3.电子层和原子轨道的关系
4.不同原子轨道的能量高低关系
1.N电子层含有的原子轨道数是( )
A.4 B.8
C.16 D.32
【解析】N电子层含有的原子轨道数为42=16。
巩固练习
C
【解析】N层包含s、p、d、f轨道,M层包含s、p、d轨道,L层包含s、p轨道,K层只包含s轨道。
2.下列各电子层中不包含p轨道的是( )
A.N B.M
C.L D.K
D
玻尔理论、量子力学理论都是对核外电子运动状态的描述,根据对它们的理解,判断下列叙述正确的是( )
A.因为s轨道的形状是球形的,所以s电子做圆周运动
B.3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同
C.在同一能级上运动的电子,其运动状态肯定相同
D.原子轨道和电子云都是用来形象地描述电子运动状态的
能力提升
D
提示:s轨道是球形的,这是电子云图的形状,表示电子在核外空间出现的机会大小,而不是电子在做圆周运动,A项错误;p能级有3个原子轨道,相同电子层上的p轨道能量相同,则E(3px)=E(3py)=E(3pz),B项错误;同一能级上的同一轨道上最多排2个电子,两个电子的自旋状态不同,则其运动状态肯定不同,C项错误;原子轨道和电子云都可用来形象地描述电子运动状态,D项正确。
1.原子轨道的图形描述
(1)对象:描述原子中单个电子的空间运动状态。
(2)方法:用直角坐标系表示。
(3)意义:表示原子轨道的三维空间分布。
(4)原子轨道形状
①s原子轨道在三维空间分布的图形为球形,即s原子轨道具有球对称性。电子层数n不同时,s原子轨道的形状相同、大小不同,电子层数越大,s原子轨道的半径越大,如图。
归纳总结
②p原子轨道在三维空间分布的特征:3个p原子轨道分别相对于x、y、z轴对称,轨道的形状为纺锤形。同一能级中3个p原子轨道大小相同,具有轴对称性,它们分别沿x、y、z轴3个相互垂直的方向伸展,如图所示。电子层数n不同时,p原子轨道的形状相同、大小不同。
2.电子云
(1)电子云表示电子在原子核外空间出现的机会大小,不代表电子的实际运动轨迹。
(2)电子云图中的小点不表示实际电子,而是电子在原子核外空间出现机会大小的形象描述。点密集的地方,表示电子在原子核外空间出现的机会大;点稀疏的地方,表示电子在原子核外空间出现的机会小。
1.电子云与原子轨道的形状是原子核外电子运动状态的两种形象化描述,下列有关说法错误的是( )
A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散
B.每个p能级有3个原子轨道,它们相互垂直,能量相同
C.p轨道的能量一定高于s轨道的能量
D.处于同一原子轨道,电子自旋状态有两种
举一反三
【解析】同一电子层上p能级能量高于s能级能量,不同电子层上p能级能量不一定高于s能级能量,如3s>2p。
C
2.下列说法正确的是( )
A.1s电子云呈球形,表示电子绕原子核做圆周运动
B.电子云图中的小点密度大,说明该原子核外空间电子数目多
C.ns能级的原子轨道图可表示为
D.3d表示d能级有3个轨道
C
【解析】电子云表示电子在原子核外空间出现机会的大小,1s电子云呈球形,表示1s电子在原子核外空间出现的机会分布呈球形对称,而不是表示电子绕原子核做圆周运动,A项错误;电子云图中小点的疏密程度仅表示电子在此处空间出现机会的大小,B项错误;s能级原子轨道为球形,C项正确;3d表示第三电子层上的d轨道,D项错误。
1.原子结构模型的发展与科学实验紧密相关。下列对应关系错误的是( )
A.道尔顿发现原子——“空心球”模型
B.汤姆生发现电子——“葡萄干布丁”模型
C.卢瑟福进行α粒子散射实验——“核式”模型
D.玻尔解释氢原子光谱——“电子分层排布”模型
当堂检测
A
【解析】道尔顿发现原子——“实心球”模型,故A错误;汤姆生根据实验发现了电子,提出原子的“葡萄干布丁”模型,故B正确;卢瑟福提出原子的核式结构模型,这一模型建立的基础是α粒子散射实验,故C正确;1913年丹麦科学家玻尔根据原子光谱实验,进一步建立起核外电子分层排布的原子结构模型,故D正确。
2.下列有关原子轨道的能量和电子运动状态的说法正确的是( )
A.多电子原子中,原子轨道的能量高低总是遵循ns
C.同一原子中,形状相同的能级(即原子轨道)的能量一定相同
D.多电子原子中,每个能层(即电子层)上电子的能量一定不同
A
【解析】多电子原子中,电子填充原子轨道时,形状相同的原子轨道能量的高低:1s<2s<3s<4s…;同一能级上的原子轨道具有相同的能量:npx=npy=npz,相同电子层上原子轨道能量的高低:ns
A.2d B.3p
C.4d D.5s
【解析】A项,电子层为2,能级只有s和p,不存在2d能级;B项,3p能级有3个轨道;C项,4d能级有5个轨道;5s能级有2个轨道;故选C。
C
4.下列关于氢原子电子云图的说法正确的是( )
A.通常用小点来表示电子的多少,小点密度大,电子数目多
B.小点密度大,空间出现的机会大
C.通常用小点来表示电子绕核做高速圆周运动
D.电子云图是对电子运动无规律性的描述
B
【解析】小点表示电子在核外空间出现的机会大小,不表示电子数目,故A错误;小点密度大表示电子在该处空间出现的机会大,故B正确;小点表示电子在核外空间出现的机会,不代表电子的运动轨迹,故C错误;电子云图是描述电子在核外空间出现的机会分布的图形,故D错误。
5.(1)日光等白光经棱镜折射后产生的是________光谱。原子光谱则与之不同,它是由不连续特征谱线组成的,称为________光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是________的。
(2)比较下列多电子原子的原子轨道的能量高低(填“<”“>”或“=”):
①2s________3s,②2s________3d,③2px________2py,④4f________6f。
=
连续
线状
量子化
<
<
<
【解析】(1)日光等白光经棱镜折射后产生的光谱为连续光谱。原子光谱是由不连续特征谱线组成的,称为线状光谱。根据原子光谱谱线的分析结果,可以得到的信息是原子轨道能量的变化是不连续的,这种情况又称为原子中电子的能量是量子化的。
(2)相同电子层上原子轨道能量的高低顺序:ns
