2023春化学苏教版选择性必修二 2.1.2 原子核外电子的排布 课件(共23张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 2.1.2 原子核外电子的排布 课件(共23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 604.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
专题2 原子结构与元素性质
第一单元 原子核外电子的运动
第2课时 原子核外电子的排布
电子总是优先排布在能量最低的电子层里;
每个电子层最多只能排布2n2个电子;
最外层不超过8个电子;(K层为最外层,不超过2个电子)
次外层最多不超过18个电子。
原子核外电子排布规律:
温故知新
一、原子核外电子排布遵循的原理
知识梳理
1.能量最低原理
2.泡利不相容原理
3.洪特规则
4.洪特规则(特殊补充)
1.能量最低原理
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。
原子核外电子排布的轨道能量顺序
1s<2s <2p < 3s <3p <4s < 3d< 4p
能级错位
请学生们画出K Ca Sc元素的原子轨道示意图
K
Ca
Sc
每个原子轨道上最多只能容纳2个自旋状态不同的电子(用“↓↑”表示)
2.泡利不相容原理
电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
3.洪特规则
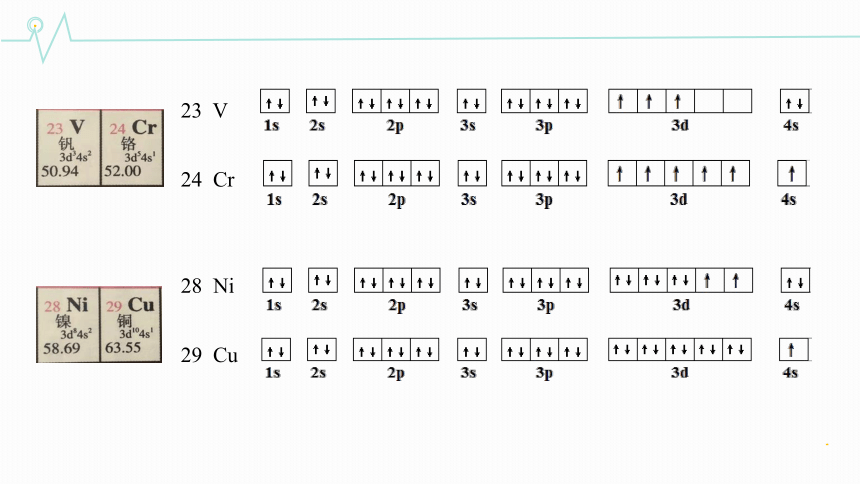
23 V
24 Cr
28 Ni
29 Cu
相对稳定的状态
体系能量较低
全充满(p6,d10,f14)
全空(p0,d0,f0)
半充满(p3,d5,f7)
24Cr
29Cu
4.洪特规则(特殊补充)
Fe2+
Fe3+
思考:
26Fe
写出铁原子、铁离子和亚铁离子的电子轨道排布式,想想铁离子和亚铁离子谁更稳定?为什么?
二、原子核外电子排布的表达方式
1.粒子结构示意图
将每个电子层上的电子总数表示在原子核外的图示
用数字在轨道符号右上角标明该轨道上排布的电子数
S:
S2-:
1s2 2s22p6 3s23p4
1s2 2s22p6 3s23p6
2.电子排布式
把内层电子达到稀有气体结构的部分写成“原子实”用相应稀有气体的元素符号外加方括号表示
S:1s2 2s22p6 3s23p4
S:[Ne]3s23p4
K:1s22s22p63s23p64s1
K:[Ar]4s1
3.简化电子排布式
1-36号元素的原子外围电子排布
主族元素:外围电子=最外层电子数
副族元素:外围电子=最外层电子数+次外层d轨道的电子
4.外围电子排布式
每个方框代表一个原子轨道,每个箭头代表一个电子
5.轨道表示式
粒子结构示意图 实例
电子排布式 实例 S:1s22s22p63s23p4
简化电子排布式 实例 S:[Ne]3s23p4
外围电子排布式 实例 S:3s23p4
轨道表达式 实例
知识小结
1.判断下列微粒核外电子表示方法是否正确;若不正确,说明它违反了什么原理?
× 能量最低原理
× 泡利不相容原理
× 能量最低原理
√
(1) C:
(2) Mg:
(3) S:1s2 2s22p6 3s33p3
(4) K:1s2 2s22p6 3s23p54s2
(5) 22Ti:[Ar]3d24s2
√
课堂练习
(1) O
(2) Al
(3) P
(4) C
(5) K
(6) Br
1s22s22p4
[He]2s22p4
1s22s22p63s23p1
[Ne]3s23p1
1s22s22p63s23p3
[Ne]3s23p3
1s22s22p2
[He]2s22p2
1s22s22p63s23p64s1
[Ar]4s1
1s22s22p63s23p63d104s24p5
[Ar]3d104s24p5
2.写出下列原子的电子排布式并简化电子排布式
基态与激发态、光谱
1.基态原子与激发态原子
处于最低能量状态的原子叫基态原子;
当基态原子的电子吸收能量后,电子会跃迁到较高能级成为激发态原子。
拓展视野
释放能量
激发态原子
吸收能量
基态原子
2.基态、激发态相互转化与能量转化的关系
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
3.原子的发射与吸收光谱
本节内容结束
专题2 原子结构与元素性质
第一单元 原子核外电子的运动
第2课时 原子核外电子的排布
电子总是优先排布在能量最低的电子层里;
每个电子层最多只能排布2n2个电子;
最外层不超过8个电子;(K层为最外层,不超过2个电子)
次外层最多不超过18个电子。
原子核外电子排布规律:
温故知新
一、原子核外电子排布遵循的原理
知识梳理
1.能量最低原理
2.泡利不相容原理
3.洪特规则
4.洪特规则(特殊补充)
1.能量最低原理
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于最低的能量状态。
原子核外电子排布的轨道能量顺序
1s<2s <2p < 3s <3p <4s < 3d< 4p
能级错位
请学生们画出K Ca Sc元素的原子轨道示意图
K
Ca
Sc
每个原子轨道上最多只能容纳2个自旋状态不同的电子(用“↓↑”表示)
2.泡利不相容原理
电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低。
3.洪特规则
23 V
24 Cr
28 Ni
29 Cu
相对稳定的状态
体系能量较低
全充满(p6,d10,f14)
全空(p0,d0,f0)
半充满(p3,d5,f7)
24Cr
29Cu
4.洪特规则(特殊补充)
Fe2+
Fe3+
思考:
26Fe
写出铁原子、铁离子和亚铁离子的电子轨道排布式,想想铁离子和亚铁离子谁更稳定?为什么?
二、原子核外电子排布的表达方式
1.粒子结构示意图
将每个电子层上的电子总数表示在原子核外的图示
用数字在轨道符号右上角标明该轨道上排布的电子数
S:
S2-:
1s2 2s22p6 3s23p4
1s2 2s22p6 3s23p6
2.电子排布式
把内层电子达到稀有气体结构的部分写成“原子实”用相应稀有气体的元素符号外加方括号表示
S:1s2 2s22p6 3s23p4
S:[Ne]3s23p4
K:1s22s22p63s23p64s1
K:[Ar]4s1
3.简化电子排布式
1-36号元素的原子外围电子排布
主族元素:外围电子=最外层电子数
副族元素:外围电子=最外层电子数+次外层d轨道的电子
4.外围电子排布式
每个方框代表一个原子轨道,每个箭头代表一个电子
5.轨道表示式
粒子结构示意图 实例
电子排布式 实例 S:1s22s22p63s23p4
简化电子排布式 实例 S:[Ne]3s23p4
外围电子排布式 实例 S:3s23p4
轨道表达式 实例
知识小结
1.判断下列微粒核外电子表示方法是否正确;若不正确,说明它违反了什么原理?
× 能量最低原理
× 泡利不相容原理
× 能量最低原理
√
(1) C:
(2) Mg:
(3) S:1s2 2s22p6 3s33p3
(4) K:1s2 2s22p6 3s23p54s2
(5) 22Ti:[Ar]3d24s2
√
课堂练习
(1) O
(2) Al
(3) P
(4) C
(5) K
(6) Br
1s22s22p4
[He]2s22p4
1s22s22p63s23p1
[Ne]3s23p1
1s22s22p63s23p3
[Ne]3s23p3
1s22s22p2
[He]2s22p2
1s22s22p63s23p64s1
[Ar]4s1
1s22s22p63s23p63d104s24p5
[Ar]3d104s24p5
2.写出下列原子的电子排布式并简化电子排布式
基态与激发态、光谱
1.基态原子与激发态原子
处于最低能量状态的原子叫基态原子;
当基态原子的电子吸收能量后,电子会跃迁到较高能级成为激发态原子。
拓展视野
释放能量
激发态原子
吸收能量
基态原子
2.基态、激发态相互转化与能量转化的关系
低能量轨道电子
吸收能量
高能量轨道电子
原子吸收光谱
低能量轨道电子
释放能量
原子发射光谱
3.原子的发射与吸收光谱
本节内容结束
