2023春化学苏教版选择性必修二 2.2.1 原子核外电子排布的周期性 课件(共18张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 2.2.1 原子核外电子排布的周期性 课件(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 289.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 10:29:36 | ||
图片预览



文档简介
(共18张PPT)
专题2 原子结构与元素性质
第二单元 元素性质的递变规律
第1课时 原子核外电子排布的周期性
1.知道原子核外电子排布呈现周期性变化。
2.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
学习目标
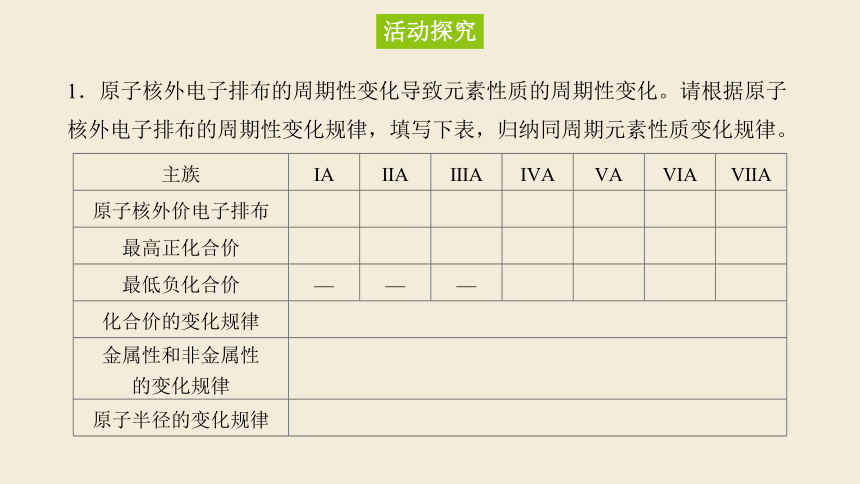
1.原子核外电子排布的周期性变化导致元素性质的周期性变化。请根据原子核外电子排布的周期性变化规律,填写下表,归纳同周期元素性质变化规律。
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布
最高正化合价
最低负化合价 — — —
化合价的变化规律 金属性和非金属性 的变化规律 原子半径的变化规律 活动探究
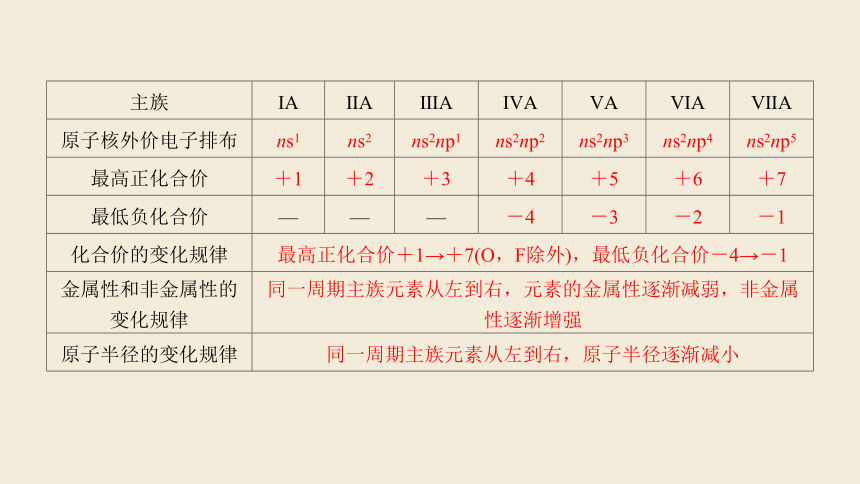
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
最高正化合价 +1 +2 +3 +4 +5 +6 +7
最低负化合价 — — — -4 -3 -2 -1
化合价的变化规律 最高正化合价+1→+7(O,F除外),最低负化合价-4→-1 金属性和非金属性的变化规律 同一周期主族元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强 原子半径的变化规律 同一周期主族元素从左到右,原子半径逐渐减小 主族 最外层电子排布 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
第1周期 — — — — — —
第2周期
第3周期
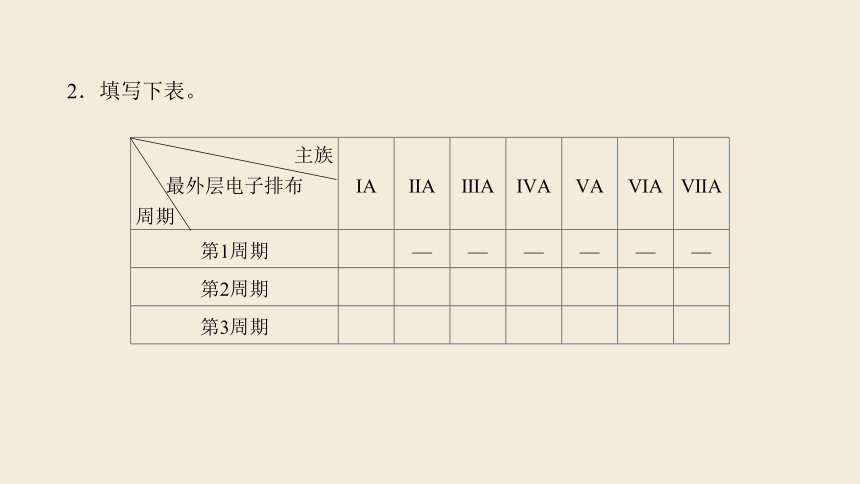
2.填写下表。
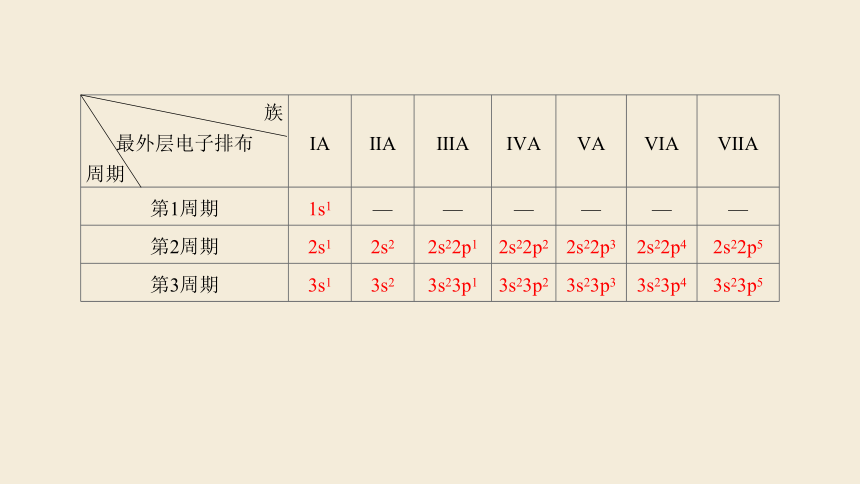
族 最外层电子排布 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
第1周期 1s1 — — — — — —
第2周期 2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5
第3周期 3s1 3s2 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5
1.根据上表,你能归纳出核外电子排布的周期性变化的内容是什么?
提示:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化。
2.元素周期表中区是如何划分的?Fe、Cu、Br元素分别位于哪个区域?
提示:根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区、f区。Fe、Cu、Br元素分别位于d区、ds区、p区。
[思考交流]
1.原子核外电子排布的周期性变化规律
每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化。
2.周期的划分与核外电子排布
原子核外电子排布与元素周期表中周期划分的联系如下表所示:
归纳总结
周期 能级组 能级组内原子轨道 最多容纳的电子数 元素数目
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
由上表可以看出:一个能级组最多能容纳的电子数是其所包含原子轨道数目的两倍,等于一个周期所包含的元素种数,所以周期表中的7个周期分别对应7个能级组。各周期所包含的元素种数分别是2、8、8、18、18、32、32。周期与电子层数n相关,最外电子层数为n时,该原子对应元素属于第n周期。
族 外围电子排布
主族 ns1~2或ns2np1~5
副族 (n-1)d1~5ns1~2或(n-1)d10ns1~2
0族 1s2或ns2np6
Ⅷ族 (n-1)d6~9ns1~2(钯除外)
3.族的划分与外围电子排布
4.核外电子排布与元素周期表的分区
分区 元素位置 价电子排布式 元素种类及性质特点
s区 ⅠA族、ⅡA族 ns1~2 元素原子的外围电子分布在s轨道上,属于活泼金属元素(H除外),为碱金属元素和碱土金属元素
p区 ⅢA~ⅦA族及0族 ns2np1~6(He除外) 元素原子的外围电子最后填入np轨道上,为非金属元素和少数金属元素;除0族外,随着最外层电子数目的增加,原子越来越难失去电子,越来越容易得到电子
分区 元素位置 价电子排布式 元素种类及性质特点
d区 ⅢB~ⅦB族(镧系、锕系除外)及Ⅷ族 (n-1)d1~9ns1~2 (Pd除外) (n-1)d轨道不同程度地参与化学键的形成,为过渡金属元素
ds区 ⅠB族、ⅡB族 (n-1) d10ns1~2 元素原子的(n-1)d轨道为全充满电子的轨道,为过渡金属元素
f区 镧系和锕系 (n-2)f0~14(n-1) d0~2ns2 镧系元素的化学性质非常相近,锕系元素的化学性质也非常相近
1.某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A.第4周期ⅡB族 B.第4周期ⅡB族
C.第4周期ⅦB族 D.第4周期Ⅷ族
【解析】由[Ar]3d74s2可知该元素位于第4周期,又由价电子数为9知其位于第4周期第9纵列,为Ⅷ族元素。
巩固练习
D
2.若某原子在处于能量最低状态时,外围电子排布式为4d15s2,下列说法错误的是( )
A.该元素可能有+3价
B.该元素位于第5周期副族
C.该元素原子核外共有39个不同运动状态的电子
D.该元素基态原子第N能层上还有5个空轨道
D
【解析】根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2。外围电子排布为4d15s2,该元素可能有+3价,故A正确;该元素原子核外有5个电子层,位于第5周期第ⅢB族,故B正确;该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,由此可见:该元素原子中共有39个电子,原子核外共有39个不同运动状态的电子,故C正确;该元素第N层的电子排布为4s24p64d1,d有5个轨道,基态原子第N能层上还有4个空轨道,故D错误。
元素 元素符号 原子序数 区 周期 族
A 1s22s22p63s1
B
C 3d104s1
D [Ne]3s23p4
E
Cl 17 p 3 ⅦA
3.下列是某几种元素原子的原子结构示意图、核外电子排布式、轨道表示式或外围电子排布式,分别判断其元素符号、原子序数并指出其在周期表中的位置。
Na 11 s 3 ⅠA
Fe 26 d 4 Ⅷ
Cu 29 ds 4 ⅠB
S 16 p 3 ⅥA
【解析】由电子排布式判断A为11号元素Na;由原子结构示意图可知x=26,B为26号元素Fe;由外围电子排布式判断C为29号元素Cu;由电子排布式判断D为16号元素S;由基态原子的轨道表示式判断E为17号元素Cl。
本节内容结束
专题2 原子结构与元素性质
第二单元 元素性质的递变规律
第1课时 原子核外电子排布的周期性
1.知道原子核外电子排布呈现周期性变化。
2.知道元素周期表中分区、周期和族的元素原子核外电子排布特征。
学习目标
1.原子核外电子排布的周期性变化导致元素性质的周期性变化。请根据原子核外电子排布的周期性变化规律,填写下表,归纳同周期元素性质变化规律。
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布
最高正化合价
最低负化合价 — — —
化合价的变化规律 金属性和非金属性 的变化规律 原子半径的变化规律 活动探究
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
原子核外价电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
最高正化合价 +1 +2 +3 +4 +5 +6 +7
最低负化合价 — — — -4 -3 -2 -1
化合价的变化规律 最高正化合价+1→+7(O,F除外),最低负化合价-4→-1 金属性和非金属性的变化规律 同一周期主族元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强 原子半径的变化规律 同一周期主族元素从左到右,原子半径逐渐减小 主族 最外层电子排布 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
第1周期 — — — — — —
第2周期
第3周期
2.填写下表。
族 最外层电子排布 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
第1周期 1s1 — — — — — —
第2周期 2s1 2s2 2s22p1 2s22p2 2s22p3 2s22p4 2s22p5
第3周期 3s1 3s2 3s23p1 3s23p2 3s23p3 3s23p4 3s23p5
1.根据上表,你能归纳出核外电子排布的周期性变化的内容是什么?
提示:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化。
2.元素周期表中区是如何划分的?Fe、Cu、Br元素分别位于哪个区域?
提示:根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区、f区。Fe、Cu、Br元素分别位于d区、ds区、p区。
[思考交流]
1.原子核外电子排布的周期性变化规律
每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化。
2.周期的划分与核外电子排布
原子核外电子排布与元素周期表中周期划分的联系如下表所示:
归纳总结
周期 能级组 能级组内原子轨道 最多容纳的电子数 元素数目
1 Ⅰ 1s 2 2
2 Ⅱ 2s 2p 8 8
3 Ⅲ 3s 3p 8 8
4 Ⅳ 4s 3d 4p 18 18
5 Ⅴ 5s 4d 5p 18 18
6 Ⅵ 6s 4f 5d 6p 32 32
由上表可以看出:一个能级组最多能容纳的电子数是其所包含原子轨道数目的两倍,等于一个周期所包含的元素种数,所以周期表中的7个周期分别对应7个能级组。各周期所包含的元素种数分别是2、8、8、18、18、32、32。周期与电子层数n相关,最外电子层数为n时,该原子对应元素属于第n周期。
族 外围电子排布
主族 ns1~2或ns2np1~5
副族 (n-1)d1~5ns1~2或(n-1)d10ns1~2
0族 1s2或ns2np6
Ⅷ族 (n-1)d6~9ns1~2(钯除外)
3.族的划分与外围电子排布
4.核外电子排布与元素周期表的分区
分区 元素位置 价电子排布式 元素种类及性质特点
s区 ⅠA族、ⅡA族 ns1~2 元素原子的外围电子分布在s轨道上,属于活泼金属元素(H除外),为碱金属元素和碱土金属元素
p区 ⅢA~ⅦA族及0族 ns2np1~6(He除外) 元素原子的外围电子最后填入np轨道上,为非金属元素和少数金属元素;除0族外,随着最外层电子数目的增加,原子越来越难失去电子,越来越容易得到电子
分区 元素位置 价电子排布式 元素种类及性质特点
d区 ⅢB~ⅦB族(镧系、锕系除外)及Ⅷ族 (n-1)d1~9ns1~2 (Pd除外) (n-1)d轨道不同程度地参与化学键的形成,为过渡金属元素
ds区 ⅠB族、ⅡB族 (n-1) d10ns1~2 元素原子的(n-1)d轨道为全充满电子的轨道,为过渡金属元素
f区 镧系和锕系 (n-2)f0~14(n-1) d0~2ns2 镧系元素的化学性质非常相近,锕系元素的化学性质也非常相近
1.某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A.第4周期ⅡB族 B.第4周期ⅡB族
C.第4周期ⅦB族 D.第4周期Ⅷ族
【解析】由[Ar]3d74s2可知该元素位于第4周期,又由价电子数为9知其位于第4周期第9纵列,为Ⅷ族元素。
巩固练习
D
2.若某原子在处于能量最低状态时,外围电子排布式为4d15s2,下列说法错误的是( )
A.该元素可能有+3价
B.该元素位于第5周期副族
C.该元素原子核外共有39个不同运动状态的电子
D.该元素基态原子第N能层上还有5个空轨道
D
【解析】根据核外电子排布规律,该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2。外围电子排布为4d15s2,该元素可能有+3价,故A正确;该元素原子核外有5个电子层,位于第5周期第ⅢB族,故B正确;该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p64d15s2,由此可见:该元素原子中共有39个电子,原子核外共有39个不同运动状态的电子,故C正确;该元素第N层的电子排布为4s24p64d1,d有5个轨道,基态原子第N能层上还有4个空轨道,故D错误。
元素 元素符号 原子序数 区 周期 族
A 1s22s22p63s1
B
C 3d104s1
D [Ne]3s23p4
E
Cl 17 p 3 ⅦA
3.下列是某几种元素原子的原子结构示意图、核外电子排布式、轨道表示式或外围电子排布式,分别判断其元素符号、原子序数并指出其在周期表中的位置。
Na 11 s 3 ⅠA
Fe 26 d 4 Ⅷ
Cu 29 ds 4 ⅠB
S 16 p 3 ⅥA
【解析】由电子排布式判断A为11号元素Na;由原子结构示意图可知x=26,B为26号元素Fe;由外围电子排布式判断C为29号元素Cu;由电子排布式判断D为16号元素S;由基态原子的轨道表示式判断E为17号元素Cl。
本节内容结束
