化学人教版(2019)必修第一册2.1.2 钠及其化合物(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2 钠及其化合物(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 6.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 11:31:32 | ||
图片预览







文档简介
(共28张PPT)
2.1.2 钠及其化合物
比如说,Na、Na2O2
有一些火灾现场不能用水灭火,为什么?
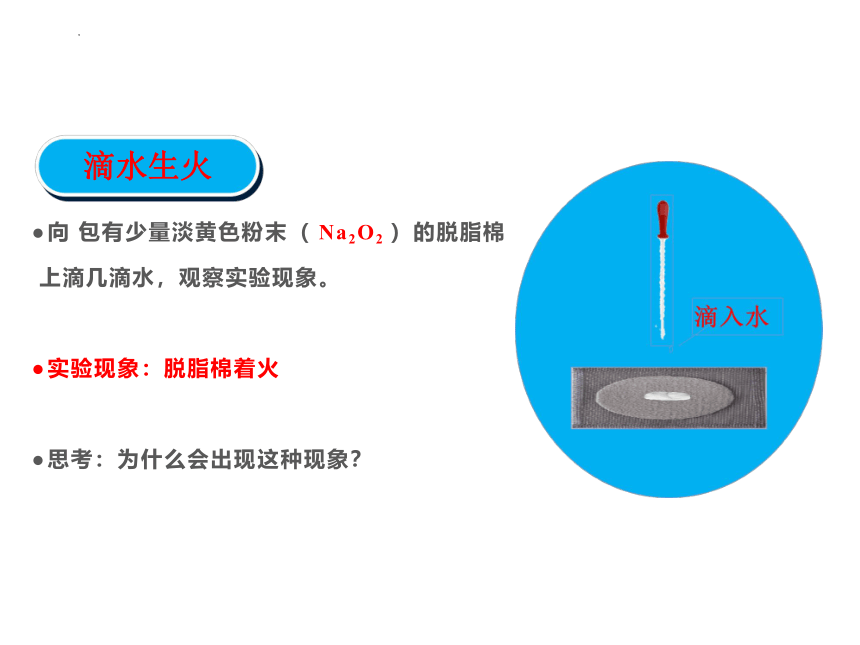
向 包有少量淡黄色粉末( Na2O2 )的脱脂棉
上滴几滴水,观察实验现象。
实验现象:脱脂棉着火
思考:为什么会出现这种现象?
滴水生火
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
氧化钠和过氧化钠
与水反应:
与酸性氧化物(CO2)反应:
碱性氧化物
与酸反应:
Na2O+2HCl =2NaCl+H2O
1、氧化钠——Na2O
操作+现象 初步结论
①把水滴入少量的Na2O2,带火星的木条放在试管口, 现象: ; 手触摸试管外壁, 。 ②用pH试纸检验溶液的酸碱性, 现象: ;
①反应产生O2,同时放出热量
②有氢氧化钠生成;
产生大量气泡,带火星的木条复燃
试管发烫
试纸变蓝溶液显碱性
(1)与水反应
2Na2O2+2H2O = 4Na+ + 4OH- + O2↑
请写出离子方程式?
Na2O2既是氧化剂又是还原剂
2Na2O2+2H2O == 4 NaOH+O2↑
失2e-
得2e-
-1
-2
0
2、过氧化钠——Na2O2
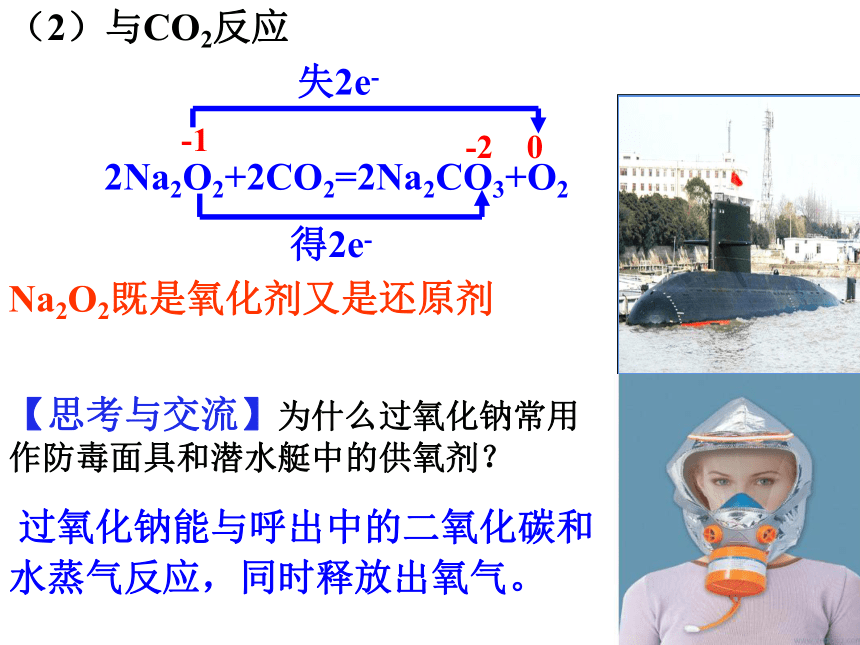
(2)与CO2反应
【思考与交流】为什么过氧化钠常用作防毒面具和潜水艇中的供氧剂?
过氧化钠能与呼出中的二氧化碳和水蒸气反应,同时释放出氧气。
2Na2O2+2CO2=2Na2CO3+O2
-1
-2
0
失2e-
得2e-
Na2O2既是氧化剂又是还原剂
(3)与盐酸反应
联想:Na2O能与盐酸反应生成盐和水,那么Na2O2能否与盐酸反应?
2Na2O2+4HCl=4NaCl+2H2O+O2↑
注意:Na2O2不是碱性氧化物
【过程探究】已知Na2O2与HCl作用,先生成H2O2,H2O2不稳定易分解放出O2,试写出以上两个反应化学方程式?
Na2O2+2HCl=2NaCl+H2O2
2H2O2=2H2O+O2↑
名称 氧化钠 过氧化钠
化学式
色、态
类别
生成条件
与水反应
与CO2反应
与盐酸反应
应用
转化
2Na2O+O2 = 2Na2O2
Na2O
Na2O2
白色固体
淡黄色固体
碱性氧化物
过氧化物(非碱性氧化物)
钠常温下与氧气反应
钠燃烧或加热时与氧气反应
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O =4NaOH + O2↑
Na2O + CO2 =Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
漂白剂、供氧剂
氧化钠和过氧化钠的性质比较
名称 碳酸钠 碳酸氢钠
化学式
俗称
类别
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打
盐 (正盐)
盐(酸式盐)
在初中,我们已经学习过碳酸钠和碳酸氢钠的一些用途,并了解了它们的一些性质,如碳酸钠和碳酸氢钠能与酸反应。
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠的性质碳酸钠和碳酸氢钠的性质
步骤 Na2CO3 NaHCO3
①加入几滴水
②加10mL水
③加1~2滴酚酞溶液
初步结论
加水结块;放热
加水部分溶解;
感受不到热量变化
振荡时间长时可溶解
固体量减少
溶液变红(较深)
溶液变微红色
Na2CO3比NaHCO3易溶于水,
溶液碱性Na2CO3比NaHCO3溶液强。
实验探究1
与碱Ca(OH)2反应
Na2CO3 + Ca(OH)2 = 2Na(OH) + CaCO3
a.Na2CO3和Ca(OH)2反应:
生成白色沉淀
b.NaHCO3和Ca(OH)2反应:
生成白色沉淀
性质 Na2CO3 NaHCO3 性质比较
水溶性 易溶 易溶 相同温度下Na2CO3 的溶解度大于NaHCO3
溶液的酸碱性 碱性 碱性 物质的量浓度相同时Na2CO3溶液的pH比NaHCO3溶液的大
热 稳定性 稳定 不稳定 NaHCO3受热分解生成Na2CO3、H2O 和CO2
与 酸反应 反应 反应 都放出CO2气体,但NaHCO3与酸反应的剧烈程度强于Na2CO3
如何区别碳酸钠和碳酸氢钠?
方法一:
取20mL水于烧杯中,加入5g的碳酸钠和碳酸氢钠,充分搅拌溶解,观察现象
碳酸钠完全溶解
碳酸氢钠部分溶解
溶解性
碳酸钠>碳酸氢钠
如何区别碳酸钠和碳酸氢钠?
思考1
小试管和大试管中分别装的是什么物质?
思考2
小苏打受热分解的化学方程式如何书写?
稳定性
碳酸钠>碳酸氢钠
因此小苏打被用做烘焙面包的发酵粉
方法二:
用pH试纸测定0.1mol/L的Na2CO3溶液和0.1mol/L的NaHCO3溶液,试比较其碱性强弱
实验结果
Na2CO3溶液pH≈12
NaHCO3溶液的pH≈8
碳酸钠溶液的碱性很强,因此被称为纯碱,且经常被用于去除油污
碱性
碳酸钠>碳酸氢钠
方法三:
设计实验:取2支试管,分别加入少量的碳酸钠和碳酸氢钠粉末,再分别倒入2mL的稀盐酸,比较反应产生气泡的快慢
实验结论
2支试管都产生气泡,且碳酸氢钠产生气泡快
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
方法四:
CO32-
H+
HCO3-
H+
H2CO3
H2O+CO2
2H+
一步完成
二步完成
现象分析:
Na2CO3:二步完成,先生成碳酸氢钠,后生成H2O和CO2
NaHCO3:一步完成,直接生成H2O和CO2
与酸反应产生气泡速率
碳酸钠<碳酸氢钠
因此碳酸氢钠被用于泡沫灭火器的原料
(可以快速的产生CO2气体)
(1)Na2CO3溶液→NaHCO3溶液
(2)NaHCO3→Na2CO3
①固体间转化:
②溶液间转化:
〖思考〗
如何除去Na2CO3固体中少量的NaHCO3?
(2) 如何除去NaHCO3溶液中少量的Na2CO3?
加热
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
Na2CO3 + CO2 + H2O = 2NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
2NaHCO3 = Na2CO3+ CO2↑+ H2O
△
通CO2
Na2CO3与NaHCO3的相互转化
Na2CO3可用于玻璃、造纸、纺织等工业;可做洗涤剂等。
NaHCO3可用于灭火剂、发酵剂、医药等。
Na2CO3与NaHCO3的用途
(一)氨碱法(索尔维制碱法)
1.原料:食盐、石灰石(经煅烧生成CaO和CO2)、氨气
2.步骤:
纯碱的工业制法
2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O
3.氨碱法的优点是:
(1)原料便宜; (2)产品纯碱的纯度高;
(3)副产品氨和二氧化碳都可以回收循环使用;
(4)制造步骤简单,适合于大规模生产。
(1)产生大量无用的副产品CaCl2
(2)NaCl利用率只有70%,约有30%的NaCl留在母液中。
(3)设备多,耗能大。
4.氨碱法的缺点是:
(二)侯氏制碱法工艺流程:
1.原料:食盐、氨气和二氧化碳(合成氨厂制取)
2.步骤:
NaCl+ NH3 +CO2 +H2O = NaHCO3↓+ NH4Cl
3、侯氏制碱法的现实意义
(1)符合“绿色化学的要求,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
(2)降低了成本,提高了综合经济效益。
1.概念
很多 在灼烧时都会使火焰呈现特殊的颜色。
根据火焰呈现的特征颜色,可以判断试样所含的 ,化学上把这样的定性分析操作称为焰色试验。
金属或它们的化合物
发生的是物理变化!!!
金属元素
焰色试验
2.操作
一些金属元素的焰色
①若没有铂丝,可以用光洁无锈的铁丝代替。因为它们在火焰上灼烧无颜色,同时熔点高,不易被氧化。
③观察钾元素的焰色反应时,要透过蓝色的钴玻璃,目的是滤去黄色的光,避免少量的钠元素对鉴别钾元素的干扰。
②洗涤铂丝用盐酸而不能用硫酸。用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物在高温时可挥发。
3.注意
①焰色反应在化学上常用于金属单质或其离子的鉴别。
②利用焰色反应制节日烟花。
4.应用
2.1.2 钠及其化合物
比如说,Na、Na2O2
有一些火灾现场不能用水灭火,为什么?
向 包有少量淡黄色粉末( Na2O2 )的脱脂棉
上滴几滴水,观察实验现象。
实验现象:脱脂棉着火
思考:为什么会出现这种现象?
滴水生火
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
氧化钠和过氧化钠
与水反应:
与酸性氧化物(CO2)反应:
碱性氧化物
与酸反应:
Na2O+2HCl =2NaCl+H2O
1、氧化钠——Na2O
操作+现象 初步结论
①把水滴入少量的Na2O2,带火星的木条放在试管口, 现象: ; 手触摸试管外壁, 。 ②用pH试纸检验溶液的酸碱性, 现象: ;
①反应产生O2,同时放出热量
②有氢氧化钠生成;
产生大量气泡,带火星的木条复燃
试管发烫
试纸变蓝溶液显碱性
(1)与水反应
2Na2O2+2H2O = 4Na+ + 4OH- + O2↑
请写出离子方程式?
Na2O2既是氧化剂又是还原剂
2Na2O2+2H2O == 4 NaOH+O2↑
失2e-
得2e-
-1
-2
0
2、过氧化钠——Na2O2
(2)与CO2反应
【思考与交流】为什么过氧化钠常用作防毒面具和潜水艇中的供氧剂?
过氧化钠能与呼出中的二氧化碳和水蒸气反应,同时释放出氧气。
2Na2O2+2CO2=2Na2CO3+O2
-1
-2
0
失2e-
得2e-
Na2O2既是氧化剂又是还原剂
(3)与盐酸反应
联想:Na2O能与盐酸反应生成盐和水,那么Na2O2能否与盐酸反应?
2Na2O2+4HCl=4NaCl+2H2O+O2↑
注意:Na2O2不是碱性氧化物
【过程探究】已知Na2O2与HCl作用,先生成H2O2,H2O2不稳定易分解放出O2,试写出以上两个反应化学方程式?
Na2O2+2HCl=2NaCl+H2O2
2H2O2=2H2O+O2↑
名称 氧化钠 过氧化钠
化学式
色、态
类别
生成条件
与水反应
与CO2反应
与盐酸反应
应用
转化
2Na2O+O2 = 2Na2O2
Na2O
Na2O2
白色固体
淡黄色固体
碱性氧化物
过氧化物(非碱性氧化物)
钠常温下与氧气反应
钠燃烧或加热时与氧气反应
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O =4NaOH + O2↑
Na2O + CO2 =Na2CO3
2Na2O2 + 2CO2 = 2Na2CO3 + O2
Na2O+2HCl===2NaCl+H2O
2Na2O2+4HCl===4NaCl+2H2O+O2↑
漂白剂、供氧剂
氧化钠和过氧化钠的性质比较
名称 碳酸钠 碳酸氢钠
化学式
俗称
类别
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打
盐 (正盐)
盐(酸式盐)
在初中,我们已经学习过碳酸钠和碳酸氢钠的一些用途,并了解了它们的一些性质,如碳酸钠和碳酸氢钠能与酸反应。
碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠的性质碳酸钠和碳酸氢钠的性质
步骤 Na2CO3 NaHCO3
①加入几滴水
②加10mL水
③加1~2滴酚酞溶液
初步结论
加水结块;放热
加水部分溶解;
感受不到热量变化
振荡时间长时可溶解
固体量减少
溶液变红(较深)
溶液变微红色
Na2CO3比NaHCO3易溶于水,
溶液碱性Na2CO3比NaHCO3溶液强。
实验探究1
与碱Ca(OH)2反应
Na2CO3 + Ca(OH)2 = 2Na(OH) + CaCO3
a.Na2CO3和Ca(OH)2反应:
生成白色沉淀
b.NaHCO3和Ca(OH)2反应:
生成白色沉淀
性质 Na2CO3 NaHCO3 性质比较
水溶性 易溶 易溶 相同温度下Na2CO3 的溶解度大于NaHCO3
溶液的酸碱性 碱性 碱性 物质的量浓度相同时Na2CO3溶液的pH比NaHCO3溶液的大
热 稳定性 稳定 不稳定 NaHCO3受热分解生成Na2CO3、H2O 和CO2
与 酸反应 反应 反应 都放出CO2气体,但NaHCO3与酸反应的剧烈程度强于Na2CO3
如何区别碳酸钠和碳酸氢钠?
方法一:
取20mL水于烧杯中,加入5g的碳酸钠和碳酸氢钠,充分搅拌溶解,观察现象
碳酸钠完全溶解
碳酸氢钠部分溶解
溶解性
碳酸钠>碳酸氢钠
如何区别碳酸钠和碳酸氢钠?
思考1
小试管和大试管中分别装的是什么物质?
思考2
小苏打受热分解的化学方程式如何书写?
稳定性
碳酸钠>碳酸氢钠
因此小苏打被用做烘焙面包的发酵粉
方法二:
用pH试纸测定0.1mol/L的Na2CO3溶液和0.1mol/L的NaHCO3溶液,试比较其碱性强弱
实验结果
Na2CO3溶液pH≈12
NaHCO3溶液的pH≈8
碳酸钠溶液的碱性很强,因此被称为纯碱,且经常被用于去除油污
碱性
碳酸钠>碳酸氢钠
方法三:
设计实验:取2支试管,分别加入少量的碳酸钠和碳酸氢钠粉末,再分别倒入2mL的稀盐酸,比较反应产生气泡的快慢
实验结论
2支试管都产生气泡,且碳酸氢钠产生气泡快
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
方法四:
CO32-
H+
HCO3-
H+
H2CO3
H2O+CO2
2H+
一步完成
二步完成
现象分析:
Na2CO3:二步完成,先生成碳酸氢钠,后生成H2O和CO2
NaHCO3:一步完成,直接生成H2O和CO2
与酸反应产生气泡速率
碳酸钠<碳酸氢钠
因此碳酸氢钠被用于泡沫灭火器的原料
(可以快速的产生CO2气体)
(1)Na2CO3溶液→NaHCO3溶液
(2)NaHCO3→Na2CO3
①固体间转化:
②溶液间转化:
〖思考〗
如何除去Na2CO3固体中少量的NaHCO3?
(2) 如何除去NaHCO3溶液中少量的Na2CO3?
加热
Na2CO3 NaHCO3
①通入CO2②少量的盐酸
①固体加热
②溶液滴加NaOH溶液
Na2CO3 + CO2 + H2O = 2NaHCO3
NaHCO3 + NaOH = Na2CO3 + H2O
2NaHCO3 = Na2CO3+ CO2↑+ H2O
△
通CO2
Na2CO3与NaHCO3的相互转化
Na2CO3可用于玻璃、造纸、纺织等工业;可做洗涤剂等。
NaHCO3可用于灭火剂、发酵剂、医药等。
Na2CO3与NaHCO3的用途
(一)氨碱法(索尔维制碱法)
1.原料:食盐、石灰石(经煅烧生成CaO和CO2)、氨气
2.步骤:
纯碱的工业制法
2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O
3.氨碱法的优点是:
(1)原料便宜; (2)产品纯碱的纯度高;
(3)副产品氨和二氧化碳都可以回收循环使用;
(4)制造步骤简单,适合于大规模生产。
(1)产生大量无用的副产品CaCl2
(2)NaCl利用率只有70%,约有30%的NaCl留在母液中。
(3)设备多,耗能大。
4.氨碱法的缺点是:
(二)侯氏制碱法工艺流程:
1.原料:食盐、氨气和二氧化碳(合成氨厂制取)
2.步骤:
NaCl+ NH3 +CO2 +H2O = NaHCO3↓+ NH4Cl
3、侯氏制碱法的现实意义
(1)符合“绿色化学的要求,提高了原料(NaCl)的利用率,不产生无用的CaCl2。
(2)降低了成本,提高了综合经济效益。
1.概念
很多 在灼烧时都会使火焰呈现特殊的颜色。
根据火焰呈现的特征颜色,可以判断试样所含的 ,化学上把这样的定性分析操作称为焰色试验。
金属或它们的化合物
发生的是物理变化!!!
金属元素
焰色试验
2.操作
一些金属元素的焰色
①若没有铂丝,可以用光洁无锈的铁丝代替。因为它们在火焰上灼烧无颜色,同时熔点高,不易被氧化。
③观察钾元素的焰色反应时,要透过蓝色的钴玻璃,目的是滤去黄色的光,避免少量的钠元素对鉴别钾元素的干扰。
②洗涤铂丝用盐酸而不能用硫酸。用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物在高温时可挥发。
3.注意
①焰色反应在化学上常用于金属单质或其离子的鉴别。
②利用焰色反应制节日烟花。
4.应用
