化学实验基本方法课件
图片预览










文档简介
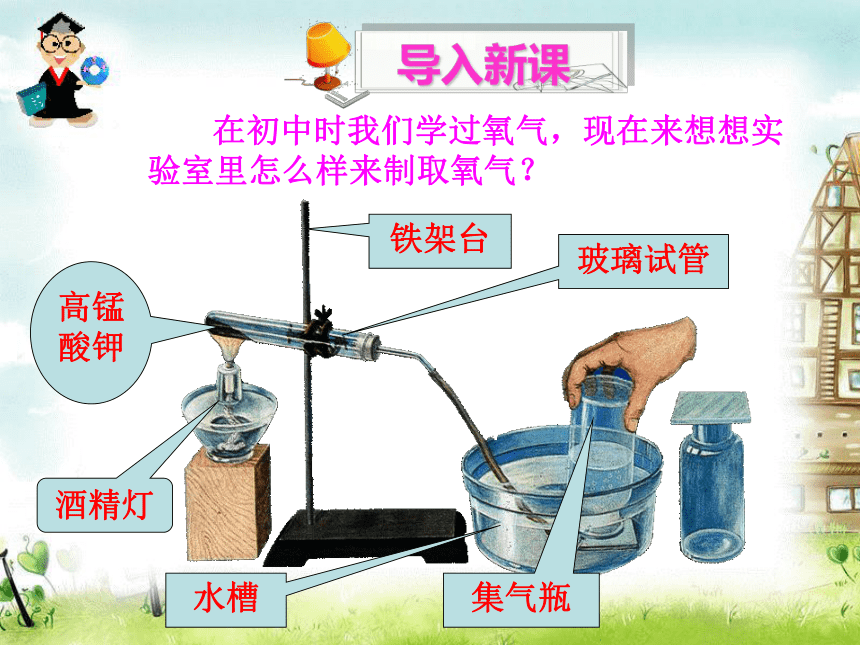
课件64张PPT。 在初中时我们学过氧气,现在来想想实验室里怎么样来制取氧气?高锰酸钾玻璃试管铁架台水槽集气瓶酒精灯 导入新课 那么在制取氧气结束时,如果先撤掉酒精灯会发生什么事呢?倒吸水
引起
试管爆裂 所以,我们要掌握正确的操作基本方法是多么重要!第一节化学实验基本方法一、化学实验安全二、混合物的分离和提纯 通过观察教师的示范操作,培养学生的观察能力,并初步掌握蒸馏、萃取分液操作的要点;通过自主练习,掌握蒸馏、萃取分液操作的要领;通过学生间的相互合作,培养学生的合作精神;通过小组汇报评议,强化蒸馏、萃取分液操作的具体应用。 教学目标知识与能力: 掌握物质的常见分离方法,了解各分离方法适用的混合物状态;学会过滤、蒸发、蒸馏、萃取分液的实验操作技能。过程与方法: 通过实验培养学生学习化学的兴趣;通过实验培养学生严谨的科学态度和实事求是的品质。情感态度与价值观:蒸馏、萃取分液的方法。
离子的检测方法。重点难点物质的分离和提纯的方法。 教学重难点一、化学实验安全1.遵守实验室规则。
2.了解安全措施。
3.掌握正确的操作方法。
4.重视并逐步熟悉污染物和废物的处理方法。(1)不准带食物进入实验室,违者,教师有权拒绝其进入。
(2)进入实验室后,按指定座位就坐(一般不变动),轻放凳子,不得在实验室大声喧哗、追逐,就坐后,检查桌子、仪器整洁情况,若发现问题,立刻报告老师。
(3)在实验过程中,若不小心损坏仪器,即向任课教师报告。并申请补领。1.遵守实验室规则(4)实验结束时,及时搞好清洁,摆好仪器、药品;挂起凳子,有序地离开课室。小组长协助老师检查。
(5)绝不能乱写画桌子,爱护设备,若有违反,照价培偿,并公开批评或处分。
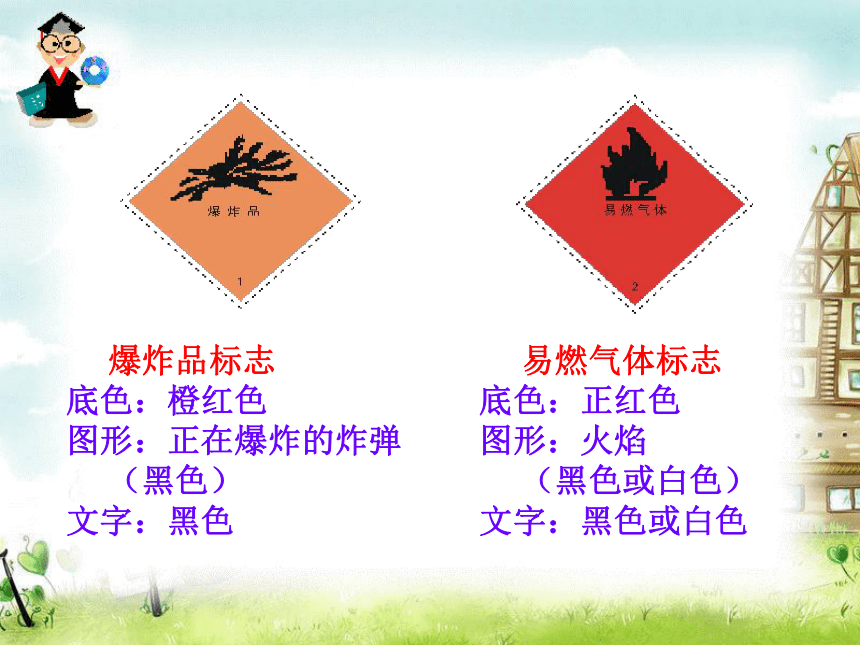
(6)在实验室上课时动作要迅速。常见危险品的分类和标志2.了解安全措施 爆炸品标志?
底色:橙红色
图形:正在爆炸的炸弹
(黑色)
文字:黑色? 易燃气体标志
底色:正红色
图形:火焰
(黑色或白色)
文字:黑色或白色 易燃液体标志
底色:红色
图形:火焰
(黑色或白色)?
文字:黑色或白色?? 易燃固体标志
底色:红白相间的垂直宽条
(红7、白6)
图形:火焰(黑色)
文字:黑色
自燃物品标志
底色:上半部白色,
下半部红色?
图形:火焰(黑色或白色)
文字:黑色或白色遇湿易燃物品标志
底色:蓝色,
图形:火焰(黑色)
文字:黑色氧化剂/有机过氧化物标志
底色:柠檬黄色??
图形:从圆圈中冒出的火焰
(黑色)
文字:黑色?????有毒品/剧毒品标志
底色:白色
图形:骷髅头和交叉骨
形(黑色)
文字:黑色
一级 二级 ? 三级
放射性物品标志?
底色:上半部黄色,下半部白色
图形:上半部三叶形(黑色)
下半部一条、两条、三条垂直的红色宽条?
文字:黑色 腐蚀品标志
底色:上半部白色,下半部
黑色
图形:上半部两个试管中液
体分 别向金属板和
手上滴落(黑色)
文字:(下半部)白色 不燃气体标志
底色:绿色
图形:气瓶(黑色或
白色)
文字:黑色?3.掌握正确的操作方法初中学过的实验操作(一)药品的取用(二)物质的称量(三)物质的加热(五)仪器的洗涤(六)装置气密性的检查(四)仪器的装备4.重视并逐步熟悉污染物和废物的处理方法包括有害气体、废液、固体废弃物的处理。例如:
破损玻璃回收二、混合物的分离和提纯?思考与交流?沙里淘金1.过滤与蒸发【实验 1-1】 粗盐的提纯(1)粗盐的成份 不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等。粗盐(2)操作步骤a.溶解 称取约4g粗盐加到
约12ml水中。b.过滤 沿着玻璃棒,缓
慢地往漏斗里倒,玻
璃棒的另一端要放在
多层的纸上。c.蒸发 一边加热,一边
不断地用玻璃棒搅拌。 经过蒸发后,得到的氯化钠含有其他杂质,我们用什么方法来检验呢? 比如是否含有硫酸盐?【实验 1-2】 硫酸盐的检验 取【实验 1-1】得到的盐约0.5g配成2ml水溶液,并滴入几点盐酸,然后滴入几滴氯化钡溶液。现象:生成不溶于稀盐酸的白色沉淀。化学方程式表示为:想一想其他离子的检验Cl-: 与硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。离子检验方法 Ca2+:与含Ba2+的溶液反应,生成白色沉淀,该沉淀溶于硝酸(或盐酸),生成无色无气味、能使澄清石灰水变浑浊的气体(CO2)。CO32-:Mg2+:离子检验方法 与氢氧化钠溶液反应,生成白色淀。与氯化钙溶液反应,生成白色沉淀,加入稀盐酸生成的气体能使澄清的石灰水变浑浊。思考与总结粗盐提纯如何除去粗盐中含有以下可溶性杂质?Na2SO4+BaCl2= 2NaCl+BaSO4Na2CO3MaCl2+2NaOH=2NaCl+Ma(OH)2BaCl2NaOHCaCl2+Na2CO3=2NaCl+CaCO32.蒸馏和萃取A.蒸馏定义:指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。实验室一般应用于下列几方面:
(1)分离液体混合物,仅对混合物中各成分的沸点
有较大的差别时才能达到较有效的分离;
(2)测定纯化合物的沸点;
(3)提纯,通过蒸馏含有少量杂质的物质,提高其
纯度;
(4)回收溶剂,或蒸出部分溶剂以浓缩溶液。 冷凝管的冷水要从下进,从上出,
简言之:下进上出 实验室制取蒸馏水。温度计蒸馏瓶冷凝管锥形瓶冷水【实验 1-3】 蒸馏的应用由白色的沉淀产生。水沸腾后产生水蒸气,
经冷凝管后又变成了
液态水。无现象产生实验说明:通过蒸馏可以得到纯净的水。蒸馏法在生活中的应用海水淡化工厂B.萃取 利用物质在互不相溶的溶剂里溶解度不同,
用一种溶剂把物质从它与另一种溶剂所组成的溶
液里提取出来的过程。定义: 分液漏斗(右图)实验室萃取的主要仪器:操作步骤:
①检漏 ②萃取
③振荡 ④静置 ⑤分液【实验 1-4】 萃取的应用——萃取碘1.用量筒量取20ml碘的饱和水溶液,倒入分液漏斗,然后再注入4ml四氯化碳,盖好玻璃塞。2.振荡:用右手压住分液漏斗口
部,右手握住活塞部分,把分液
漏斗倒转过来振荡。如右图:
振荡后打开活塞,使漏斗内
气体放出。3.将分液漏斗放在铁架台
上,静置,如右图。4.分液:将分液漏斗颈上
的玻璃塞打开,再将分液
漏斗下面的活塞拧开,使
下层液体慢慢沿烧杯壁流
下,如右图。萃取在生活中的应用萃取的天然香料药品的提取萃取在生活中的应用核燃料的处理技术3.混合物分离,检验的应用固体与液体不互溶的混合物粗盐的提纯①难挥发的固体杂质在液体中形成的混合物
②互溶液体沸点有明显差异蒸馏水、无水乙醇的制备、石油的分馏CCl4(沸点76.75℃)和甲苯(沸点110.6℃)混合物的分离蒸馏过滤想一想,还有哪些应用?分液萃取两种互不混溶
的液体混合物CCl4和水的分离溶质在互不相
溶的溶剂里溶
解度不同利用CCl4从溴水中
萃取溴3、掌握正确的操作方法。一.化学实验安全1、遵守实验室规则。2、了解安全措施。 课堂小结1、过滤:2、蒸发:3、蒸馏:4、萃取:二.混合物的分离和提纯不可溶性的固体和液体分离可溶性的固体和液体分离沸点不同的液体混合物分离溶解度不同的可溶性混合物分离方法适用范围(2000上海卷)下列实验操作中错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口
C.滴定时,大手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的大盘,砝码放在托盘天平的右盘中托盘天平的右盘中C 高考链接解析: C项,正确的操作应该是左手握住锥形瓶,右手控制滴定管的活塞,眼睛注视锥形瓶内的液面。2.(03上海卷)下面是实验室制取氨气的装置和
选用的试剂,其中错误的是( )A.B.C.D.AC解析:A项,试管口应该朝上,防止氢氧化氨固体堵塞试管;
C项,氢氧化钙不应该与氯化铵共热,使产生的氨气不纯,会混有有未反应的氯化氢气体产生。3.(08年广东卷)下列有关实验操作的说法正
确的是( )
A.可用25ml碱式滴定管量取20.00mlKMnO4
B.用pH试纸测试溶液的pH时,需要用蒸馏
水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过
容积的2/3,液体也不能蒸干
D.将金属钠在研钵中研成粉末,使钠与水
反应的实验更安全C解析:A项,不能用碱式滴定取,因为高锰酸钾有氧化性,应当使用酸式滴定管。
B项,用pH试纸测定溶液时,不能用蒸馏水润湿,那样会使溶液浓度降低。
D项,做金属钠与水反应的实验时,用小刀将钠切成小块,金属钠研成粉末时会导致金属钠完全氧化甚至燃烧。1.下列实验中用错试剂的是( )
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精萃取碘水中的碘
C.用稀盐酸洗去残留在试管壁上的铜
D.用碱石灰吸收氨气中的水蒸气
B 课堂练习2. 某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4·10H2O),可选择的操作有(1)加适量H2SO4溶液;(2)加金属钠;(3)结晶;(4)加过量NaOH溶液;(5)加强热脱结晶水;(6)过滤。正确的操作步骤 ( )
A.(2)(6)(3) B.(4)(6)(1)(3)
C.(4)(6)(3)(5) D.(2)(6)(1)(3)(5)B3.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )A4.下列各组溶液,不用其他试剂,就可将它们区别开的是( )
A.盐酸 氢氧化钠 碳酸钠 硫酸铜
B.盐酸 硝酸银 氯化钠 硝酸钠
C.氢氧化钠 硫酸镁 碳酸钠 硫酸氢钠
D.氯化钡 硫酸钠 氯化钙 硝酸钙A5.下图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放______________
(2)检验:证明CO中混有CO2,装置内应盛放 ______________ 浓硫酸澄清石灰水(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A”或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通人。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。BABBA6 . A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。试确定A、B、C、D、X各代表何种溶液。
A:________,B:________,C:_______,
D:_______,X:_______。NaOHNaNO3 Ba(NO3)2 HNO3 MgSO4 7. 粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为????????????????????????????????? 。(2)如何运用最简方法检验溶液中有无SO42-离子????????????????????????? 。如果有,应该如何除去SO42-离子????????????????????????? 。(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是???????????????????? (4)将经过操作(3)后的溶液过滤。请问这一操作
能除掉哪些杂质???????????????????????????? 。 (5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;溶时:????????????????????过滤时:????????????????蒸发时:????????????????????(1)①②③④⑤
(2)静止片刻在上层清液处,滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,则溶液中有SO42-不出现浑浊就说明SO42-已经除尽。除去SO42-的方法是在溶液中加入过量的BaCl2溶液。
(3)除去Ca2+、Mg2+以及加入过量Ba2+
(4)BaSO4、CaCO3、MgCO3、BaCO3等杂质
(5)搅拌,加速溶解?;使待滤液体沿玻璃棒流入漏
斗,防止外洒;搅拌,防止因局部过热液滴或晶体飞溅。解答:8. 以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
【实验用品】硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
【实验步骤】
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵体中研细,再放回到坩埚中;③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称量;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据试验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题
⑴完成本实验还需要的试样用品是??????????????????????? 。⑵指出实验步骤中存在的错误并改正???????????????? 。
⑶硫酸钠不能放置在空气中冷却原因是???????????? 。
⑷步骤⑤的目的是???????????? 。
⑸下面的情况有可能造成测试结果偏高的是( )
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.试验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出解答:(1)坩埚钳、酒精灯、泥三角
(2)步骤②有错误,应先将试样研细后放入坩埚称重
(3)硫酸钠放置在空气中冷却时,会吸收空气中的水分
(4)保证试样脱水完全
(5)BDF1.C 2.B 3.D4.海水食盐的生产。
5.萃取的方法。利用油汤易溶于汽油而不易溶于水的原理。
6.用盐酸与陶瓷片反应,生成的气体能使澄清石灰水变浑浊。
7.不可靠。因为白色沉淀有可能是碳酸钡。在生成的溶液中加入一定量的硝酸溶液,看看溶液里的沉淀是否溶解并产生气体,如果没有那么就说明是含有硝酸盐。 教材习题答案
引起
试管爆裂 所以,我们要掌握正确的操作基本方法是多么重要!第一节化学实验基本方法一、化学实验安全二、混合物的分离和提纯 通过观察教师的示范操作,培养学生的观察能力,并初步掌握蒸馏、萃取分液操作的要点;通过自主练习,掌握蒸馏、萃取分液操作的要领;通过学生间的相互合作,培养学生的合作精神;通过小组汇报评议,强化蒸馏、萃取分液操作的具体应用。 教学目标知识与能力: 掌握物质的常见分离方法,了解各分离方法适用的混合物状态;学会过滤、蒸发、蒸馏、萃取分液的实验操作技能。过程与方法: 通过实验培养学生学习化学的兴趣;通过实验培养学生严谨的科学态度和实事求是的品质。情感态度与价值观:蒸馏、萃取分液的方法。
离子的检测方法。重点难点物质的分离和提纯的方法。 教学重难点一、化学实验安全1.遵守实验室规则。
2.了解安全措施。
3.掌握正确的操作方法。
4.重视并逐步熟悉污染物和废物的处理方法。(1)不准带食物进入实验室,违者,教师有权拒绝其进入。
(2)进入实验室后,按指定座位就坐(一般不变动),轻放凳子,不得在实验室大声喧哗、追逐,就坐后,检查桌子、仪器整洁情况,若发现问题,立刻报告老师。
(3)在实验过程中,若不小心损坏仪器,即向任课教师报告。并申请补领。1.遵守实验室规则(4)实验结束时,及时搞好清洁,摆好仪器、药品;挂起凳子,有序地离开课室。小组长协助老师检查。
(5)绝不能乱写画桌子,爱护设备,若有违反,照价培偿,并公开批评或处分。
(6)在实验室上课时动作要迅速。常见危险品的分类和标志2.了解安全措施 爆炸品标志?
底色:橙红色
图形:正在爆炸的炸弹
(黑色)
文字:黑色? 易燃气体标志
底色:正红色
图形:火焰
(黑色或白色)
文字:黑色或白色 易燃液体标志
底色:红色
图形:火焰
(黑色或白色)?
文字:黑色或白色?? 易燃固体标志
底色:红白相间的垂直宽条
(红7、白6)
图形:火焰(黑色)
文字:黑色
自燃物品标志
底色:上半部白色,
下半部红色?
图形:火焰(黑色或白色)
文字:黑色或白色遇湿易燃物品标志
底色:蓝色,
图形:火焰(黑色)
文字:黑色氧化剂/有机过氧化物标志
底色:柠檬黄色??
图形:从圆圈中冒出的火焰
(黑色)
文字:黑色?????有毒品/剧毒品标志
底色:白色
图形:骷髅头和交叉骨
形(黑色)
文字:黑色
一级 二级 ? 三级
放射性物品标志?
底色:上半部黄色,下半部白色
图形:上半部三叶形(黑色)
下半部一条、两条、三条垂直的红色宽条?
文字:黑色 腐蚀品标志
底色:上半部白色,下半部
黑色
图形:上半部两个试管中液
体分 别向金属板和
手上滴落(黑色)
文字:(下半部)白色 不燃气体标志
底色:绿色
图形:气瓶(黑色或
白色)
文字:黑色?3.掌握正确的操作方法初中学过的实验操作(一)药品的取用(二)物质的称量(三)物质的加热(五)仪器的洗涤(六)装置气密性的检查(四)仪器的装备4.重视并逐步熟悉污染物和废物的处理方法包括有害气体、废液、固体废弃物的处理。例如:
破损玻璃回收二、混合物的分离和提纯?思考与交流?沙里淘金1.过滤与蒸发【实验 1-1】 粗盐的提纯(1)粗盐的成份 不溶性的泥沙,可溶性的CaCl2、MgCl2以及一些硫酸盐等。粗盐(2)操作步骤a.溶解 称取约4g粗盐加到
约12ml水中。b.过滤 沿着玻璃棒,缓
慢地往漏斗里倒,玻
璃棒的另一端要放在
多层的纸上。c.蒸发 一边加热,一边
不断地用玻璃棒搅拌。 经过蒸发后,得到的氯化钠含有其他杂质,我们用什么方法来检验呢? 比如是否含有硫酸盐?【实验 1-2】 硫酸盐的检验 取【实验 1-1】得到的盐约0.5g配成2ml水溶液,并滴入几点盐酸,然后滴入几滴氯化钡溶液。现象:生成不溶于稀盐酸的白色沉淀。化学方程式表示为:想一想其他离子的检验Cl-: 与硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。离子检验方法 Ca2+:与含Ba2+的溶液反应,生成白色沉淀,该沉淀溶于硝酸(或盐酸),生成无色无气味、能使澄清石灰水变浑浊的气体(CO2)。CO32-:Mg2+:离子检验方法 与氢氧化钠溶液反应,生成白色淀。与氯化钙溶液反应,生成白色沉淀,加入稀盐酸生成的气体能使澄清的石灰水变浑浊。思考与总结粗盐提纯如何除去粗盐中含有以下可溶性杂质?Na2SO4+BaCl2= 2NaCl+BaSO4Na2CO3MaCl2+2NaOH=2NaCl+Ma(OH)2BaCl2NaOHCaCl2+Na2CO3=2NaCl+CaCO32.蒸馏和萃取A.蒸馏定义:指利用液体混合物中各组分挥发性的差异而将组分分离的传质过程。实验室一般应用于下列几方面:
(1)分离液体混合物,仅对混合物中各成分的沸点
有较大的差别时才能达到较有效的分离;
(2)测定纯化合物的沸点;
(3)提纯,通过蒸馏含有少量杂质的物质,提高其
纯度;
(4)回收溶剂,或蒸出部分溶剂以浓缩溶液。 冷凝管的冷水要从下进,从上出,
简言之:下进上出 实验室制取蒸馏水。温度计蒸馏瓶冷凝管锥形瓶冷水【实验 1-3】 蒸馏的应用由白色的沉淀产生。水沸腾后产生水蒸气,
经冷凝管后又变成了
液态水。无现象产生实验说明:通过蒸馏可以得到纯净的水。蒸馏法在生活中的应用海水淡化工厂B.萃取 利用物质在互不相溶的溶剂里溶解度不同,
用一种溶剂把物质从它与另一种溶剂所组成的溶
液里提取出来的过程。定义: 分液漏斗(右图)实验室萃取的主要仪器:操作步骤:
①检漏 ②萃取
③振荡 ④静置 ⑤分液【实验 1-4】 萃取的应用——萃取碘1.用量筒量取20ml碘的饱和水溶液,倒入分液漏斗,然后再注入4ml四氯化碳,盖好玻璃塞。2.振荡:用右手压住分液漏斗口
部,右手握住活塞部分,把分液
漏斗倒转过来振荡。如右图:
振荡后打开活塞,使漏斗内
气体放出。3.将分液漏斗放在铁架台
上,静置,如右图。4.分液:将分液漏斗颈上
的玻璃塞打开,再将分液
漏斗下面的活塞拧开,使
下层液体慢慢沿烧杯壁流
下,如右图。萃取在生活中的应用萃取的天然香料药品的提取萃取在生活中的应用核燃料的处理技术3.混合物分离,检验的应用固体与液体不互溶的混合物粗盐的提纯①难挥发的固体杂质在液体中形成的混合物
②互溶液体沸点有明显差异蒸馏水、无水乙醇的制备、石油的分馏CCl4(沸点76.75℃)和甲苯(沸点110.6℃)混合物的分离蒸馏过滤想一想,还有哪些应用?分液萃取两种互不混溶
的液体混合物CCl4和水的分离溶质在互不相
溶的溶剂里溶
解度不同利用CCl4从溴水中
萃取溴3、掌握正确的操作方法。一.化学实验安全1、遵守实验室规则。2、了解安全措施。 课堂小结1、过滤:2、蒸发:3、蒸馏:4、萃取:二.混合物的分离和提纯不可溶性的固体和液体分离可溶性的固体和液体分离沸点不同的液体混合物分离溶解度不同的可溶性混合物分离方法适用范围(2000上海卷)下列实验操作中错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸烧瓶支管口
C.滴定时,大手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.称量时,称量物放在称量纸上,置于托盘天平的大盘,砝码放在托盘天平的右盘中托盘天平的右盘中C 高考链接解析: C项,正确的操作应该是左手握住锥形瓶,右手控制滴定管的活塞,眼睛注视锥形瓶内的液面。2.(03上海卷)下面是实验室制取氨气的装置和
选用的试剂,其中错误的是( )A.B.C.D.AC解析:A项,试管口应该朝上,防止氢氧化氨固体堵塞试管;
C项,氢氧化钙不应该与氯化铵共热,使产生的氨气不纯,会混有有未反应的氯化氢气体产生。3.(08年广东卷)下列有关实验操作的说法正
确的是( )
A.可用25ml碱式滴定管量取20.00mlKMnO4
B.用pH试纸测试溶液的pH时,需要用蒸馏
水润湿试纸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过
容积的2/3,液体也不能蒸干
D.将金属钠在研钵中研成粉末,使钠与水
反应的实验更安全C解析:A项,不能用碱式滴定取,因为高锰酸钾有氧化性,应当使用酸式滴定管。
B项,用pH试纸测定溶液时,不能用蒸馏水润湿,那样会使溶液浓度降低。
D项,做金属钠与水反应的实验时,用小刀将钠切成小块,金属钠研成粉末时会导致金属钠完全氧化甚至燃烧。1.下列实验中用错试剂的是( )
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精萃取碘水中的碘
C.用稀盐酸洗去残留在试管壁上的铜
D.用碱石灰吸收氨气中的水蒸气
B 课堂练习2. 某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4·10H2O),可选择的操作有(1)加适量H2SO4溶液;(2)加金属钠;(3)结晶;(4)加过量NaOH溶液;(5)加强热脱结晶水;(6)过滤。正确的操作步骤 ( )
A.(2)(6)(3) B.(4)(6)(1)(3)
C.(4)(6)(3)(5) D.(2)(6)(1)(3)(5)B3.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )A4.下列各组溶液,不用其他试剂,就可将它们区别开的是( )
A.盐酸 氢氧化钠 碳酸钠 硫酸铜
B.盐酸 硝酸银 氯化钠 硝酸钠
C.氢氧化钠 硫酸镁 碳酸钠 硫酸氢钠
D.氯化钡 硫酸钠 氯化钙 硝酸钙A5.下图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放______________
(2)检验:证明CO中混有CO2,装置内应盛放 ______________ 浓硫酸澄清石灰水(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的 端通入(填“A”或“B”,下同);若收集比空气重的气体,则气体从 端通入。若用排水法收集O2时,瓶内应先装满水,气体从 端通人。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 端通入。BABBA6 . A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定。试确定A、B、C、D、X各代表何种溶液。
A:________,B:________,C:_______,
D:_______,X:_______。NaOHNaNO3 Ba(NO3)2 HNO3 MgSO4 7. 粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ;②固定铁圈位置 ;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为????????????????????????????????? 。(2)如何运用最简方法检验溶液中有无SO42-离子????????????????????????? 。如果有,应该如何除去SO42-离子????????????????????????? 。(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是???????????????????? (4)将经过操作(3)后的溶液过滤。请问这一操作
能除掉哪些杂质???????????????????????????? 。 (5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;溶时:????????????????????过滤时:????????????????蒸发时:????????????????????(1)①②③④⑤
(2)静止片刻在上层清液处,滴加一滴BaCl2溶液,如果出现白色浑浊或者沉淀,则溶液中有SO42-不出现浑浊就说明SO42-已经除尽。除去SO42-的方法是在溶液中加入过量的BaCl2溶液。
(3)除去Ca2+、Mg2+以及加入过量Ba2+
(4)BaSO4、CaCO3、MgCO3、BaCO3等杂质
(5)搅拌,加速溶解?;使待滤液体沿玻璃棒流入漏
斗,防止外洒;搅拌,防止因局部过热液滴或晶体飞溅。解答:8. 以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
【实验用品】硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
【实验步骤】
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵体中研细,再放回到坩埚中;③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称量;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据试验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题
⑴完成本实验还需要的试样用品是??????????????????????? 。⑵指出实验步骤中存在的错误并改正???????????????? 。
⑶硫酸钠不能放置在空气中冷却原因是???????????? 。
⑷步骤⑤的目的是???????????? 。
⑸下面的情况有可能造成测试结果偏高的是( )
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.试验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出解答:(1)坩埚钳、酒精灯、泥三角
(2)步骤②有错误,应先将试样研细后放入坩埚称重
(3)硫酸钠放置在空气中冷却时,会吸收空气中的水分
(4)保证试样脱水完全
(5)BDF1.C 2.B 3.D4.海水食盐的生产。
5.萃取的方法。利用油汤易溶于汽油而不易溶于水的原理。
6.用盐酸与陶瓷片反应,生成的气体能使澄清石灰水变浑浊。
7.不可靠。因为白色沉淀有可能是碳酸钡。在生成的溶液中加入一定量的硝酸溶液,看看溶液里的沉淀是否溶解并产生气体,如果没有那么就说明是含有硝酸盐。 教材习题答案
