2023春化学苏教版选择性必修二 3.2 离子键 离子晶体 课件(共26张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 3.2 离子键 离子晶体 课件(共26张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 14:57:43 | ||
图片预览







文档简介
专题3 微粒间作用力与物质性质
第二单元 离子键 离子晶体
学习目标
1.理解离子键的本质,能结合离子键的本质解释离子晶体的性质。
2.认识常见离子晶体的结构模型,理解离子晶体的结构特点,预测其性质,强化证据推理与模型认知的学科核心素养。
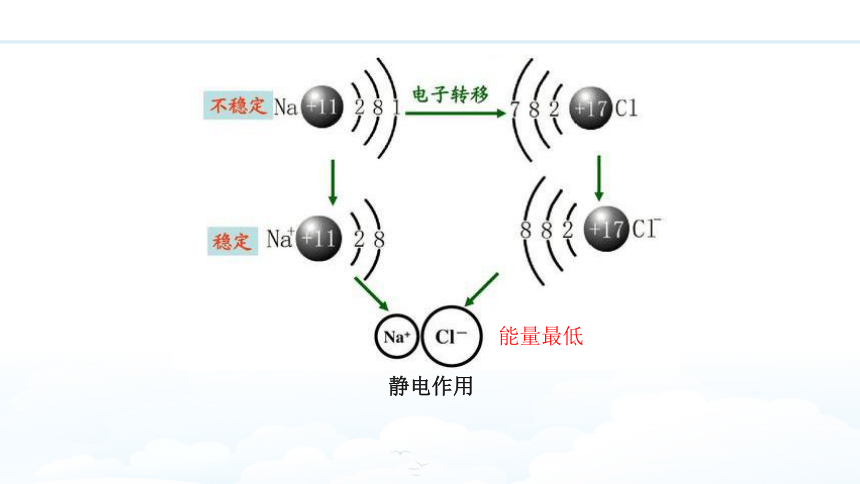
温故知新
静电作用
能量最低
一、离子键
带相反电荷离子之间的相互作用。
1.实质——一种静电作用。包括引力和斥力。
2.特征——没有方向性和饱和性
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
知识梳理
拆开1 mol离子晶体使之形成气态阴、阳离子所吸收的能量。
NaCl(s)→Na+(g)+Cl-(g)
U=786 kJ·mol-1
晶格能越大,离子键越牢固,离子晶体熔点越高,硬度越大。
二、晶格能
1.定义
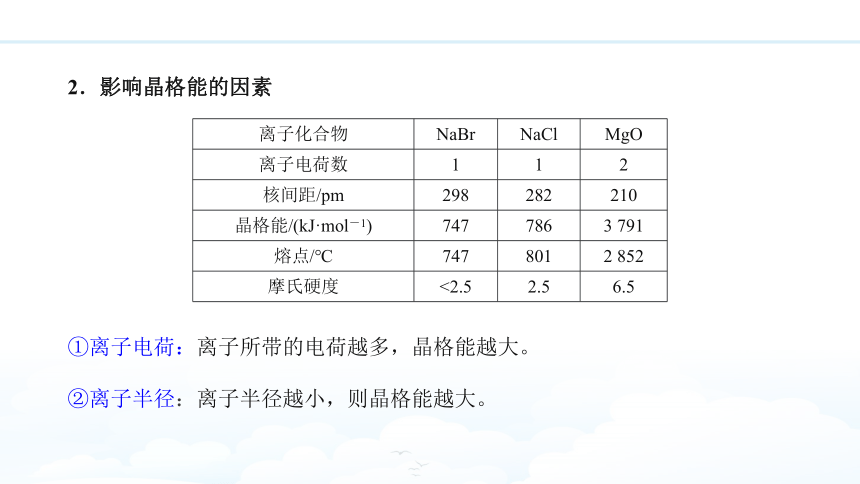
②离子半径:离子半径越小,则晶格能越大。
①离子电荷:离子所带的电荷越多,晶格能越大。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 离子化合物
NaBr
NaCl
MgO
离子电荷数
1
1
2
核间距/pm
298
282
210
晶格能/(kJ·mol-1)
747
786
3 791
熔点/℃
747
801
2 852
摩氏硬度
<2.5
2.5
6.5
2.影响晶格能的因素
重晶石 BaSO4
明矾 KAl(SO4)2·12H2O
食盐 NaCl
萤石 CaF2
强碱、活泼金属氧化物、大部分的盐、金属过氧化物、金属氢化物等。
(1)成键粒子:
阴、阳离子
(2)微粒间的相互作用力:
离子键
(4)常见的离子晶体:
(3)熔化时破坏的作用力:
离子键
注意:
① 离子晶体中不存在单独的分子;
②化学式表示的是离子的个数比。
1.由阳离子和阴离子通过离子键结合而成的晶体。
三、离子晶体
(1)NaCl型晶胞
2.常见晶胞类型
观察NaCl晶胞,按以下要求填空。
Cl-
Na+
1.每个晶胞含钠离子、氯离子的个数:
Na+:_______,Cl- :________;
4个
4个
2.Na+配位数:_____,Cl- 配位数:_____;
6
6
3.与Na+等距离且最近的Na+ 有:___个;
12
4.每个Cl-周围距离最近的Na+在空间构成的
几何构型为_______________;
5.每个Na+周围距离最近的Cl-在空间构成的几何构型为________________。
正八面体
正八面体
—Cl-
NaCl的晶体结构模型
—Na+
正八面体
正八面体
与某个Na+最近且等距离的Na+个数
与某个Cl-最近且等距离的Cl-个数
都是12个
1.每个晶胞含铯离子、氯离子的个数:
Cs+:_______,Cl- :________;
1个
1个
2. CsCl晶体中阴、阳离子配位数:
Cs+配位数:_____,Cl- 配位数:_____;
8
8
3.与Cs+等距离且最近的Cs+ 有:_____个。
6
(2)氯化铯型晶胞
CsCl晶胞
1.Ca2+在大立方体的________和 _______, 8个F-在大立方体内构成一个 __________;
2.每个晶胞含Ca2+ 、 F-的个数:
Ca2+:_______F- :________;
3.CaF2晶体中阴、阳离子配位数:
Ca2+配位数:_____,F- 配位数:_____;
4.每个F-周围与距离最近的Ca2+在空间构成的几何构型为____________。
顶角
面心
小立方体
4个
8个
8
4
正四面体
(3)CaF2型晶胞
Ca2+配位数:8
配位多面体:立方体
—Ca2+
—F-
CaF2晶体结构
F- 配位数:4
配位多面体:正四面体
思考:同为离子晶体,为什么NaCl和CsCl的晶胞结构不相同?
CsCl晶胞
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
6
6
8
8
离子晶体中不同离子周围异电性离子数目的多少主要取决于阴、阳离子的相对大小。
r+r?越大,配位数越大
?
1.没有单个分子存在;“NaCl” 不表示分子式。
2.熔沸点较高,硬度较大而脆,难挥发、难压缩;
3.一般易溶于极性溶剂(如水),而难溶于非极性溶剂;
4.固态不导电,水溶液或者熔融状态下能导电。
四、离子晶体的特点
1.正误判断
(1)活泼金属元素与活泼非金属元素之间一定形成离子键 ( )
(2)含有阳离子的晶体一定是离子晶体 ( )
(3)离子晶体有固定的配位数,说明离子键有饱和性 ( )
(4)金属晶体与离子晶体的导电原理相同 ( )
×
×
×
×
课堂练习
2.下列关于离子键的说法中错误的是 ( )
A.离子键没有方向性和饱和性
B.非金属元素组成的物质也可以含离子键
C.形成离子键时离子间的静电作用包括静电吸引和静电排斥
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
D
3.具有下列电子排布的原子中最难形成离子键的是 ( )
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
A
4.MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是 ( )
A.MgO>Rb2O>BaO>CaO B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O D.CaO>BaO>Rb2O>MgO
B
5.下列性质适合于离子晶体的是 ( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
A
本节内容结束
第二单元 离子键 离子晶体
学习目标
1.理解离子键的本质,能结合离子键的本质解释离子晶体的性质。
2.认识常见离子晶体的结构模型,理解离子晶体的结构特点,预测其性质,强化证据推理与模型认知的学科核心素养。
温故知新
静电作用
能量最低
一、离子键
带相反电荷离子之间的相互作用。
1.实质——一种静电作用。包括引力和斥力。
2.特征——没有方向性和饱和性
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
知识梳理
拆开1 mol离子晶体使之形成气态阴、阳离子所吸收的能量。
NaCl(s)→Na+(g)+Cl-(g)
U=786 kJ·mol-1
晶格能越大,离子键越牢固,离子晶体熔点越高,硬度越大。
二、晶格能
1.定义
②离子半径:离子半径越小,则晶格能越大。
①离子电荷:离子所带的电荷越多,晶格能越大。
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A} 离子化合物
NaBr
NaCl
MgO
离子电荷数
1
1
2
核间距/pm
298
282
210
晶格能/(kJ·mol-1)
747
786
3 791
熔点/℃
747
801
2 852
摩氏硬度
<2.5
2.5
6.5
2.影响晶格能的因素
重晶石 BaSO4
明矾 KAl(SO4)2·12H2O
食盐 NaCl
萤石 CaF2
强碱、活泼金属氧化物、大部分的盐、金属过氧化物、金属氢化物等。
(1)成键粒子:
阴、阳离子
(2)微粒间的相互作用力:
离子键
(4)常见的离子晶体:
(3)熔化时破坏的作用力:
离子键
注意:
① 离子晶体中不存在单独的分子;
②化学式表示的是离子的个数比。
1.由阳离子和阴离子通过离子键结合而成的晶体。
三、离子晶体
(1)NaCl型晶胞
2.常见晶胞类型
观察NaCl晶胞,按以下要求填空。
Cl-
Na+
1.每个晶胞含钠离子、氯离子的个数:
Na+:_______,Cl- :________;
4个
4个
2.Na+配位数:_____,Cl- 配位数:_____;
6
6
3.与Na+等距离且最近的Na+ 有:___个;
12
4.每个Cl-周围距离最近的Na+在空间构成的
几何构型为_______________;
5.每个Na+周围距离最近的Cl-在空间构成的几何构型为________________。
正八面体
正八面体
—Cl-
NaCl的晶体结构模型
—Na+
正八面体
正八面体
与某个Na+最近且等距离的Na+个数
与某个Cl-最近且等距离的Cl-个数
都是12个
1.每个晶胞含铯离子、氯离子的个数:
Cs+:_______,Cl- :________;
1个
1个
2. CsCl晶体中阴、阳离子配位数:
Cs+配位数:_____,Cl- 配位数:_____;
8
8
3.与Cs+等距离且最近的Cs+ 有:_____个。
6
(2)氯化铯型晶胞
CsCl晶胞
1.Ca2+在大立方体的________和 _______, 8个F-在大立方体内构成一个 __________;
2.每个晶胞含Ca2+ 、 F-的个数:
Ca2+:_______F- :________;
3.CaF2晶体中阴、阳离子配位数:
Ca2+配位数:_____,F- 配位数:_____;
4.每个F-周围与距离最近的Ca2+在空间构成的几何构型为____________。
顶角
面心
小立方体
4个
8个
8
4
正四面体
(3)CaF2型晶胞
Ca2+配位数:8
配位多面体:立方体
—Ca2+
—F-
CaF2晶体结构
F- 配位数:4
配位多面体:正四面体
思考:同为离子晶体,为什么NaCl和CsCl的晶胞结构不相同?
CsCl晶胞
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
6
6
8
8
离子晶体中不同离子周围异电性离子数目的多少主要取决于阴、阳离子的相对大小。
r+r?越大,配位数越大
?
1.没有单个分子存在;“NaCl” 不表示分子式。
2.熔沸点较高,硬度较大而脆,难挥发、难压缩;
3.一般易溶于极性溶剂(如水),而难溶于非极性溶剂;
4.固态不导电,水溶液或者熔融状态下能导电。
四、离子晶体的特点
1.正误判断
(1)活泼金属元素与活泼非金属元素之间一定形成离子键 ( )
(2)含有阳离子的晶体一定是离子晶体 ( )
(3)离子晶体有固定的配位数,说明离子键有饱和性 ( )
(4)金属晶体与离子晶体的导电原理相同 ( )
×
×
×
×
课堂练习
2.下列关于离子键的说法中错误的是 ( )
A.离子键没有方向性和饱和性
B.非金属元素组成的物质也可以含离子键
C.形成离子键时离子间的静电作用包括静电吸引和静电排斥
D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子
D
3.具有下列电子排布的原子中最难形成离子键的是 ( )
A.1s22s22p2 B.1s22s22p5
C.1s22s22p63s2 D.1s22s22p63s1
A
4.MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是 ( )
A.MgO>Rb2O>BaO>CaO B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O D.CaO>BaO>Rb2O>MgO
B
5.下列性质适合于离子晶体的是 ( )
A.熔点1 070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
A
本节内容结束
