2023春化学苏教版选择性必修二 3.3.2 共价键键能 共价晶体 课件(共47张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 3.3.2 共价键键能 共价晶体 课件(共47张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 820.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 15:00:34 | ||
图片预览









文档简介
(共47张PPT)
专题3 微粒间作用力与物质性质 第三单元 共价键 共价晶体
第2课时 共价键键能 共价晶体
学习目标
1.知道键能、键长可以用来描述键的强弱,认识键能与反应热的关系。
2.能借助共价晶体的模型认识晶体的结构特点
3.借助共价晶体模型说明晶体中的微粒及其微粒间的相互作用。
宏观辨识与微观探析:
辨识共价晶体,微观认识其晶体结构特点。
证据推理与模型认知:
构建共价键模型,并能用模型认识共价键的结构特点,说明晶体中的微粒及其微粒间的相互作用。
核心素养
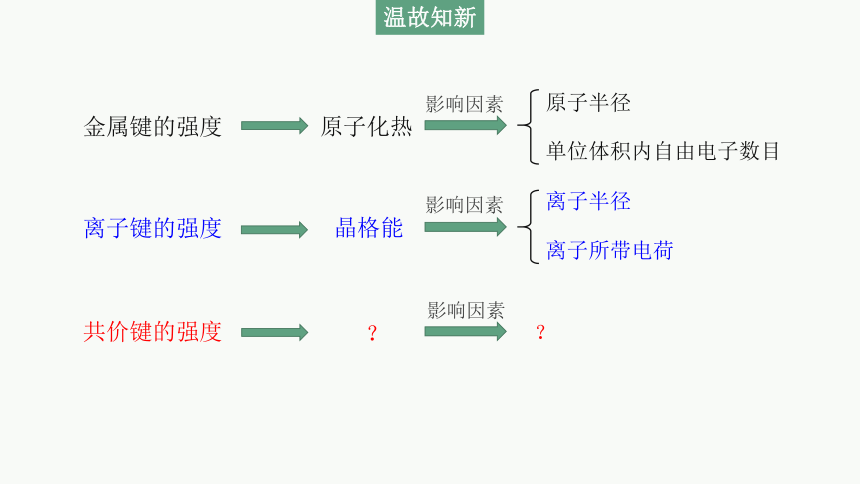
金属键的强度
离子键的强度
共价键的强度
原子化热
晶格能
?
影响因素
原子半径
单位体积内自由电子数目
离子半径
离子所带电荷
影响因素
影响因素
?
温故知新
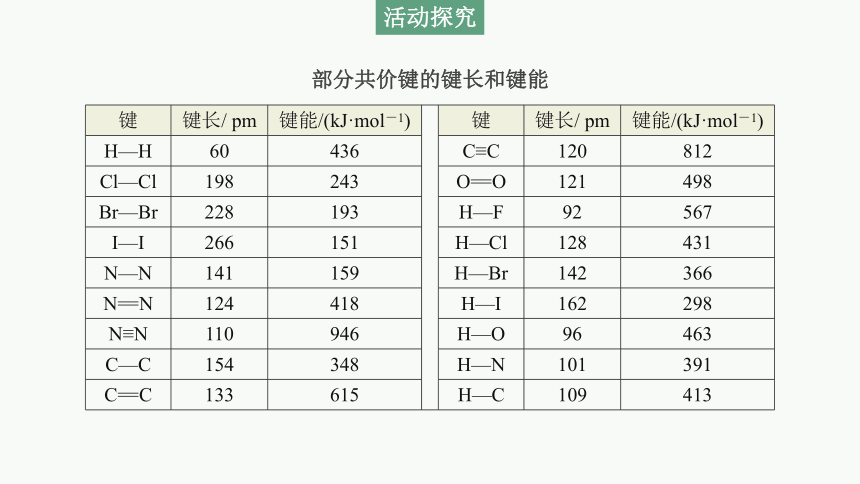
部分共价键的键长和键能
键 键长/ pm 键能/(kJ·mol-1) 键 键长/ pm 键能/(kJ·mol-1)
H—H 60 436 C≡C 120 812
Cl—Cl 198 243 O==O 121 498
Br—Br 228 193 H—F 92 567
I—I 266 151 H—Cl 128 431
N—N 141 159 H—Br 142 366
N==N 124 418 H—I 162 298
N≡N 110 946 H—O 96 463
C—C 154 348 H—N 101 391
C==C 133 615 H—C 109 413
活动探究
1.根据键能的概念,利用表中的数据,归纳键能与键长的关系。
提示:共价键的键能越大,键长越短。
2.1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl (g),放出183 kJ的热。请你利用表中的数据,讨论该反应过程中的能量变化,并总结化学键的键能与化学反应过程中能量变化的关系。
提示:1 mol H2(g)和1 mol Cl2(g)断键吸收的总能量为(436+243)kJ=679 kJ,形成2 mol HCl(g),化学键释放的总能量为431 kJ×2=862 kJ,(862-679)kJ=183 kJ,故1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl(g)放出183 kJ的热。
化学反应中旧化学键断裂所吸收的总能量大于新化学键形成放出的总能量,该化学反应为吸热反应;反之,该反应为放热反应。
1.根据表中的数据计算化学反应N2(g)+3H2(g) 2NH3(g)中的能量变化ΔH,并总结运用键能计算ΔH的公式。
提示:ΔH=(946 kJ·mol-1+436 kJ·mol-1×3)-6×391 kJ·mol-1=-92 kJ·mol-1。
ΔH=反应物的键能总和-生成物的键能总和。
2.利用表中卤化氢键能的数据比较卤化氢分子的稳定性。
提示:键能越大,卤化氢分子越稳定。故卤化氢稳定性由强到弱的顺序为HF>HCl>HBr>HI。
[思考交流]
(1)键能:在101 kPa、298 K条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,称为AB间共价键的键能。键能越大,共价键越牢固,含有该键的分子越稳定。
(2)键长:两原子间形成共价键时,两原子核间的平均间距。共价键键长越短,键越牢固。
一、共价键键能与化学反应的反应热
归纳总结
1.键能、键长
(1)反应物和生成物中化学键的强弱直接决定着化学反应过程中的能量变化。
(2)化学反应的实质是旧化学键的断裂和新化学键的形成。如果化学反应中旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,该反应为吸热反应。反之,该反应为放热反应。
(3)由键能计算化学反应的反应热
ΔH=反应物的键能总和-生成物的键能总和。
2.键能与反应热的关系
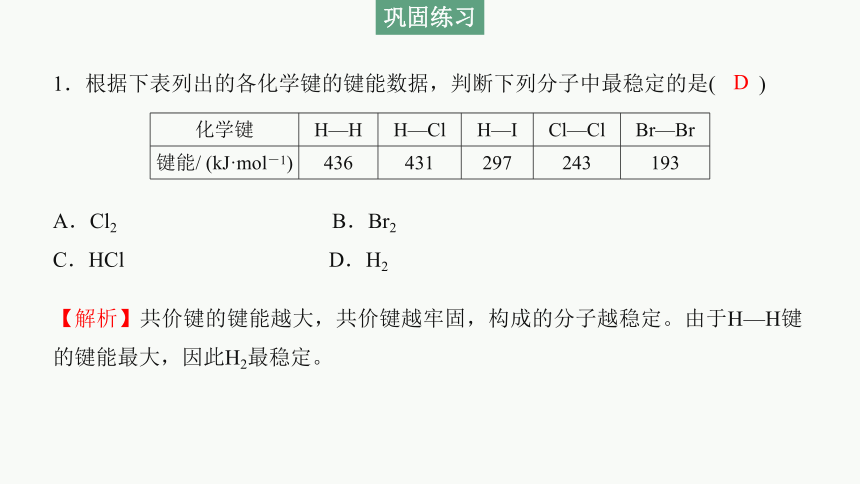
1.根据下表列出的各化学键的键能数据,判断下列分子中最稳定的是( )
化学键 H—H H—Cl H—I Cl—Cl Br—Br
键能/ (kJ·mol-1) 436 431 297 243 193
A.Cl2 B.Br2
C.HCl D.H2
【解析】共价键的键能越大,共价键越牢固,构成的分子越稳定。由于H—H键的键能最大,因此H2最稳定。
巩固练习
D
2.已知H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,则N≡N键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.869 kJ·mol-1
【解析】据ΔH=反应物的键能总和-生成物的键能总和可知:E(N≡N)+3E(H—H)-6E(H—N)=ΔH,则,E(N≡N)+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,解得E(N≡N)=946 kJ·mol-1。
B
金刚石具有很高的熔点和很大的硬度,请结合金刚石晶体的结构示意图进行解释。
提示:金刚石晶体中碳原子之间通过共价键结合而形成空间网状结构,由于C—C键的键长短,键能大,故金刚石的熔点很高,硬度很大。
活动探究
金刚石
金刚石钻头
金刚石晶体的结构示意图
金刚石晶胞
部分共价晶体的键能、键长、熔点和硬度
共价晶体 键能/(kJ·mol-1) 键长/ pm 熔点/℃ 摩氏硬度
金刚石 (C—C) 348 154 3 500 ℃以上 10
碳化硅 (C—Si) 301 184 2 600 9
晶体硅 (Si—Si) 226 234 1 415 7
1.根据表中的数据分析晶体硅(Si)和金刚砂(SiC)熔点,硬度的大小与其结构之间的关系。
提示:对于结构相似的共价晶体而言,共价键的键长越长,键能越小,晶体的熔点越低,硬度越小。
2.氮化硼是一种超硬、耐磨、耐高温的新型材料,请你判断氮化硼属于哪种晶体?
提示:共价晶体。
[思考交流]
1.概念
相邻原子间以共价键结合而形成的具有空间网状结构的晶体。
2.结构
二、共价晶体
归纳总结
(一)共价晶体
3.结构特点
(1)由于共价键的饱和性和方向性,使每个中心原子周围排列的原子数目是固定的。
(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
1.键能
C—C>C—Si>Si—Si;熔点:金刚石>碳化硅>晶体硅;硬度:金刚石>碳化硅>晶体硅。
2.规律
共价晶体具有很高的熔点,很大的硬度;对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
(二)共价晶体的性质
(1)共价晶体的构成微粒是原子,只存在共价键,不存在其他作用力。
(2)共价晶体的化学式表示其比例组成,晶体中不存在分子。
(3)常见的共价晶体有:金刚石、晶体硅、晶体硼、二氧化硅、碳化硅。
(4)共价晶体一般具有熔点高、硬度大、不溶于溶剂等特点。
[名师点拨]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)共价晶体中一定存在极性键 ( )
(2)CO2、SiO2均属于共价晶体 ( )
(3)硬度很大、熔点很高的晶体可能是共价晶体 ( )
(4)SiC熔化时断裂非极性共价键 ( )
(5)共价晶体一定不是电解质 ( )
巩固练习
×
×
×
√
√
2.下列属于共价晶体的化合物的是( )
A.晶体硅 B.H3PO4
C.金刚石 D.SiO2
【解析】A项,晶体硅是单质,错误;B项,H3PO4不是共价晶体,错误;C项,金刚石是单质,错误;D项,SiO2是共价晶体,且属于化合物,正确。
D
金刚石晶体结构中,C—C键的键长为0.154 nm,键角为109°28′,键能为348 kJ·mol-1。
(1)每个碳原子与周围紧邻的____个碳原子以共价键结合成____________结构,向空间伸展形成空间网状结构。
(2)最小碳环由____个碳原子组成,且最小环上碳原子不在同一平面内,形成立体的六元环状结构。每个碳原子参与的六元环数为12,则最小碳环实际占有的碳原子数为________。
正四面体
6
活动探究
4
1.在金刚石晶体结构中,碳原子数与C—C键数之比是多少?
提示:1∶2。
2.在金刚石晶胞中含有几个碳原子?
提示:8个。
[思考交流]
(1)金刚石
在晶体中,碳原子与周围4个原子以共价键相结合,C—C键间的夹角为109°28′。
(2)碳化硅晶体
碳化硅晶体与金刚石晶体结构相似,其空间结构中碳原子和硅原子交替排列,所以在整个晶体中碳原子和硅原子的个数之比为1∶1。
三、常见共价晶体结构
归纳总结
典型的共价晶体
(3)晶体硅
若以硅原子代替金刚石晶体结构中的碳原子,便可得到晶体硅的结构,晶体硅中的硅原子,与其他4个硅原子以共价键结合。不同的是Si—Si键键长>C—C键键长。
(4)二氧化硅
①在二氧化硅晶体里,硅原子和氧原子交替排列,1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键。
②每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点,则每个正四面体占有1个完整的硅原子、2个氧原子。因此,二氧化硅晶体中硅原子和氧原子的个数之比为
1∶(4×)=1∶2,化学式为SiO2。
③在SiO2晶体中,最小的环为6个硅原子和6个氧原子组成的十二元环。
④n mol SiO2晶体中,Si—O键为4n mol,即1 mol Si可以形成4 mol Si—O键。
⑤在SiO2晶体中,每个最小的环实际拥有的硅原子数为6×=,氧原子数为6×=1。
1.二氧化硅晶体是空间网状结构,其晶体模型如图所示。下列有关二氧化硅晶体的说法正确的是( )
A.二氧化硅晶体最小环上含有12个原子
B.每个硅原子为4个最小环所共有
C.从晶体结构可知,1 mol SiO2拥有2 mol Si—O键
D.SiO2晶体是由极性共价键与非极性共价键共同构成的
巩固练习
A
【解析】二氧化硅晶体和金刚石晶体的结构类似,每个硅原子为12个最小环共有,B项错误;1个Si与4个O形成Si—O键,则1 mol SiO2拥有4 mol Si—O键,C项错误;SiO2晶体中只含极性共价键,不含非极性共价键,D项错误。
A.β- 氮化碳属于共价晶体,其化学键比金刚石的更稳定
B.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
C.β -氮化碳的化学式为C3N4,其中氮显-3价,碳显+4价
D.该晶体与金刚石结构相似,都是原子间以非极性键结合形成的空间网状结构
2.氮化碳部分结构如图所示,其中β -氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法错误的是( )
D
【解析】A项,N原子半径小于C原子,键长:C—N键边上的C原子被2个正方形所共有,故实际含有的C原子数为4×+4×=3,N
原子数为4,化学式为C3N4,因为N元素的电负性比C元素的大,故N显负价(-3 价),C显正价(+4 价),正确;D项,金刚石晶体中只含C—C非极性键,C3N4晶体中只含C—N极性键,错误。
1.已知下列化学键的键能:
化学键 C—C N—N O—O O—H S—H Se—H N—H As—H
键能/ (kJ·mol-1) 347 160 142 467 347 276 391 247
回答下列问题:
(1)O—H键、S—H键、Se—H键的键能逐渐减小,原因是____________________,
据此可推测P—H键的键能范围为________<EP—H<________。
提示:O、S、Se位于同一主族,原子半径逐渐增大,导致O—H键、S—H键、Se—H键的键长依次增大,键长越大,键能越小,所以O—H键、S—H键、Se—H键的键能依次减小。N、P、As位于同一主族,原子半径逐渐增大,导致N—H键、P—H键、As—H键的键能依次减小,所以键能:EAs—H<EP—H能力提升
EAs—H
EN—H
(2)有机化合物是以碳骨架为基础的化合物,即碳原子间易形成C—C长链,而氮原子与氮原子间,氧原子与氧原子间难形成N—N长链和O—O长链,原因是_________________________________________________________________________________________________________________________________________。
提示:键能越大,化学键越牢固,越不容易断裂,分子越稳定,结合表中数据分析解答。
C—C的键能较大,较稳定,因而易形成C—C长链,而N—N、O—O的键能小,不稳定、易断裂,因此难以形成N—N、O—O长链
2.单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
熔点/K 大于3 823 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
晶体硼的晶体类型属于__________晶体,理由是___________________________。
提示:从题表可知,晶体硼的熔、沸点以及硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,在元素周期表中B与C相邻、与Si处于对角线位置,则晶体硼也属于共价晶体。理由是晶体硼的熔、沸点高,硬度大。
共价晶体
晶体硼的熔、沸点高,硬度大
1.共价键键长越短,键能越大,键越牢固,形成的物质越稳定。
2.分析时结合问题,对比分析题给数据,联想相关规律,归纳得出结论。
3.可由晶体的物理性质判断其晶体类型,一般来说,若晶体的熔、沸点很高,硬度很大,其晶体类型为共价晶体。
4.组成共价晶体的元素通常是元素周期表中金属元素与非金属元素分界线附近的B、C、N、Al、Si、Ge等元素。绝大多数新型无机非金属材料(如新型陶瓷)都具有熔点高、硬度大、耐酸碱腐蚀、抗氧化、耐磨损等优点,它们一般都属于共价晶体,如SiC、Si3N4等。
归纳总结
1.下表是一些键能数据(kJ·mol-1):
回答下列问题。
(1)由表中数据能否得出下列结论:
①半径越小的原子形成的共价键越牢固(即键能越大),______(填“能”或“不能”);
②非金属性越强的原子形成的共价键越牢固,________(填“能”或“不能”)。能否从数据中找出一些规律,请写出一条:____________________________________
______________________________________________________________________。
试预测C—Br键的键能范围:____________举一反三
不能
不能
与相同原子结合时同主族元素原子形成的共价键,原子半径越小,共价键越牢固
216 kJ·mol-1
339 kJ·mol-1
(2)由热化学方程式H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是____________________________________________________________________;
由热化学方程式2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ·mol-1和表中数值可计算出1 mol S2(s)变为S2(g)时将________(填“吸收”或“放出”)________kJ的热量。
化学反应的反应热等于反应物的键能总和与生成物的键能总和的差
吸收
36.5
【解析】(1)①共价键的键能与原子的半径和原子对共用电子对的吸引能力(非金属性)等有关,同类型的共价键的键能可以进行比较,不同类型的不能直接进行比较;②由于C—F键、C—Cl键、C—Br键和C—I键的类型相似,可以通过原子半径和非金属性进行比较,F、Cl、Br、I的原子半径依次增大,非金属性逐渐减弱,所以它们对共用电子对的吸引能力依次减弱,故C—X(X表示卤素原子)键的键能依次减小。(2)化学反应的实质是旧化学键的断裂与新化学键的形成的过程。化学键的断裂要吸收热量,形成新化学键要放出热量,从而可以得出它们之间的关系。根据键能可以计算S2(g)+2H2(g)===2H2S(g)的反应热:ΔH=2×436 kJ·mol-1+255 kJ·mol-1-4×347 kJ·mol-1=-261 kJ·mol-1。结合已知热化学方程式知,1 mol S2(s)转化为S2(g)需要吸收36.5 kJ热量。
2.金刚砂(SiC)的硬度为9,其晶胞结构如图所示,则金刚砂的晶体类型为__________;在SiC中,每个Si原子周围距离最近且相等的Si原子数为________;
【解析】金刚砂(SiC)的硬度为9,硬度大,属于共价晶体;由晶胞结构可知,Si原子位于顶点和面上,则每个Si原子周围距离最近且相等的Si原子数为12。
共价晶体
12
1.根据键能数据:EH—Cl=431 kJ·mol-1,EH—I=297 kJ·mol-1,可得出的结论正确的是( )
A.H—I键的键长大于H—Cl键的键长
B.HI比HCl的熔、沸点高
C.HI比HCl稳定
D.断裂等物质的量的HI和HCl中的化学键,HI消耗的能量多
当堂检测
A
【解析】HI、HCl的熔、沸点为物理性质,与化学键的强弱无关,故B项错误;化学键的键能越大,化学键越牢固,H—Cl键的键能大于H—I键的键能,说明HCl比HI稳定,故C项错误;H—Cl键的键能大于H—I键的键能,断裂等物质的量的HI和HCl中的化学键时,HCl消耗的能量多,故D项错误。
2.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
【解析】由于N2分子中存在N≡N键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I原子半径逐渐增大,其氢化物中的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱;由于H—F键的键能大于H—O键的键能,所以更容易生成HF。
3.有关共价晶体的叙述,错误的是( )
A.共价晶体中,原子不遵循紧密堆积原理
B.共价晶体的熔点高于所有金属晶体
C.共价晶体中不存在独立的分子
D.共价晶体熔化时要破坏共价键
B
【解析】共价晶体中原子不遵循紧密堆积原理,A项正确;共价晶体中不存在独立的分子,C项正确;共价晶体熔化时要破坏共价键,D项正确;B项,金属钨的熔点为3 410 ℃,而晶体硅的熔点为1 415 ℃,B项错误。
4.下表是某些共价晶体的熔点和硬度。
共价晶体 金刚石 氮化硼 碳化硅 石英 晶体硅 晶体锗
熔点/ ℃ 大于3 500 3 000 2 830 1 710 1 412 1 211
硬度 10 9.5 9 7 7 6.0
分析表中的数据,下列叙述正确的是( )
A.构成共价晶体的原子种类越多,晶体的熔点越高
B.构成共价晶体的原子间的共价键键能越大,晶体的熔点越低
C.构成共价晶体的原子的半径越大,晶体的硬度越大
D.构成共价晶体的原子的半径越小,晶体的硬度越大
D
【解析】共价晶体的熔点和硬度与构成共价晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关。即原子半径越小,键能越大,共价晶体的熔点越高,硬度越大。
5.F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应:Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为_____ kJ·mol-1。
【解析】设Cl—F键的平均键能为a kJ·mol-1,则159 kJ·mol-1×3+242 kJ·mol-1-6a kJ·mol-1=-313 kJ·mol-1,解得a=172。
172
6.已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由______个硼原子构成,其中B—B键的键角为________,B—B键的数目为________。
12
60°
30
【解析】每个三角形的顶点为5个三角形所共有,此顶点完全属于一个三角形的只有,每个三角形有3个这样的顶点,且晶体的基本单元中有20个这样的三角形,故有B原子的个数为3××20=12,又因为三角形为正三角形,所以键角为60°,每个边为2个三角形共用,所以边数(B—B键数)为20×3×=30。
本节内容结束
专题3 微粒间作用力与物质性质 第三单元 共价键 共价晶体
第2课时 共价键键能 共价晶体
学习目标
1.知道键能、键长可以用来描述键的强弱,认识键能与反应热的关系。
2.能借助共价晶体的模型认识晶体的结构特点
3.借助共价晶体模型说明晶体中的微粒及其微粒间的相互作用。
宏观辨识与微观探析:
辨识共价晶体,微观认识其晶体结构特点。
证据推理与模型认知:
构建共价键模型,并能用模型认识共价键的结构特点,说明晶体中的微粒及其微粒间的相互作用。
核心素养
金属键的强度
离子键的强度
共价键的强度
原子化热
晶格能
?
影响因素
原子半径
单位体积内自由电子数目
离子半径
离子所带电荷
影响因素
影响因素
?
温故知新
部分共价键的键长和键能
键 键长/ pm 键能/(kJ·mol-1) 键 键长/ pm 键能/(kJ·mol-1)
H—H 60 436 C≡C 120 812
Cl—Cl 198 243 O==O 121 498
Br—Br 228 193 H—F 92 567
I—I 266 151 H—Cl 128 431
N—N 141 159 H—Br 142 366
N==N 124 418 H—I 162 298
N≡N 110 946 H—O 96 463
C—C 154 348 H—N 101 391
C==C 133 615 H—C 109 413
活动探究
1.根据键能的概念,利用表中的数据,归纳键能与键长的关系。
提示:共价键的键能越大,键长越短。
2.1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl (g),放出183 kJ的热。请你利用表中的数据,讨论该反应过程中的能量变化,并总结化学键的键能与化学反应过程中能量变化的关系。
提示:1 mol H2(g)和1 mol Cl2(g)断键吸收的总能量为(436+243)kJ=679 kJ,形成2 mol HCl(g),化学键释放的总能量为431 kJ×2=862 kJ,(862-679)kJ=183 kJ,故1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl(g)放出183 kJ的热。
化学反应中旧化学键断裂所吸收的总能量大于新化学键形成放出的总能量,该化学反应为吸热反应;反之,该反应为放热反应。
1.根据表中的数据计算化学反应N2(g)+3H2(g) 2NH3(g)中的能量变化ΔH,并总结运用键能计算ΔH的公式。
提示:ΔH=(946 kJ·mol-1+436 kJ·mol-1×3)-6×391 kJ·mol-1=-92 kJ·mol-1。
ΔH=反应物的键能总和-生成物的键能总和。
2.利用表中卤化氢键能的数据比较卤化氢分子的稳定性。
提示:键能越大,卤化氢分子越稳定。故卤化氢稳定性由强到弱的顺序为HF>HCl>HBr>HI。
[思考交流]
(1)键能:在101 kPa、298 K条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,称为AB间共价键的键能。键能越大,共价键越牢固,含有该键的分子越稳定。
(2)键长:两原子间形成共价键时,两原子核间的平均间距。共价键键长越短,键越牢固。
一、共价键键能与化学反应的反应热
归纳总结
1.键能、键长
(1)反应物和生成物中化学键的强弱直接决定着化学反应过程中的能量变化。
(2)化学反应的实质是旧化学键的断裂和新化学键的形成。如果化学反应中旧化学键断裂所吸收的总能量大于新化学键形成所放出的总能量,该反应为吸热反应。反之,该反应为放热反应。
(3)由键能计算化学反应的反应热
ΔH=反应物的键能总和-生成物的键能总和。
2.键能与反应热的关系
1.根据下表列出的各化学键的键能数据,判断下列分子中最稳定的是( )
化学键 H—H H—Cl H—I Cl—Cl Br—Br
键能/ (kJ·mol-1) 436 431 297 243 193
A.Cl2 B.Br2
C.HCl D.H2
【解析】共价键的键能越大,共价键越牢固,构成的分子越稳定。由于H—H键的键能最大,因此H2最稳定。
巩固练习
D
2.已知H—H键的键能为436 kJ·mol-1,H—N键的键能为391 kJ·mol-1,根据热化学方程式N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,则N≡N键的键能是( )
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.869 kJ·mol-1
【解析】据ΔH=反应物的键能总和-生成物的键能总和可知:E(N≡N)+3E(H—H)-6E(H—N)=ΔH,则,E(N≡N)+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1,解得E(N≡N)=946 kJ·mol-1。
B
金刚石具有很高的熔点和很大的硬度,请结合金刚石晶体的结构示意图进行解释。
提示:金刚石晶体中碳原子之间通过共价键结合而形成空间网状结构,由于C—C键的键长短,键能大,故金刚石的熔点很高,硬度很大。
活动探究
金刚石
金刚石钻头
金刚石晶体的结构示意图
金刚石晶胞
部分共价晶体的键能、键长、熔点和硬度
共价晶体 键能/(kJ·mol-1) 键长/ pm 熔点/℃ 摩氏硬度
金刚石 (C—C) 348 154 3 500 ℃以上 10
碳化硅 (C—Si) 301 184 2 600 9
晶体硅 (Si—Si) 226 234 1 415 7
1.根据表中的数据分析晶体硅(Si)和金刚砂(SiC)熔点,硬度的大小与其结构之间的关系。
提示:对于结构相似的共价晶体而言,共价键的键长越长,键能越小,晶体的熔点越低,硬度越小。
2.氮化硼是一种超硬、耐磨、耐高温的新型材料,请你判断氮化硼属于哪种晶体?
提示:共价晶体。
[思考交流]
1.概念
相邻原子间以共价键结合而形成的具有空间网状结构的晶体。
2.结构
二、共价晶体
归纳总结
(一)共价晶体
3.结构特点
(1)由于共价键的饱和性和方向性,使每个中心原子周围排列的原子数目是固定的。
(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
1.键能
C—C>C—Si>Si—Si;熔点:金刚石>碳化硅>晶体硅;硬度:金刚石>碳化硅>晶体硅。
2.规律
共价晶体具有很高的熔点,很大的硬度;对结构相似的共价晶体来说,原子半径越小,键长越短,键能越大,晶体的熔点就越高。
(二)共价晶体的性质
(1)共价晶体的构成微粒是原子,只存在共价键,不存在其他作用力。
(2)共价晶体的化学式表示其比例组成,晶体中不存在分子。
(3)常见的共价晶体有:金刚石、晶体硅、晶体硼、二氧化硅、碳化硅。
(4)共价晶体一般具有熔点高、硬度大、不溶于溶剂等特点。
[名师点拨]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)共价晶体中一定存在极性键 ( )
(2)CO2、SiO2均属于共价晶体 ( )
(3)硬度很大、熔点很高的晶体可能是共价晶体 ( )
(4)SiC熔化时断裂非极性共价键 ( )
(5)共价晶体一定不是电解质 ( )
巩固练习
×
×
×
√
√
2.下列属于共价晶体的化合物的是( )
A.晶体硅 B.H3PO4
C.金刚石 D.SiO2
【解析】A项,晶体硅是单质,错误;B项,H3PO4不是共价晶体,错误;C项,金刚石是单质,错误;D项,SiO2是共价晶体,且属于化合物,正确。
D
金刚石晶体结构中,C—C键的键长为0.154 nm,键角为109°28′,键能为348 kJ·mol-1。
(1)每个碳原子与周围紧邻的____个碳原子以共价键结合成____________结构,向空间伸展形成空间网状结构。
(2)最小碳环由____个碳原子组成,且最小环上碳原子不在同一平面内,形成立体的六元环状结构。每个碳原子参与的六元环数为12,则最小碳环实际占有的碳原子数为________。
正四面体
6
活动探究
4
1.在金刚石晶体结构中,碳原子数与C—C键数之比是多少?
提示:1∶2。
2.在金刚石晶胞中含有几个碳原子?
提示:8个。
[思考交流]
(1)金刚石
在晶体中,碳原子与周围4个原子以共价键相结合,C—C键间的夹角为109°28′。
(2)碳化硅晶体
碳化硅晶体与金刚石晶体结构相似,其空间结构中碳原子和硅原子交替排列,所以在整个晶体中碳原子和硅原子的个数之比为1∶1。
三、常见共价晶体结构
归纳总结
典型的共价晶体
(3)晶体硅
若以硅原子代替金刚石晶体结构中的碳原子,便可得到晶体硅的结构,晶体硅中的硅原子,与其他4个硅原子以共价键结合。不同的是Si—Si键键长>C—C键键长。
(4)二氧化硅
①在二氧化硅晶体里,硅原子和氧原子交替排列,1个硅原子与4个氧原子形成4个共价键,每个氧原子与2个硅原子形成2个共价键。
②每个硅原子与相邻的4个氧原子以共价键相结合构成正四面体结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点,则每个正四面体占有1个完整的硅原子、2个氧原子。因此,二氧化硅晶体中硅原子和氧原子的个数之比为
1∶(4×)=1∶2,化学式为SiO2。
③在SiO2晶体中,最小的环为6个硅原子和6个氧原子组成的十二元环。
④n mol SiO2晶体中,Si—O键为4n mol,即1 mol Si可以形成4 mol Si—O键。
⑤在SiO2晶体中,每个最小的环实际拥有的硅原子数为6×=,氧原子数为6×=1。
1.二氧化硅晶体是空间网状结构,其晶体模型如图所示。下列有关二氧化硅晶体的说法正确的是( )
A.二氧化硅晶体最小环上含有12个原子
B.每个硅原子为4个最小环所共有
C.从晶体结构可知,1 mol SiO2拥有2 mol Si—O键
D.SiO2晶体是由极性共价键与非极性共价键共同构成的
巩固练习
A
【解析】二氧化硅晶体和金刚石晶体的结构类似,每个硅原子为12个最小环共有,B项错误;1个Si与4个O形成Si—O键,则1 mol SiO2拥有4 mol Si—O键,C项错误;SiO2晶体中只含极性共价键,不含非极性共价键,D项错误。
A.β- 氮化碳属于共价晶体,其化学键比金刚石的更稳定
B.该晶体中碳原子和氮原子的最外层都满足8电子稳定结构
C.β -氮化碳的化学式为C3N4,其中氮显-3价,碳显+4价
D.该晶体与金刚石结构相似,都是原子间以非极性键结合形成的空间网状结构
2.氮化碳部分结构如图所示,其中β -氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法错误的是( )
D
【解析】A项,N原子半径小于C原子,键长:C—N键
原子数为4,化学式为C3N4,因为N元素的电负性比C元素的大,故N显负价(-3 价),C显正价(+4 价),正确;D项,金刚石晶体中只含C—C非极性键,C3N4晶体中只含C—N极性键,错误。
1.已知下列化学键的键能:
化学键 C—C N—N O—O O—H S—H Se—H N—H As—H
键能/ (kJ·mol-1) 347 160 142 467 347 276 391 247
回答下列问题:
(1)O—H键、S—H键、Se—H键的键能逐渐减小,原因是____________________,
据此可推测P—H键的键能范围为________<EP—H<________。
提示:O、S、Se位于同一主族,原子半径逐渐增大,导致O—H键、S—H键、Se—H键的键长依次增大,键长越大,键能越小,所以O—H键、S—H键、Se—H键的键能依次减小。N、P、As位于同一主族,原子半径逐渐增大,导致N—H键、P—H键、As—H键的键能依次减小,所以键能:EAs—H<EP—H
EAs—H
EN—H
(2)有机化合物是以碳骨架为基础的化合物,即碳原子间易形成C—C长链,而氮原子与氮原子间,氧原子与氧原子间难形成N—N长链和O—O长链,原因是_________________________________________________________________________________________________________________________________________。
提示:键能越大,化学键越牢固,越不容易断裂,分子越稳定,结合表中数据分析解答。
C—C的键能较大,较稳定,因而易形成C—C长链,而N—N、O—O的键能小,不稳定、易断裂,因此难以形成N—N、O—O长链
2.单质硼有无定型和晶体两种,参考下表数据,回答下列问题:
物质 金刚石 晶体硅 晶体硼
熔点/K 大于3 823 1 683 2 573
沸点/K 5 100 2 628 2 823
硬度/Mob 10 7.0 9.5
晶体硼的晶体类型属于__________晶体,理由是___________________________。
提示:从题表可知,晶体硼的熔、沸点以及硬度都介于晶体硅和金刚石之间,而金刚石和晶体硅均为共价晶体,在元素周期表中B与C相邻、与Si处于对角线位置,则晶体硼也属于共价晶体。理由是晶体硼的熔、沸点高,硬度大。
共价晶体
晶体硼的熔、沸点高,硬度大
1.共价键键长越短,键能越大,键越牢固,形成的物质越稳定。
2.分析时结合问题,对比分析题给数据,联想相关规律,归纳得出结论。
3.可由晶体的物理性质判断其晶体类型,一般来说,若晶体的熔、沸点很高,硬度很大,其晶体类型为共价晶体。
4.组成共价晶体的元素通常是元素周期表中金属元素与非金属元素分界线附近的B、C、N、Al、Si、Ge等元素。绝大多数新型无机非金属材料(如新型陶瓷)都具有熔点高、硬度大、耐酸碱腐蚀、抗氧化、耐磨损等优点,它们一般都属于共价晶体,如SiC、Si3N4等。
归纳总结
1.下表是一些键能数据(kJ·mol-1):
回答下列问题。
(1)由表中数据能否得出下列结论:
①半径越小的原子形成的共价键越牢固(即键能越大),______(填“能”或“不能”);
②非金属性越强的原子形成的共价键越牢固,________(填“能”或“不能”)。能否从数据中找出一些规律,请写出一条:____________________________________
______________________________________________________________________。
试预测C—Br键的键能范围:____________
不能
不能
与相同原子结合时同主族元素原子形成的共价键,原子半径越小,共价键越牢固
216 kJ·mol-1
339 kJ·mol-1
(2)由热化学方程式H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1并结合上表数据可推知一个化学反应的反应热(设反应物和生成物均为气态)与反应物和生成物的键能之间的关系是____________________________________________________________________;
由热化学方程式2H2(g)+S2(s)===2H2S(g) ΔH=-224.5 kJ·mol-1和表中数值可计算出1 mol S2(s)变为S2(g)时将________(填“吸收”或“放出”)________kJ的热量。
化学反应的反应热等于反应物的键能总和与生成物的键能总和的差
吸收
36.5
【解析】(1)①共价键的键能与原子的半径和原子对共用电子对的吸引能力(非金属性)等有关,同类型的共价键的键能可以进行比较,不同类型的不能直接进行比较;②由于C—F键、C—Cl键、C—Br键和C—I键的类型相似,可以通过原子半径和非金属性进行比较,F、Cl、Br、I的原子半径依次增大,非金属性逐渐减弱,所以它们对共用电子对的吸引能力依次减弱,故C—X(X表示卤素原子)键的键能依次减小。(2)化学反应的实质是旧化学键的断裂与新化学键的形成的过程。化学键的断裂要吸收热量,形成新化学键要放出热量,从而可以得出它们之间的关系。根据键能可以计算S2(g)+2H2(g)===2H2S(g)的反应热:ΔH=2×436 kJ·mol-1+255 kJ·mol-1-4×347 kJ·mol-1=-261 kJ·mol-1。结合已知热化学方程式知,1 mol S2(s)转化为S2(g)需要吸收36.5 kJ热量。
2.金刚砂(SiC)的硬度为9,其晶胞结构如图所示,则金刚砂的晶体类型为__________;在SiC中,每个Si原子周围距离最近且相等的Si原子数为________;
【解析】金刚砂(SiC)的硬度为9,硬度大,属于共价晶体;由晶胞结构可知,Si原子位于顶点和面上,则每个Si原子周围距离最近且相等的Si原子数为12。
共价晶体
12
1.根据键能数据:EH—Cl=431 kJ·mol-1,EH—I=297 kJ·mol-1,可得出的结论正确的是( )
A.H—I键的键长大于H—Cl键的键长
B.HI比HCl的熔、沸点高
C.HI比HCl稳定
D.断裂等物质的量的HI和HCl中的化学键,HI消耗的能量多
当堂检测
A
【解析】HI、HCl的熔、沸点为物理性质,与化学键的强弱无关,故B项错误;化学键的键能越大,化学键越牢固,H—Cl键的键能大于H—I键的键能,说明HCl比HI稳定,故C项错误;H—Cl键的键能大于H—I键的键能,断裂等物质的量的HI和HCl中的化学键时,HCl消耗的能量多,故D项错误。
2.下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
B
【解析】由于N2分子中存在N≡N键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I原子半径逐渐增大,其氢化物中的键长逐渐变长,键能逐渐变小,所以稳定性逐渐减弱;由于H—F键的键能大于H—O键的键能,所以更容易生成HF。
3.有关共价晶体的叙述,错误的是( )
A.共价晶体中,原子不遵循紧密堆积原理
B.共价晶体的熔点高于所有金属晶体
C.共价晶体中不存在独立的分子
D.共价晶体熔化时要破坏共价键
B
【解析】共价晶体中原子不遵循紧密堆积原理,A项正确;共价晶体中不存在独立的分子,C项正确;共价晶体熔化时要破坏共价键,D项正确;B项,金属钨的熔点为3 410 ℃,而晶体硅的熔点为1 415 ℃,B项错误。
4.下表是某些共价晶体的熔点和硬度。
共价晶体 金刚石 氮化硼 碳化硅 石英 晶体硅 晶体锗
熔点/ ℃ 大于3 500 3 000 2 830 1 710 1 412 1 211
硬度 10 9.5 9 7 7 6.0
分析表中的数据,下列叙述正确的是( )
A.构成共价晶体的原子种类越多,晶体的熔点越高
B.构成共价晶体的原子间的共价键键能越大,晶体的熔点越低
C.构成共价晶体的原子的半径越大,晶体的硬度越大
D.构成共价晶体的原子的半径越小,晶体的硬度越大
D
【解析】共价晶体的熔点和硬度与构成共价晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关。即原子半径越小,键能越大,共价晶体的熔点越高,硬度越大。
5.F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应:Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为_____ kJ·mol-1。
【解析】设Cl—F键的平均键能为a kJ·mol-1,则159 kJ·mol-1×3+242 kJ·mol-1-6a kJ·mol-1=-313 kJ·mol-1,解得a=172。
172
6.已知晶体硼的基本结构单元是由硼原子组成的正二十面体,如图。其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有一个硼原子。通过观察及推算,此基本结构单元由______个硼原子构成,其中B—B键的键角为________,B—B键的数目为________。
12
60°
30
【解析】每个三角形的顶点为5个三角形所共有,此顶点完全属于一个三角形的只有,每个三角形有3个这样的顶点,且晶体的基本单元中有20个这样的三角形,故有B原子的个数为3××20=12,又因为三角形为正三角形,所以键角为60°,每个边为2个三角形共用,所以边数(B—B键数)为20×3×=30。
本节内容结束
