2023春化学苏教版选择性必修二 3.4.1 分子间作用力 课件(共26张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 3.4.1 分子间作用力 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 877.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 15:01:34 | ||
图片预览







文档简介
(共26张PPT)
专题3 微粒间作用力与物质性质 第四单元 分子间作用力 分子晶体
第1课时 分子间作用力
学习目标
认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力,了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用。
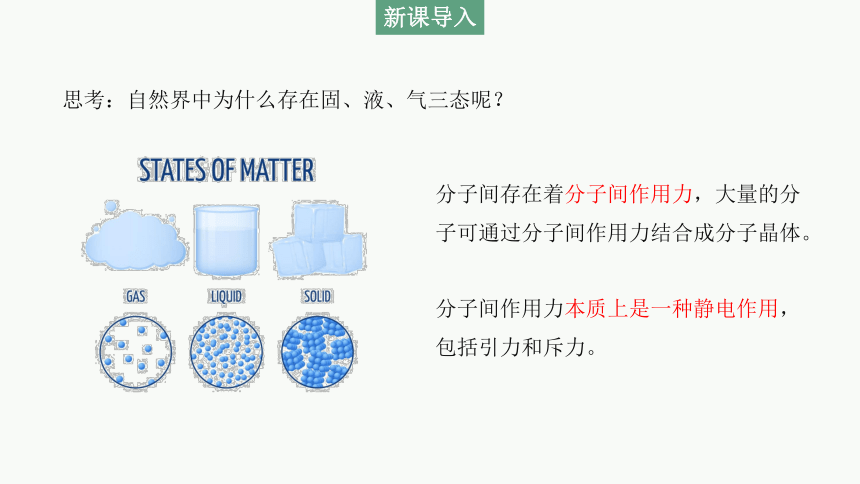
思考:自然界中为什么存在固、液、气三态呢?
分子间存在着分子间作用力,大量的分子可通过分子间作用力结合成分子晶体。
分子间作用力本质上是一种静电作用,包括引力和斥力。
新课导入
卤素单质的相对分子质量和熔、沸点
化学式 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
请根据上表中的数据探究以下问题:
(1)卤素单质的熔、沸点有怎样的变化规律?
提示:随相对分子质量的增大,卤素单质的熔、沸点依次升高。
活动探究
(2)导致卤素单质熔、沸点规律变化的原因是什么?它与卤素单质相对分子质量的变化规律有怎样的关系?
提示:卤素单质组成和结构相近,分子之间存在范德华力,相对分子质量越大,范德华力越大,相应单质的熔、沸点越高。
1.范德华力与化学键的区别?
提示:范德华力是一种分子间作用力,比化学键的键能小得多。
2.范德华力是如何影响物质性质的?
提示:范德华力主要影响物质的熔点、沸点、溶解度等物理性质。
3.影响范德华力的因素有哪些?
提示:分子的大小、分子的空间构型及分子中电荷分布是否均匀等。
[思考交流]
1.分子间作用力
概念 共价分子之间存在的静电作用
分类 常见的分子间作用力是范德华力和氢键
特点 比化学键弱得多,主要影响物质的物理性质
一、范德华力
归纳总结
概念 范德华力是一种普遍存在于固体、液体和气体中分子之间的作用力
特征 作用力比较小,且一般没有饱和性和方向性
影响因素 分子的大小、分子的空间构型及分子中电荷分布是否均匀等
对物质性质的影响 范德华力主要影响物质的物理性质,如熔点、沸点、溶解度;范德华力越大,物质的熔、沸点越高
2.范德华力
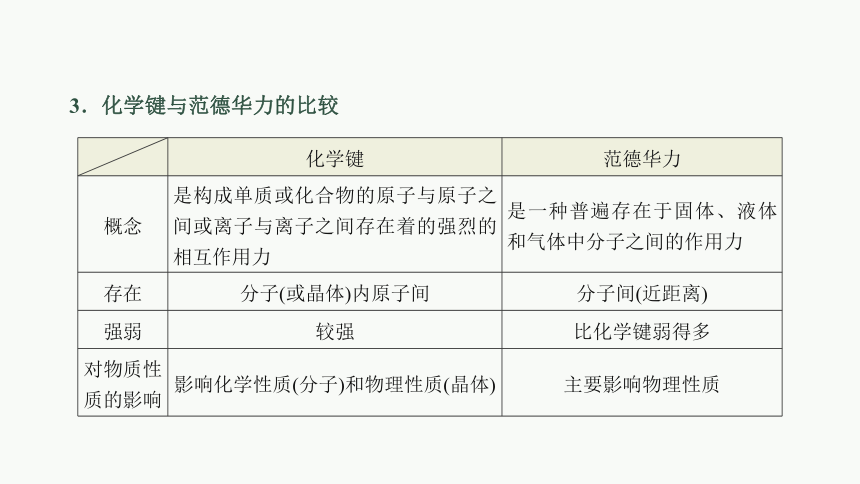
化学键 范德华力
概念 是构成单质或化合物的原子与原子之间或离子与离子之间存在着的强烈的相互作用力 是一种普遍存在于固体、液体和气体中分子之间的作用力
存在 分子(或晶体)内原子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质(分子)和物理性质(晶体) 主要影响物理性质
3.化学键与范德华力的比较
(1)离子化合物中只存在化学键,不存在范德华力。
(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
4.对范德华力存在的理解
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在的较强的静电作用
C.直接影响所有物质的熔、沸点
D.稀有气体的原子间存在范德华力
【解析】范德华力是分子间存在的较弱的相互作用,实质上是一种静电作用,比化学键弱得多,只能影响由分子构成的物质的熔、沸点;稀有气体为单原子分子,原子间存在范德华力。
巩固练习
D
2.下列叙述与范德华力无关的是( )
A.气体物质在加压或降温时能凝结或凝固
B.干冰易于升华
C.氟、氯、溴、碘单质的熔点、沸点依次升高
D.氯化钠的熔点较高
【解析】一般来说,由分子构成的物质,其物理性质通常与范德华力的大小密切相关,A、B、C三个选项中涉及的物质都是由分子构成,故其表现的物理性质与范德华力的大小有关系;只有D选项中的NaCl是离子化合物,不存在分子,故其物理性质与范德华力无关。
D
氧和硫同为ⅥA族元素,H2O和H2S的结构也很相似。从相对分子质量对分子间作用力和物质性质影响的角度分析,应该是H2S的沸点高于H2O,但通常情况下,H2O是液体(沸点为100 ℃),H2S是气体(沸点为-61 ℃)。你知道导致H2O沸点“反常”的原因吗?
提示:H2O分子之间存在氢键。
活动探究
1.分析氢键的形成条件及表示方法。
提示:H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键。氢键通常用X—H…Y表示,其中X和Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮等。
2.虽然HF分子间氢键比H2O分子间氢键更强,但液体氟化氢的蒸发热却比水的蒸发热低,试解释其原因。
提示:每个HF分子最多与周围的HF分子形成2个氢键,而每个H2O分子最多可与周围的H2O分子形成4个氢键,即H2O分子间氢键比HF分子间氢键多,H2O的沸点比HF的高。
[思考交流]
H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键,通常用X—H…Y表示。
二、氢键
归纳总结
1.氢键的形成和表示方法
4.氢键与物质的性质
含有分子间氢键的物质有较高的熔点和沸点,氢键会影响物质溶解性。
3.氢键的类型
氢键有分子内氢键和分子间氢键两种。
2.氢键形成的条件
(1)氢原子位于X原子和Y原子之间。
(2)X、Y原子所属元素具有很大的电负性和很小的原子半径,一般是指位于元素周期表右上角的氮、氧、氟等。
(1)氢键具有饱和性和方向性。
(2)微粒间作用强弱关系:化学键>氢键>范德华力。
(3)氢键分为分子间氢键和分子内氢键,对物质性质的影响分子间氢键大于分子内氢键。如熔点、沸点: 。
(4)与H原子结合的X原子的电负性越大,形成氢键时作用力越大。
[名师点拨]
1.中科院国家纳米科学中心的科研人员在国际上首次“拍到”氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列说法不正确的是( )
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点的大小顺序为HF>HCl>HBr>HI
D.蛋白质中存在氢键
巩固练习
C
【解析】由于氢键具有方向性,在结冰时,水分子之间形成的间隙造成冰晶体的微观空间存在孔洞,导致冰的密度比水的小,浮于水面上,A项正确;乙醇中的羟基氢原子与水分子中的氧原子可形成分子间氢键,乙醇的羟基氧原子与水分子中的H原子之间也可以形成氢键,致使其与水混溶,而甲醚中的O原子与H原子不相连,无法形成氢键,难溶于水,B项正确;HF分子间能形成氢键,故沸点大小顺序为HF>HI>HBr>HCl,C项错误;蛋白质分子中,氨基和羧基中分别存在N原子与H原子相连和O与H相连,可形成氢键,D项正确。
2.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;范德华力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;范德华力
D.范德华力;氢键;非极性键
【解析】因为O的电负性较大,在雪花、水中存在O—H…O,故在实现“雪花→水→水蒸气”的变化阶段主要破坏水分子间的氢键,而由“水蒸气→氧气和氢气”则破坏了O—H极性共价键。
B
1.关于氢键及范德华力,下列说法正确的是( )
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
当堂检测
B
【解析】氢键比范德华力强,但不属于化学键,化学键是原子间的作用力,氢键属于分子间的作用力,A错误;氢键的存在,大大加强了分子间的作用力,使物质的熔、沸点升高,B正确;在结构相似的共价化合物中,相对分子质量越大,物质的熔、沸点越高,但由于HF分子间存在氢键,导致HF的沸点比其他氢化物的沸点高,沸点高低的顺序为HF>HI>HBr>HCl,C错误;氢键一般影响物质的物理性质,H2O是一种稳定的化合物,主要是氧氢键的影响,D错误。
2.下列有关水的叙述中,不能用氢键的知识进行解释的是( )
A.水比硫化氢气体稳定 B.水的熔、沸点比硫化氢的高
C.氨气极易溶于水 D.0 ℃时,水的密度比冰大
【解析】A项中,水比硫化氢气体稳定是由于氧氢键的键能比硫氢键的键能大;B项中,水的熔、沸点比硫化氢的高,与氢键有关;C项中,氨气极易溶于水,与氢键有关;D项中,由于水分子间存在氢键,在固态时水分子大范围以氢键连接,形成疏松多孔的固体,造成体积膨胀,密度减小。
A
3.试用相关知识回答下列问题:
(1)有机化合物大多难溶于水,而乙醇和乙酸可与水互溶,原因是_____________
___________________________________________________________________。
(2)乙醚(C2H5OC2H5)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是______________________________________________________。
(3)从氨合成塔里分离出NH3,通常采用的方法是___________________________
_________,原因是_________________________________________________。
(4)水在常温下的组成的化学式可用(H2O)m表示,原因是________________________________________________________。
乙醇、乙酸和水均为极性分子,且乙醇和乙酸均可与水形成分子间氢键
乙醇分子间存在较强的氢键
加压使NH3液化后,与H2、
N2分离
NH3分子间存在氢键,易液化
水分子间存在氢键,若干个水分子易缔合成较大的“分子”
【解析】(2)乙醇分子间通过氢键结合产生的作用力比乙醚分子间的作用力要大,故乙醇的相对分子质量虽然比较小,但其分子间作用力较大,所以沸点较高。
(4)常温下,水分子不是以单个分子的形式存在的,而是依靠氢键缔合成较大的“分子”,所以用(H2O)m表示其存在更符合实际情况。
本节内容结束
专题3 微粒间作用力与物质性质 第四单元 分子间作用力 分子晶体
第1课时 分子间作用力
学习目标
认识分子间存在相互作用,知道范德华力和氢键是两种常见的分子间作用力,了解分子内氢键和分子间氢键在自然界中的广泛存在及重要作用。
思考:自然界中为什么存在固、液、气三态呢?
分子间存在着分子间作用力,大量的分子可通过分子间作用力结合成分子晶体。
分子间作用力本质上是一种静电作用,包括引力和斥力。
新课导入
卤素单质的相对分子质量和熔、沸点
化学式 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101 -34.6
Br2 160 -7.2 58.8
I2 254 113.5 184.4
请根据上表中的数据探究以下问题:
(1)卤素单质的熔、沸点有怎样的变化规律?
提示:随相对分子质量的增大,卤素单质的熔、沸点依次升高。
活动探究
(2)导致卤素单质熔、沸点规律变化的原因是什么?它与卤素单质相对分子质量的变化规律有怎样的关系?
提示:卤素单质组成和结构相近,分子之间存在范德华力,相对分子质量越大,范德华力越大,相应单质的熔、沸点越高。
1.范德华力与化学键的区别?
提示:范德华力是一种分子间作用力,比化学键的键能小得多。
2.范德华力是如何影响物质性质的?
提示:范德华力主要影响物质的熔点、沸点、溶解度等物理性质。
3.影响范德华力的因素有哪些?
提示:分子的大小、分子的空间构型及分子中电荷分布是否均匀等。
[思考交流]
1.分子间作用力
概念 共价分子之间存在的静电作用
分类 常见的分子间作用力是范德华力和氢键
特点 比化学键弱得多,主要影响物质的物理性质
一、范德华力
归纳总结
概念 范德华力是一种普遍存在于固体、液体和气体中分子之间的作用力
特征 作用力比较小,且一般没有饱和性和方向性
影响因素 分子的大小、分子的空间构型及分子中电荷分布是否均匀等
对物质性质的影响 范德华力主要影响物质的物理性质,如熔点、沸点、溶解度;范德华力越大,物质的熔、沸点越高
2.范德华力
化学键 范德华力
概念 是构成单质或化合物的原子与原子之间或离子与离子之间存在着的强烈的相互作用力 是一种普遍存在于固体、液体和气体中分子之间的作用力
存在 分子(或晶体)内原子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质(分子)和物理性质(晶体) 主要影响物理性质
3.化学键与范德华力的比较
(1)离子化合物中只存在化学键,不存在范德华力。
(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
4.对范德华力存在的理解
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在的较强的静电作用
C.直接影响所有物质的熔、沸点
D.稀有气体的原子间存在范德华力
【解析】范德华力是分子间存在的较弱的相互作用,实质上是一种静电作用,比化学键弱得多,只能影响由分子构成的物质的熔、沸点;稀有气体为单原子分子,原子间存在范德华力。
巩固练习
D
2.下列叙述与范德华力无关的是( )
A.气体物质在加压或降温时能凝结或凝固
B.干冰易于升华
C.氟、氯、溴、碘单质的熔点、沸点依次升高
D.氯化钠的熔点较高
【解析】一般来说,由分子构成的物质,其物理性质通常与范德华力的大小密切相关,A、B、C三个选项中涉及的物质都是由分子构成,故其表现的物理性质与范德华力的大小有关系;只有D选项中的NaCl是离子化合物,不存在分子,故其物理性质与范德华力无关。
D
氧和硫同为ⅥA族元素,H2O和H2S的结构也很相似。从相对分子质量对分子间作用力和物质性质影响的角度分析,应该是H2S的沸点高于H2O,但通常情况下,H2O是液体(沸点为100 ℃),H2S是气体(沸点为-61 ℃)。你知道导致H2O沸点“反常”的原因吗?
提示:H2O分子之间存在氢键。
活动探究
1.分析氢键的形成条件及表示方法。
提示:H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键。氢键通常用X—H…Y表示,其中X和Y代表电负性大而原子半径较小的非金属原子,如氟、氧、氮等。
2.虽然HF分子间氢键比H2O分子间氢键更强,但液体氟化氢的蒸发热却比水的蒸发热低,试解释其原因。
提示:每个HF分子最多与周围的HF分子形成2个氢键,而每个H2O分子最多可与周围的H2O分子形成4个氢键,即H2O分子间氢键比HF分子间氢键多,H2O的沸点比HF的高。
[思考交流]
H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键,通常用X—H…Y表示。
二、氢键
归纳总结
1.氢键的形成和表示方法
4.氢键与物质的性质
含有分子间氢键的物质有较高的熔点和沸点,氢键会影响物质溶解性。
3.氢键的类型
氢键有分子内氢键和分子间氢键两种。
2.氢键形成的条件
(1)氢原子位于X原子和Y原子之间。
(2)X、Y原子所属元素具有很大的电负性和很小的原子半径,一般是指位于元素周期表右上角的氮、氧、氟等。
(1)氢键具有饱和性和方向性。
(2)微粒间作用强弱关系:化学键>氢键>范德华力。
(3)氢键分为分子间氢键和分子内氢键,对物质性质的影响分子间氢键大于分子内氢键。如熔点、沸点: 。
(4)与H原子结合的X原子的电负性越大,形成氢键时作用力越大。
[名师点拨]
1.中科院国家纳米科学中心的科研人员在国际上首次“拍到”氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列说法不正确的是( )
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点的大小顺序为HF>HCl>HBr>HI
D.蛋白质中存在氢键
巩固练习
C
【解析】由于氢键具有方向性,在结冰时,水分子之间形成的间隙造成冰晶体的微观空间存在孔洞,导致冰的密度比水的小,浮于水面上,A项正确;乙醇中的羟基氢原子与水分子中的氧原子可形成分子间氢键,乙醇的羟基氧原子与水分子中的H原子之间也可以形成氢键,致使其与水混溶,而甲醚中的O原子与H原子不相连,无法形成氢键,难溶于水,B项正确;HF分子间能形成氢键,故沸点大小顺序为HF>HI>HBr>HCl,C项错误;蛋白质分子中,氨基和羧基中分别存在N原子与H原子相连和O与H相连,可形成氢键,D项正确。
2.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A.氢键;范德华力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;范德华力
D.范德华力;氢键;非极性键
【解析】因为O的电负性较大,在雪花、水中存在O—H…O,故在实现“雪花→水→水蒸气”的变化阶段主要破坏水分子间的氢键,而由“水蒸气→氧气和氢气”则破坏了O—H极性共价键。
B
1.关于氢键及范德华力,下列说法正确的是( )
A.氢键比范德华力强,所以它属于化学键
B.分子间形成的氢键使物质的熔点和沸点升高
C.沸点:HI>HBr>HCl>HF
D.H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
当堂检测
B
【解析】氢键比范德华力强,但不属于化学键,化学键是原子间的作用力,氢键属于分子间的作用力,A错误;氢键的存在,大大加强了分子间的作用力,使物质的熔、沸点升高,B正确;在结构相似的共价化合物中,相对分子质量越大,物质的熔、沸点越高,但由于HF分子间存在氢键,导致HF的沸点比其他氢化物的沸点高,沸点高低的顺序为HF>HI>HBr>HCl,C错误;氢键一般影响物质的物理性质,H2O是一种稳定的化合物,主要是氧氢键的影响,D错误。
2.下列有关水的叙述中,不能用氢键的知识进行解释的是( )
A.水比硫化氢气体稳定 B.水的熔、沸点比硫化氢的高
C.氨气极易溶于水 D.0 ℃时,水的密度比冰大
【解析】A项中,水比硫化氢气体稳定是由于氧氢键的键能比硫氢键的键能大;B项中,水的熔、沸点比硫化氢的高,与氢键有关;C项中,氨气极易溶于水,与氢键有关;D项中,由于水分子间存在氢键,在固态时水分子大范围以氢键连接,形成疏松多孔的固体,造成体积膨胀,密度减小。
A
3.试用相关知识回答下列问题:
(1)有机化合物大多难溶于水,而乙醇和乙酸可与水互溶,原因是_____________
___________________________________________________________________。
(2)乙醚(C2H5OC2H5)的相对分子质量大于乙醇,但乙醇的沸点却比乙醚的高得多,原因是______________________________________________________。
(3)从氨合成塔里分离出NH3,通常采用的方法是___________________________
_________,原因是_________________________________________________。
(4)水在常温下的组成的化学式可用(H2O)m表示,原因是________________________________________________________。
乙醇、乙酸和水均为极性分子,且乙醇和乙酸均可与水形成分子间氢键
乙醇分子间存在较强的氢键
加压使NH3液化后,与H2、
N2分离
NH3分子间存在氢键,易液化
水分子间存在氢键,若干个水分子易缔合成较大的“分子”
【解析】(2)乙醇分子间通过氢键结合产生的作用力比乙醚分子间的作用力要大,故乙醇的相对分子质量虽然比较小,但其分子间作用力较大,所以沸点较高。
(4)常温下,水分子不是以单个分子的形式存在的,而是依靠氢键缔合成较大的“分子”,所以用(H2O)m表示其存在更符合实际情况。
本节内容结束
