2023春化学苏教版选择性必修二 3.4.2 分子晶体 混合型晶体 课件(共24张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 3.4.2 分子晶体 混合型晶体 课件(共24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 630.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 15:08:11 | ||
图片预览





文档简介
(共24张PPT)
专题3 微粒间作用力与物质性质 第四单元 分子间作用力 分子晶体
第2课时 分子晶体 混合型晶体
核心
素养
学习
目标
借助分子晶体模型认识晶体的结构特点。
构建分子晶体模型,并能用模型认识分子晶体的结构特点,说明晶体中的微粒及其微粒间的相互作用。
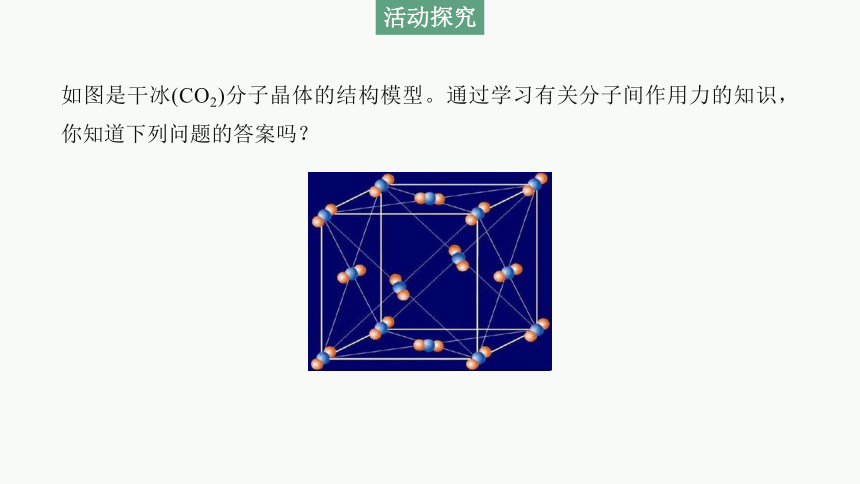
如图是干冰(CO2)分子晶体的结构模型。通过学习有关分子间作用力的知识,你知道下列问题的答案吗?
活动探究
1.构成分子晶体的微粒是什么?分子晶体中微粒间的作用力是什么?
提示:分子;分子间作用力。
2.分子晶体有哪些共同的物理性质?为什么它们具有这些共同的物理性质?
提示:熔点较低,硬度较小;分子晶体由于以比较微弱的分子间作用力相结合,故具有这些共同的物理性质。
3.干冰晶胞中含有CO2分子的数目是多少?配位数是多少?距离CO2分子最近的CO2分子是几个?
提示:4;12;12。
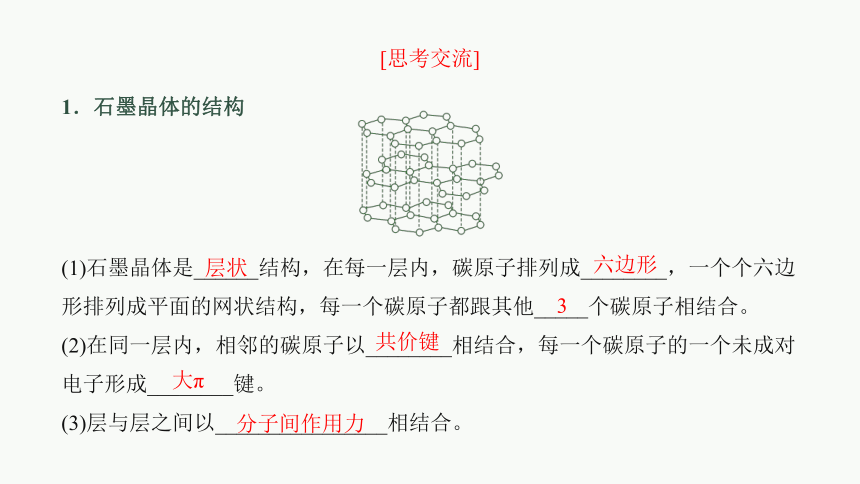
1.石墨晶体的结构
(1)石墨晶体是______结构,在每一层内,碳原子排列成________,一个个六边形排列成平面的网状结构,每一个碳原子都跟其他_____个碳原子相结合。
(2)在同一层内,相邻的碳原子以________相结合,每一个碳原子的一个未成对电子形成________键。
(3)层与层之间以________________相结合。
层状
[思考交流]
六边形
3
共价键
大π
分子间作用力
2.石墨的晶体类型和性质
(1)类型:石墨晶体中既有__________,又有__________,同时还有金属键的特性,是一种________晶体。
(2)性质:熔点高,质软,具有导电性。
共价键
范德华力
混合
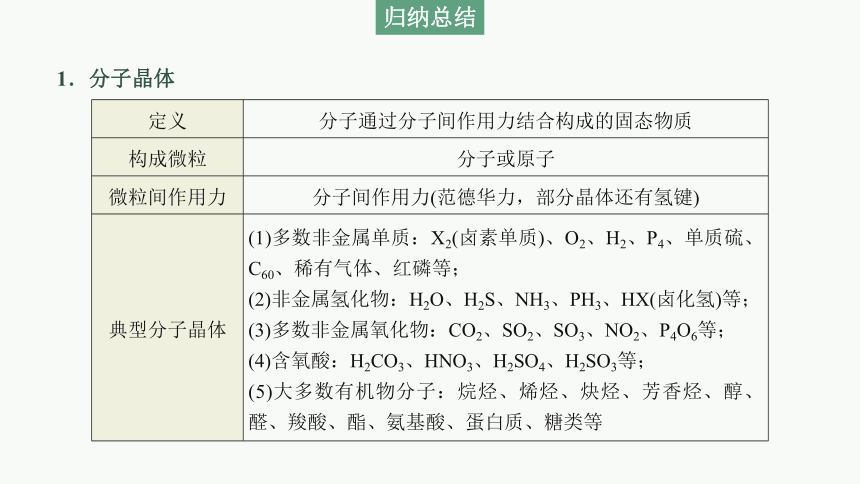
1.分子晶体
定义 分子通过分子间作用力结合构成的固态物质
构成微粒 分子或原子
微粒间作用力 分子间作用力(范德华力,部分晶体还有氢键)
典型分子晶体 (1)多数非金属单质:X2(卤素单质)、O2、H2、P4、单质硫、C60、稀有气体、红磷等;
(2)非金属氢化物:H2O、H2S、NH3、PH3、HX(卤化氢)等;
(3)多数非金属氧化物:CO2、SO2、SO3、NO2、P4O6等;
(4)含氧酸:H2CO3、HNO3、H2SO4、H2SO3等;
(5)大多数有机物分子:烷烃、烯烃、炔烃、芳香烃、醇、醛、羧酸、酯、氨基酸、蛋白质、糖类等
归纳总结
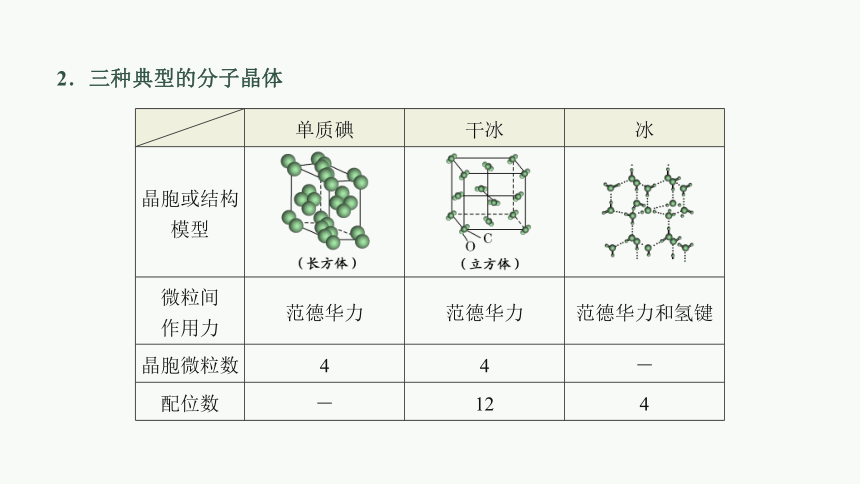
单质碘 干冰 冰
晶胞或结构模型
微粒间 作用力 范德华力 范德华力 范德华力和氢键
晶胞微粒数 4 4 -
配位数 - 12 4
2.三种典型的分子晶体
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点较低,硬度较小。
(2)对组成和结构相似,晶体中又不含氢键的分子晶体来说,随着相对分子质量的增大,范德华力增大,熔、沸点升高。
[名师点拨]
分子间只存在范德华力的分子晶体服从紧密堆积排列原理;分子间存在氢键的分子晶体,由于氢键具有方向性,故不服从紧密堆积排列原理。
3.分子晶体的物理性质
1.下列有关分子晶体的说法中,正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.分子晶体中,共价键越强,键能越大,熔点越高
C.冰融化时水分子内的共价键发生断裂
D.在冰的晶体结构中由于氢键的存在,其熔点较高
巩固练习
D
【解析】分子间作用力的大小决定分子的物理性质,而分子的稳定性则取决于化学键的强弱,故A、B项错误;冰融化时克服范德华力和氢键,水分子内的共价键没有断裂,故C项错误;在冰的晶体结构中存在分子间氢键,使其熔点较高,故D项正确。
2.下列有关分子晶体的说法中,正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定不能由原子直接构成
B
【解析】稀有气体分子组成的晶体中,不存在由多个原子组成的分子,而是原子间通过范德华力结合成晶体,所以不存在任何化学键,且分子为单原子分子,故A、D项错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较大的N、O、F原子结合的氢原子的分子间或者分子内,所以B项正确,C项错误。
3.石墨晶体中层与层、同层原子间的主要作用力分别是( )
A.范德华力,范德华力
B.共价键,范德华力
C.范德华力,共价键
D.共价键,共价键
C
C60结构,又称为巴基球、足球烯,它是一个由60个碳原子结合形成的稳定分子,英国化学家哈罗德·沃特尔·克罗托勾画出的C60的分子结构,富勒的启示起了关键性作用,因此他们一致建议,将其命名为富勒烯。科研人员应用电子计算机模拟出来类似C60的物质N60,试据此回答下列几个问题:
(1)N60在水中的溶解性能是什么?晶体类型是什么?
提示:C60是一种单质,属于分子晶体,而N60类似于C60,所以N60也是单质,属于分子晶体,即具有分子晶体的一些性质,如硬度较小,熔、沸点较低。单质一般是非极性分子,难溶于水这种极性溶剂。
能力提升
(2)N60与N2的熔点谁的更高?稳定性呢?
提示:由于分子晶体相对分子质量越大,熔、沸点越高,所以N60的熔点高于N2。N2分子以N≡N键结合,N60分子中只存在N—N键,而N≡N键比N—N键牢固得多,所以N2的稳定性高于N60。
1.分子在固态时一般为分子晶体具有分子晶体的通性。
2.一般来说,组成和结构相似的分子,相对分子质量越大,范德华力越大,熔点越高。
3.分子的稳定性取决于分子中化学键的键能,一般来说,键能越大,分子越稳定。
归纳总结
1.比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2;②NH3________PH3;
③O3________O2;④Ne________Ar;
⑤CH3CH2OH________CH3OH。
2.已知AlCl3为分子晶体。设计实验判断氯化铝是离子化合物还是共价化合物:
___________________________________________________________________。
在熔融状态下,验证其是否导电,若不导电是共价化合物
【解析】若验证一种化合物是共价化合物还是离子化合物,可测其在熔融状态下是否导电,不导电则是共价化合物,导电则是离子化合物。
举一反三
>
<
>
>
<
1.下列晶体由原子直接构成,且属于分子晶体的是( )
A.固态氢 B.固态氖
C.磷 D.三氧化硫
【解析】固态氢由H2分子构成,磷由磷分子构成,三氧化硫由SO3分子构成,只有固态氖直接由Ne原子构成。
当堂检测
B
2.下列分子晶体的熔、沸点高低的比较中,正确的是( )
A.Cl2>I2 B.SiCl4>CCl4
C.NH3晶体碘
【解析】A、B选项属于无氢键存在且分子结构相似的情况,相对分子质量大的熔、沸点高;C选项属于有氢键存在具分子结构相似的情况,存在氢键的熔、沸点高;D选项,晶体碘常温下是固体,二氧化碳常温下是气体,晶体碘的熔、沸点高。
B
3.如图所示,甲、乙、丙分别表示C60、二氧化碳、碘晶体的晶胞结构模型。
请回答下列问题:
(1)C60的熔点为280 ℃,从晶体类型来看,C60属于________晶体。
(2)二氧化碳晶胞中显示出的二氧化碳分子数为14,实际上一个二氧化碳晶胞中含有_____个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为________。
4
1∶1
分子
3.如图所示,甲、乙、丙分别表示C60、二氧化碳、碘晶体的晶胞结构模型。
请回答下列问题:
(3)①碘晶体属于________晶体。
②碘晶体熔化过程中克服的作用力为__________________。
③假设碘晶胞中长方体的长、宽、高分别为a cm、b cm,c cm,阿伏加德罗常数
的值为NA,则碘晶体的密度为________g·cm-3。
分子
分子间作用力
【解析】(1)C60不属于空间网状结构,熔、沸点低,为分子晶体。
(2)二氧化碳晶胞中,二氧化碳分子分布于晶胞的顶点和面心位置,则晶胞中含有二氧化碳的分子数为8×+6×=4,二氧化碳的结构式为O==C==O,每个分子中含有2个σ键和2个π键,所以σ键与π键的个数比为1∶1。
(3)观察碘晶胞不难发现,一个晶胞中含有碘分子数为8×+6×=4,即含有8个碘原子。一个晶胞的体积为abc cm3,其质量为 g,则碘晶体的密度为 g·cm-3。
本节内容结束
专题3 微粒间作用力与物质性质 第四单元 分子间作用力 分子晶体
第2课时 分子晶体 混合型晶体
核心
素养
学习
目标
借助分子晶体模型认识晶体的结构特点。
构建分子晶体模型,并能用模型认识分子晶体的结构特点,说明晶体中的微粒及其微粒间的相互作用。
如图是干冰(CO2)分子晶体的结构模型。通过学习有关分子间作用力的知识,你知道下列问题的答案吗?
活动探究
1.构成分子晶体的微粒是什么?分子晶体中微粒间的作用力是什么?
提示:分子;分子间作用力。
2.分子晶体有哪些共同的物理性质?为什么它们具有这些共同的物理性质?
提示:熔点较低,硬度较小;分子晶体由于以比较微弱的分子间作用力相结合,故具有这些共同的物理性质。
3.干冰晶胞中含有CO2分子的数目是多少?配位数是多少?距离CO2分子最近的CO2分子是几个?
提示:4;12;12。
1.石墨晶体的结构
(1)石墨晶体是______结构,在每一层内,碳原子排列成________,一个个六边形排列成平面的网状结构,每一个碳原子都跟其他_____个碳原子相结合。
(2)在同一层内,相邻的碳原子以________相结合,每一个碳原子的一个未成对电子形成________键。
(3)层与层之间以________________相结合。
层状
[思考交流]
六边形
3
共价键
大π
分子间作用力
2.石墨的晶体类型和性质
(1)类型:石墨晶体中既有__________,又有__________,同时还有金属键的特性,是一种________晶体。
(2)性质:熔点高,质软,具有导电性。
共价键
范德华力
混合
1.分子晶体
定义 分子通过分子间作用力结合构成的固态物质
构成微粒 分子或原子
微粒间作用力 分子间作用力(范德华力,部分晶体还有氢键)
典型分子晶体 (1)多数非金属单质:X2(卤素单质)、O2、H2、P4、单质硫、C60、稀有气体、红磷等;
(2)非金属氢化物:H2O、H2S、NH3、PH3、HX(卤化氢)等;
(3)多数非金属氧化物:CO2、SO2、SO3、NO2、P4O6等;
(4)含氧酸:H2CO3、HNO3、H2SO4、H2SO3等;
(5)大多数有机物分子:烷烃、烯烃、炔烃、芳香烃、醇、醛、羧酸、酯、氨基酸、蛋白质、糖类等
归纳总结
单质碘 干冰 冰
晶胞或结构模型
微粒间 作用力 范德华力 范德华力 范德华力和氢键
晶胞微粒数 4 4 -
配位数 - 12 4
2.三种典型的分子晶体
(1)分子晶体由于以比较弱的分子间作用力相结合,因此一般熔点较低,硬度较小。
(2)对组成和结构相似,晶体中又不含氢键的分子晶体来说,随着相对分子质量的增大,范德华力增大,熔、沸点升高。
[名师点拨]
分子间只存在范德华力的分子晶体服从紧密堆积排列原理;分子间存在氢键的分子晶体,由于氢键具有方向性,故不服从紧密堆积排列原理。
3.分子晶体的物理性质
1.下列有关分子晶体的说法中,正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.分子晶体中,共价键越强,键能越大,熔点越高
C.冰融化时水分子内的共价键发生断裂
D.在冰的晶体结构中由于氢键的存在,其熔点较高
巩固练习
D
【解析】分子间作用力的大小决定分子的物理性质,而分子的稳定性则取决于化学键的强弱,故A、B项错误;冰融化时克服范德华力和氢键,水分子内的共价键没有断裂,故C项错误;在冰的晶体结构中存在分子间氢键,使其熔点较高,故D项正确。
2.下列有关分子晶体的说法中,正确的是( )
A.分子内均存在共价键
B.分子间一定存在范德华力
C.分子间一定存在氢键
D.其结构一定不能由原子直接构成
B
【解析】稀有气体分子组成的晶体中,不存在由多个原子组成的分子,而是原子间通过范德华力结合成晶体,所以不存在任何化学键,且分子为单原子分子,故A、D项错误;分子间作用力包括范德华力和氢键,范德华力存在于所有的分子晶体中,而氢键只存在于含有与电负性较大的N、O、F原子结合的氢原子的分子间或者分子内,所以B项正确,C项错误。
3.石墨晶体中层与层、同层原子间的主要作用力分别是( )
A.范德华力,范德华力
B.共价键,范德华力
C.范德华力,共价键
D.共价键,共价键
C
C60结构,又称为巴基球、足球烯,它是一个由60个碳原子结合形成的稳定分子,英国化学家哈罗德·沃特尔·克罗托勾画出的C60的分子结构,富勒的启示起了关键性作用,因此他们一致建议,将其命名为富勒烯。科研人员应用电子计算机模拟出来类似C60的物质N60,试据此回答下列几个问题:
(1)N60在水中的溶解性能是什么?晶体类型是什么?
提示:C60是一种单质,属于分子晶体,而N60类似于C60,所以N60也是单质,属于分子晶体,即具有分子晶体的一些性质,如硬度较小,熔、沸点较低。单质一般是非极性分子,难溶于水这种极性溶剂。
能力提升
(2)N60与N2的熔点谁的更高?稳定性呢?
提示:由于分子晶体相对分子质量越大,熔、沸点越高,所以N60的熔点高于N2。N2分子以N≡N键结合,N60分子中只存在N—N键,而N≡N键比N—N键牢固得多,所以N2的稳定性高于N60。
1.分子在固态时一般为分子晶体具有分子晶体的通性。
2.一般来说,组成和结构相似的分子,相对分子质量越大,范德华力越大,熔点越高。
3.分子的稳定性取决于分子中化学键的键能,一般来说,键能越大,分子越稳定。
归纳总结
1.比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2________SO2;②NH3________PH3;
③O3________O2;④Ne________Ar;
⑤CH3CH2OH________CH3OH。
2.已知AlCl3为分子晶体。设计实验判断氯化铝是离子化合物还是共价化合物:
___________________________________________________________________。
在熔融状态下,验证其是否导电,若不导电是共价化合物
【解析】若验证一种化合物是共价化合物还是离子化合物,可测其在熔融状态下是否导电,不导电则是共价化合物,导电则是离子化合物。
举一反三
>
<
>
>
<
1.下列晶体由原子直接构成,且属于分子晶体的是( )
A.固态氢 B.固态氖
C.磷 D.三氧化硫
【解析】固态氢由H2分子构成,磷由磷分子构成,三氧化硫由SO3分子构成,只有固态氖直接由Ne原子构成。
当堂检测
B
2.下列分子晶体的熔、沸点高低的比较中,正确的是( )
A.Cl2>I2 B.SiCl4>CCl4
C.NH3
【解析】A、B选项属于无氢键存在且分子结构相似的情况,相对分子质量大的熔、沸点高;C选项属于有氢键存在具分子结构相似的情况,存在氢键的熔、沸点高;D选项,晶体碘常温下是固体,二氧化碳常温下是气体,晶体碘的熔、沸点高。
B
3.如图所示,甲、乙、丙分别表示C60、二氧化碳、碘晶体的晶胞结构模型。
请回答下列问题:
(1)C60的熔点为280 ℃,从晶体类型来看,C60属于________晶体。
(2)二氧化碳晶胞中显示出的二氧化碳分子数为14,实际上一个二氧化碳晶胞中含有_____个二氧化碳分子,二氧化碳分子中σ键与π键的个数比为________。
4
1∶1
分子
3.如图所示,甲、乙、丙分别表示C60、二氧化碳、碘晶体的晶胞结构模型。
请回答下列问题:
(3)①碘晶体属于________晶体。
②碘晶体熔化过程中克服的作用力为__________________。
③假设碘晶胞中长方体的长、宽、高分别为a cm、b cm,c cm,阿伏加德罗常数
的值为NA,则碘晶体的密度为________g·cm-3。
分子
分子间作用力
【解析】(1)C60不属于空间网状结构,熔、沸点低,为分子晶体。
(2)二氧化碳晶胞中,二氧化碳分子分布于晶胞的顶点和面心位置,则晶胞中含有二氧化碳的分子数为8×+6×=4,二氧化碳的结构式为O==C==O,每个分子中含有2个σ键和2个π键,所以σ键与π键的个数比为1∶1。
(3)观察碘晶胞不难发现,一个晶胞中含有碘分子数为8×+6×=4,即含有8个碘原子。一个晶胞的体积为abc cm3,其质量为 g,则碘晶体的密度为 g·cm-3。
本节内容结束
