2023春化学苏教版选择性必修二 3.1.2 金属晶体 课件(共31张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 3.1.2 金属晶体 课件(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 61.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 15:12:31 | ||
图片预览









文档简介
专题3 微粒间作用力与物质性质
第一单元 金属键 金属晶体
第2课时 金属晶体
通过结晶过程形成的具有规则几何外形的固体叫晶体。
通常情况下,大多数金属单质及其合金也是晶体。
2.晶胞
晶体中能够反映晶体结构特征的基本重复单位
1.晶体
一、金属晶体
知识梳理
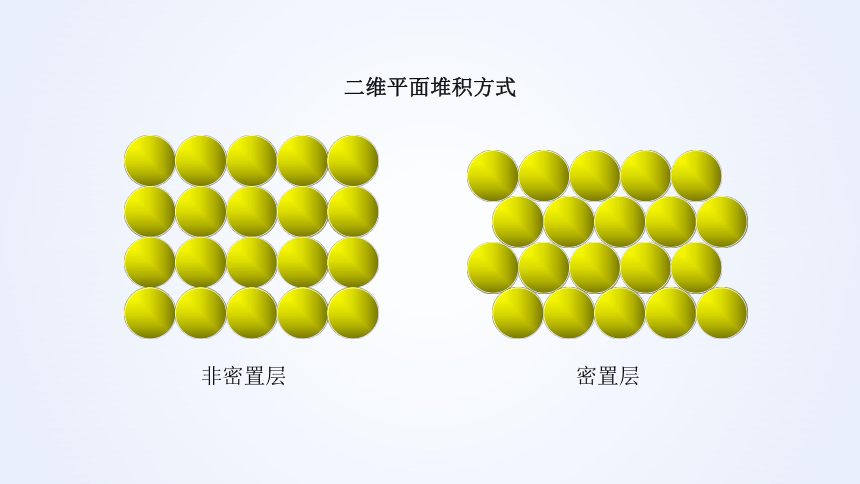
二维平面堆积方式
密置层
非密置层
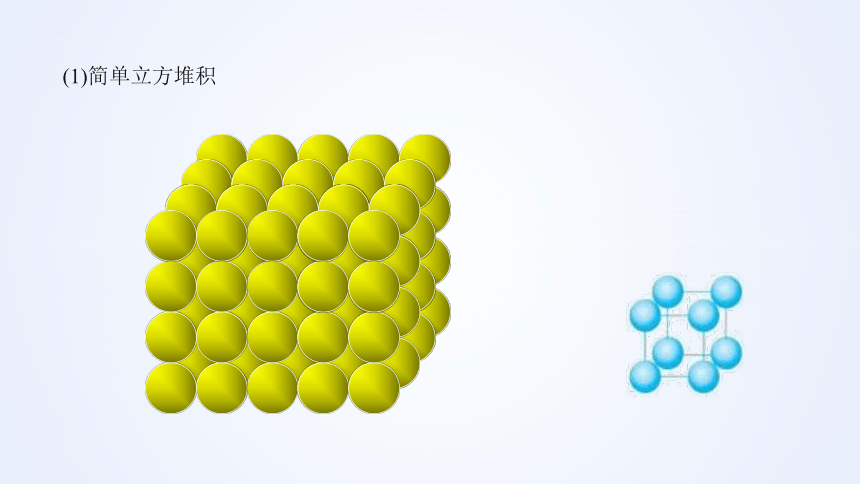
(1)简单立方堆积
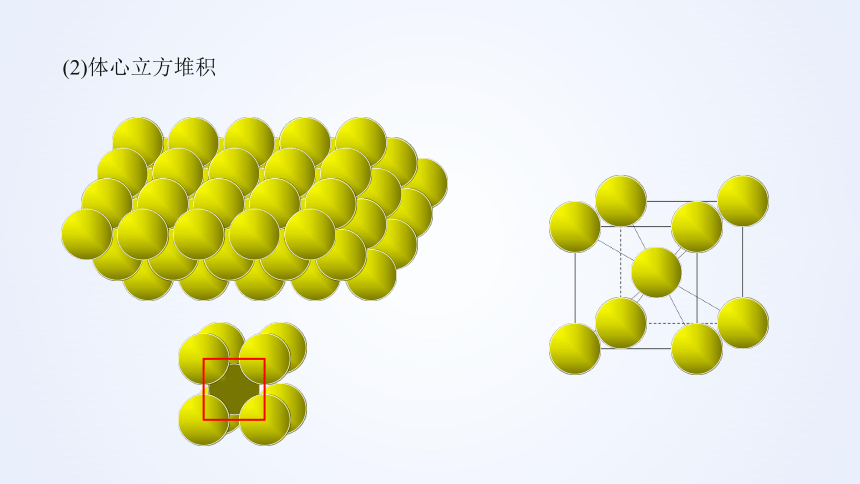
(2)体心立方堆积
(3)六方堆积
(4)面心立方堆积
非密置层堆积形成
密置层堆积形成
三维空间堆积方式
(1)简单立方堆积
①代表金属钋(Po)
②配位数:6
简单立方堆积晶胞
配位数:晶体中一个原子周围距离相等且最近的原子数目叫配位数。
(2)体心立方堆积
①代表金属:Na、K、Fe
②配位数:8
(3)六方堆积
①代表金属:镁、锌、钛
②配位数:12
(4)面心立方堆积
①代表金属:铜、银、金
②配位数:12
二、晶体及晶胞的相关计算
1.晶胞中原子数目的计算(均摊法)
2.晶体空间利用率的计算
3.晶体密度的计算
顶角
棱上
面上
内部
1.晶胞中原子数目的计算(均摊法)
顶点占18
?
棱上占14
?
体内占1
面上占12
?
8×18 = 1
?
8×18 + 1 = 2
?
12×16+2×12 + 3 = 6
?
8×18 + 6×12 = 4
?
晶体空间利用率=
晶胞中微粒总体积
晶胞体积
(1)简单立方堆积
边长a
半径r
a=2r
空间利用率=
=52.3%
2.晶体空间利用率的计算
4πr332r3
?
边长a
4r
空间利用率=
体对角线
(2)体心立方堆积
a
h
a=2r
h=
正六边形的面积s=
63r2
?
空间利用率=
=74%
(3)六方堆积
6×4πr3363r2×463r
?
面心立方的空间利用率=
=74%
边长a
4r
(4)面心立方堆积
4×4πr3322r3
?
晶体密度的计算步骤:
①先确定一个晶胞中微粒个数N(均摊法)
②再确定一个晶胞中微粒的总质量
③最后求晶胞的密度
3.晶体密度的计算
ρ=NNAa3M
?
NNAM
?
简单立方堆积
体心立方堆积
面心立方堆积
晶胞类型
边长a与微粒半径r的关系
晶胞中微粒数
1
2
4
晶胞密度ρ
三、合金
把两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质叫做合金。
(1)合金的熔点比其成分金属低。 (介于两种成分金属的熔点之间)
(2)具有比各成分金属更好的硬度、强度和机械加工性能。
1.定义
2.合金的特性
1.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
【解析】该晶体中含A粒子个数为6×112=12,B粒子个数为6×14+3×16=2,C粒子个数为1;则A、B、C的个数比为12∶2∶1=1∶4∶2。
?
当堂检测
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4
B
2.从如图中选择:
(1)金属钠的晶胞模型是______,每个Na原子周围有_____个紧邻的Na原子。
(2)金属铜的晶胞模型是______,每个Cu原子周围有_____个紧邻的Cu原子。
(3)金属导电靠______________, 电解质溶液导电靠__________________。
自由移动的离子
B
8
D
12
自由电子
【解析】(1)金属钠的堆积方式为体心立方堆积,每个晶胞中含有2个钠原子,其配位数为8,每个钠原子周围有8个紧邻的钠原子。
(2)金属铜的堆积方式为面心立方堆积,每个晶胞含有4个铜原子,配位数为12,每个铜原子周围有12个紧邻的铜原子。
(3)金属导电靠的是金属晶体中含有的自由电子,电解质溶液导电靠的是电解质在溶液中电离出来的自由移动的离子。
3.已知金属间可以形成合金,金和铜可以形成多种合金晶体。其中一种的晶体结构如图所示(为面心立方结构)。
(1)该金属化合物的化学式为________。
(2)已知Au的相对原子质量为197,Cu的相对原子质量为64,阿伏加德罗常数为NA mol-1,若该化合物的密度为d g·cm-3,则两个最近金原子的核间距为
_________cm。
AuCu3
3389d?NA
?
【解析】(1)处于顶点的粒子为8个晶胞共有,每个原子有18属于该晶胞,则Au原子数=8×18=1;处于面上的粒子,同时为两个晶胞共有,每个原子有12属于该晶胞,则Cu原子数=6×12=3;原子数Cu∶Au=3∶1,则化学式为AuCu3。
(2)1个晶胞占有的体积=Md×NA=a3(设a为棱长),则a=3Md×NA 。两个最近金原子的核间距,即该晶胞的棱长为364×3+197g?mol?1d?g?cm?3×NA?mol?1=3389d?NA cm。
?
本节内容结束
第一单元 金属键 金属晶体
第2课时 金属晶体
通过结晶过程形成的具有规则几何外形的固体叫晶体。
通常情况下,大多数金属单质及其合金也是晶体。
2.晶胞
晶体中能够反映晶体结构特征的基本重复单位
1.晶体
一、金属晶体
知识梳理
二维平面堆积方式
密置层
非密置层
(1)简单立方堆积
(2)体心立方堆积
(3)六方堆积
(4)面心立方堆积
非密置层堆积形成
密置层堆积形成
三维空间堆积方式
(1)简单立方堆积
①代表金属钋(Po)
②配位数:6
简单立方堆积晶胞
配位数:晶体中一个原子周围距离相等且最近的原子数目叫配位数。
(2)体心立方堆积
①代表金属:Na、K、Fe
②配位数:8
(3)六方堆积
①代表金属:镁、锌、钛
②配位数:12
(4)面心立方堆积
①代表金属:铜、银、金
②配位数:12
二、晶体及晶胞的相关计算
1.晶胞中原子数目的计算(均摊法)
2.晶体空间利用率的计算
3.晶体密度的计算
顶角
棱上
面上
内部
1.晶胞中原子数目的计算(均摊法)
顶点占18
?
棱上占14
?
体内占1
面上占12
?
8×18 = 1
?
8×18 + 1 = 2
?
12×16+2×12 + 3 = 6
?
8×18 + 6×12 = 4
?
晶体空间利用率=
晶胞中微粒总体积
晶胞体积
(1)简单立方堆积
边长a
半径r
a=2r
空间利用率=
=52.3%
2.晶体空间利用率的计算
4πr332r3
?
边长a
4r
空间利用率=
体对角线
(2)体心立方堆积
a
h
a=2r
h=
正六边形的面积s=
63r2
?
空间利用率=
=74%
(3)六方堆积
6×4πr3363r2×463r
?
面心立方的空间利用率=
=74%
边长a
4r
(4)面心立方堆积
4×4πr3322r3
?
晶体密度的计算步骤:
①先确定一个晶胞中微粒个数N(均摊法)
②再确定一个晶胞中微粒的总质量
③最后求晶胞的密度
3.晶体密度的计算
ρ=NNAa3M
?
NNAM
?
简单立方堆积
体心立方堆积
面心立方堆积
晶胞类型
边长a与微粒半径r的关系
晶胞中微粒数
1
2
4
晶胞密度ρ
三、合金
把两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质叫做合金。
(1)合金的熔点比其成分金属低。 (介于两种成分金属的熔点之间)
(2)具有比各成分金属更好的硬度、强度和机械加工性能。
1.定义
2.合金的特性
1.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )
【解析】该晶体中含A粒子个数为6×112=12,B粒子个数为6×14+3×16=2,C粒子个数为1;则A、B、C的个数比为12∶2∶1=1∶4∶2。
?
当堂检测
A.3∶9∶4 B.1∶4∶2
C.2∶9∶4 D.3∶8∶4
B
2.从如图中选择:
(1)金属钠的晶胞模型是______,每个Na原子周围有_____个紧邻的Na原子。
(2)金属铜的晶胞模型是______,每个Cu原子周围有_____个紧邻的Cu原子。
(3)金属导电靠______________, 电解质溶液导电靠__________________。
自由移动的离子
B
8
D
12
自由电子
【解析】(1)金属钠的堆积方式为体心立方堆积,每个晶胞中含有2个钠原子,其配位数为8,每个钠原子周围有8个紧邻的钠原子。
(2)金属铜的堆积方式为面心立方堆积,每个晶胞含有4个铜原子,配位数为12,每个铜原子周围有12个紧邻的铜原子。
(3)金属导电靠的是金属晶体中含有的自由电子,电解质溶液导电靠的是电解质在溶液中电离出来的自由移动的离子。
3.已知金属间可以形成合金,金和铜可以形成多种合金晶体。其中一种的晶体结构如图所示(为面心立方结构)。
(1)该金属化合物的化学式为________。
(2)已知Au的相对原子质量为197,Cu的相对原子质量为64,阿伏加德罗常数为NA mol-1,若该化合物的密度为d g·cm-3,则两个最近金原子的核间距为
_________cm。
AuCu3
3389d?NA
?
【解析】(1)处于顶点的粒子为8个晶胞共有,每个原子有18属于该晶胞,则Au原子数=8×18=1;处于面上的粒子,同时为两个晶胞共有,每个原子有12属于该晶胞,则Cu原子数=6×12=3;原子数Cu∶Au=3∶1,则化学式为AuCu3。
(2)1个晶胞占有的体积=Md×NA=a3(设a为棱长),则a=3Md×NA 。两个最近金原子的核间距,即该晶胞的棱长为364×3+197g?mol?1d?g?cm?3×NA?mol?1=3389d?NA cm。
?
本节内容结束
