2023春化学苏教版选择性必修二 4.2.2 配合物的性质与应用 课件(共18张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 4.2.2 配合物的性质与应用 课件(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 705.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 17:41:16 | ||
图片预览




文档简介
(共18张PPT)
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
第2课时 配合物的性质与应用
1.了解配位化合物的存在与应用。
2.举例说明物质结构研究的应用价值,如配合物在药物开发和催化剂研制等领域的重要应用。
学习目标
实验1 实验步骤
实验现象 在试管内壁上出现________
结 论 Ag+与NH3形成配合物,减慢葡萄糖还原Ag+的速度,形成_________________
活动探究
银镜
光亮的银镜
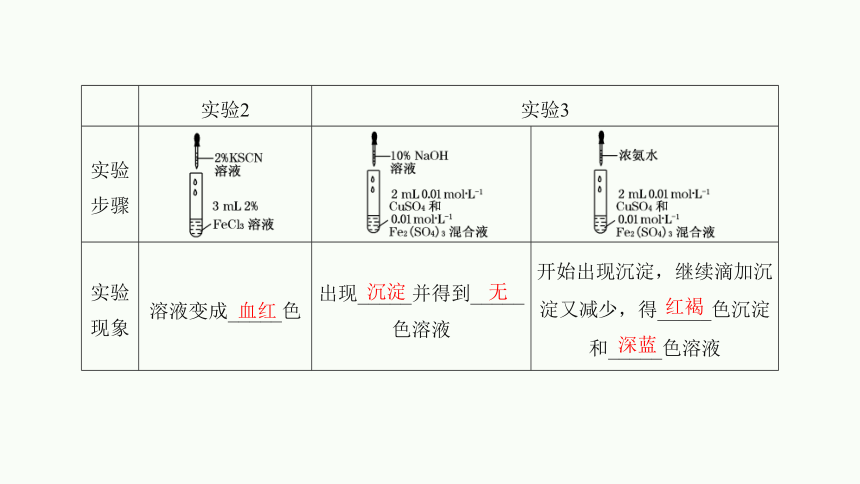
实验2 实验3 实验步骤
实验现象 溶液变成_____色 出现_____并得到_____色溶液 开始出现沉淀,继续滴加沉淀又减少,得_____色沉淀和_____色溶液
血红
沉淀
无
红褐
深蓝
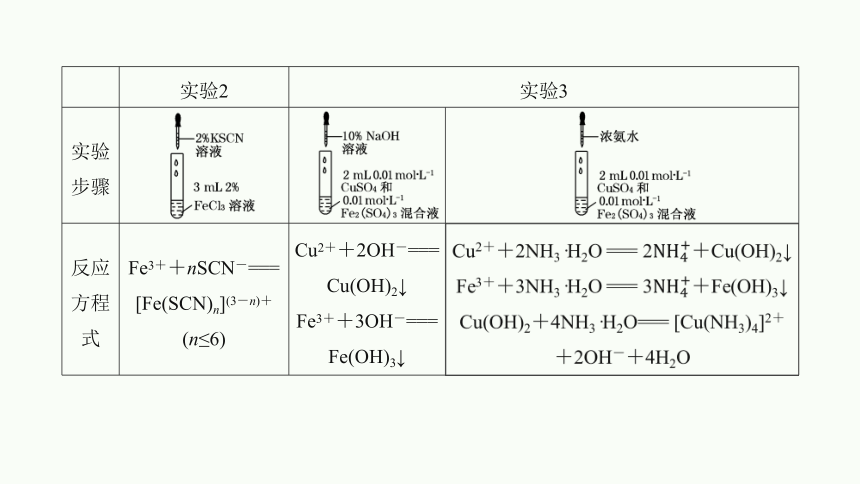
实验2 实验3 实验步骤
反应方程式 Fe3++nSCN-=== [Fe(SCN)n](3-n)+(n≤6) Cu2++2OH-=== Cu(OH)2↓ Fe3++3OH-=== Fe(OH)3↓
1.通过以上实验探究,总结归纳配合物的应用。
提示:实验1用于镀银。实验2、3用于金属离子的检验。
2.在日常生活中遇到哪些与配合物有关的情况?试举一例。
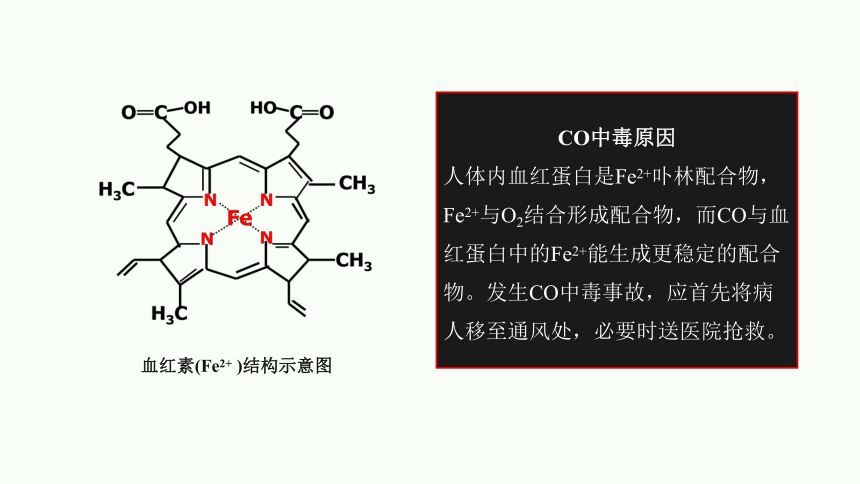
提示:如煤气中毒事件,是血红蛋白中的Fe2+与煤气中的CO形成了比Fe2+与O2形成的配合物更稳定的配合物,从而降低或丧失了血红蛋白输送O2的能力,导致人体缺氧而中毒。
[思考交流]
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
1.在化学分析中,常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
2.在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
3.在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制等方面,配合物发挥着越来越大的作用。
4.配合物在生命体中有着非常重要的作用,许多酶的作用与其结构中含有形成配位键的金属离子的配合物有关。
知识梳理
一、配合物的应用
O
C
NH3
CH2
Pt2+
第二代铂类抗癌药(碳铂)
固氮酶中Fe—Mo中心结构示意图
1.对溶解性的影响:某些难溶物形成配合物时可使溶解度增大。如AgOH可溶于氨水中,I2在浓KI溶液中比在水中的溶解度大得多。
2.颜色的改变:当简单离子形成配离子时其性质往往有很大差异。我们根据颜色的变化就可以判断是否有配离子形成。如Fe3+与SCN-在溶液中可生成红色的铁的硫氰酸根配离子。无水CuSO4为白色,溶于水得蓝色溶液,就是因为Cu2+与H2O形成了天蓝色的[Cu(H2O)4]2+。
二、配合物的形成对性质的影响
3.稳定性增强:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。例如,血红蛋白中的Fe2+与CO形成的配位键比Fe2+与O2形成的配位键强,因此血红蛋白中的Fe2+与 CO结合后,就很难再与O2结合,血红蛋白失去输送氧气的功能,从而导致人体CO中毒。
1.能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )
A.AgNO3溶液 B.NaOH溶液
C.CCl4 D.浓氨水
【解析】外界中有氯离子的[Co(NH3)4Cl2]Cl可以和AgNO3溶液反应生成AgCl沉淀,而[Co(NH3)4Cl2]NO3则不与AgNO3溶液反应。
当堂检测
A
2.如图所示是卟啉配合物叶绿素的结构示意图(部分),下列有关叙述正确的是( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心离子是镁离子
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
【解析】该化合物还含有O元素和N元素,A错误;Mg的最高化合价为+2价,而化合物中Mg与4个N原子作用,由此可以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B正确,D错误;该化合物中配位原子为N原子,不能称N原子为配位体,同样也不能称N元素为配位体,因为配位体一般为离子或分子,C错误。
3.下列过程与配合物无关的是( )
A.向FeCl3溶液中滴加KSCN溶液出现血红色
B.用Na2S2O3溶液溶解照相底片上没有感光的AgBr
C.向FeCl2溶液中滴加氯水,溶液颜色加深
D.向AgNO3溶液中逐滴加入氨水,先出现沉淀,继而沉淀消失
C
【解析】A中形成[Fe(SCN)n](3-n)+;B中形成可溶性的配合物Na3[Ag(S2O3)2];D中先生成AgOH沉淀,当氨水过量时生成[Ag(NH3)2]+;C中发生2FeCl2+Cl2===2FeCl3,与配合物无关。
4.(1)NH3BH3分子中,N—B化学键称为________键,其电子对由_____提供。
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物通过螯合作用形成的配位键有________mol。
6
配位键
N
【解析】(1)NH3BH3中N有孤电子对,B有空轨道,N和B形成配位键,电子对由N提供。
(2)该螯合物中Cd2+与5个N原子、2个O原子形成化学键,其中与1个O原子形成的为共价键,另外的均为配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键。
本节内容结束
专题4 分子空间结构与物质性质
第二单元 配合物的形成和应用
第2课时 配合物的性质与应用
1.了解配位化合物的存在与应用。
2.举例说明物质结构研究的应用价值,如配合物在药物开发和催化剂研制等领域的重要应用。
学习目标
实验1 实验步骤
实验现象 在试管内壁上出现________
结 论 Ag+与NH3形成配合物,减慢葡萄糖还原Ag+的速度,形成_________________
活动探究
银镜
光亮的银镜
实验2 实验3 实验步骤
实验现象 溶液变成_____色 出现_____并得到_____色溶液 开始出现沉淀,继续滴加沉淀又减少,得_____色沉淀和_____色溶液
血红
沉淀
无
红褐
深蓝
实验2 实验3 实验步骤
反应方程式 Fe3++nSCN-=== [Fe(SCN)n](3-n)+(n≤6) Cu2++2OH-=== Cu(OH)2↓ Fe3++3OH-=== Fe(OH)3↓
1.通过以上实验探究,总结归纳配合物的应用。
提示:实验1用于镀银。实验2、3用于金属离子的检验。
2.在日常生活中遇到哪些与配合物有关的情况?试举一例。
提示:如煤气中毒事件,是血红蛋白中的Fe2+与煤气中的CO形成了比Fe2+与O2形成的配合物更稳定的配合物,从而降低或丧失了血红蛋白输送O2的能力,导致人体缺氧而中毒。
[思考交流]
血红素(Fe2+ )结构示意图
CO中毒原因
人体内血红蛋白是Fe2+卟林配合物, Fe2+与O2结合形成配合物,而CO与血红蛋白中的Fe2+能生成更稳定的配合物。发生CO中毒事故,应首先将病人移至通风处,必要时送医院抢救。
1.在化学分析中,常用形成配合物的方法来检验金属离子、分离物质、定量测定物质的组成。
2.在生产中,配合物被广泛应用于染色、电镀、硬水软化、金属冶炼领域。
3.在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制等方面,配合物发挥着越来越大的作用。
4.配合物在生命体中有着非常重要的作用,许多酶的作用与其结构中含有形成配位键的金属离子的配合物有关。
知识梳理
一、配合物的应用
O
C
NH3
CH2
Pt2+
第二代铂类抗癌药(碳铂)
固氮酶中Fe—Mo中心结构示意图
1.对溶解性的影响:某些难溶物形成配合物时可使溶解度增大。如AgOH可溶于氨水中,I2在浓KI溶液中比在水中的溶解度大得多。
2.颜色的改变:当简单离子形成配离子时其性质往往有很大差异。我们根据颜色的变化就可以判断是否有配离子形成。如Fe3+与SCN-在溶液中可生成红色的铁的硫氰酸根配离子。无水CuSO4为白色,溶于水得蓝色溶液,就是因为Cu2+与H2O形成了天蓝色的[Cu(H2O)4]2+。
二、配合物的形成对性质的影响
3.稳定性增强:配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。例如,血红蛋白中的Fe2+与CO形成的配位键比Fe2+与O2形成的配位键强,因此血红蛋白中的Fe2+与 CO结合后,就很难再与O2结合,血红蛋白失去输送氧气的功能,从而导致人体CO中毒。
1.能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )
A.AgNO3溶液 B.NaOH溶液
C.CCl4 D.浓氨水
【解析】外界中有氯离子的[Co(NH3)4Cl2]Cl可以和AgNO3溶液反应生成AgCl沉淀,而[Co(NH3)4Cl2]NO3则不与AgNO3溶液反应。
当堂检测
A
2.如图所示是卟啉配合物叶绿素的结构示意图(部分),下列有关叙述正确的是( )
A.该叶绿素只含有H、Mg、C元素
B.该叶绿素是配合物,中心离子是镁离子
C.该叶绿素是配合物,其配位体是N元素
D.该叶绿素不是配合物,而是高分子化合物
B
【解析】该化合物还含有O元素和N元素,A错误;Mg的最高化合价为+2价,而化合物中Mg与4个N原子作用,由此可以判断该化合物中Mg与N原子间形成配位键,该物质为配合物,B正确,D错误;该化合物中配位原子为N原子,不能称N原子为配位体,同样也不能称N元素为配位体,因为配位体一般为离子或分子,C错误。
3.下列过程与配合物无关的是( )
A.向FeCl3溶液中滴加KSCN溶液出现血红色
B.用Na2S2O3溶液溶解照相底片上没有感光的AgBr
C.向FeCl2溶液中滴加氯水,溶液颜色加深
D.向AgNO3溶液中逐滴加入氨水,先出现沉淀,继而沉淀消失
C
【解析】A中形成[Fe(SCN)n](3-n)+;B中形成可溶性的配合物Na3[Ag(S2O3)2];D中先生成AgOH沉淀,当氨水过量时生成[Ag(NH3)2]+;C中发生2FeCl2+Cl2===2FeCl3,与配合物无关。
4.(1)NH3BH3分子中,N—B化学键称为________键,其电子对由_____提供。
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 mol该配合物通过螯合作用形成的配位键有________mol。
6
配位键
N
【解析】(1)NH3BH3中N有孤电子对,B有空轨道,N和B形成配位键,电子对由N提供。
(2)该螯合物中Cd2+与5个N原子、2个O原子形成化学键,其中与1个O原子形成的为共价键,另外的均为配位键,故1 mol该配合物中通过螯合作用形成6 mol配位键。
本节内容结束
