2023春化学苏教版选择性必修二 4.1.1 杂化轨道理论与分子空间结构 课件(共23张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 4.1.1 杂化轨道理论与分子空间结构 课件(共23张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 23.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 17:46:58 | ||
图片预览








文档简介
(共23张PPT)
专题4 分子空间结构与物质性质
第一单元 分子的空间结构
第1课时 杂化轨道理论与分子空间结构
1.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。
2.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型对分子空间结构的影响。
学习目标
宏观辨识与微观探析:
辨识共价分子,微观认识其空间结构。
证据推理与模型认知:
构建分子的空间结构模型,能用模型认识分子的空间结构,并运用相关的理论和模型进行解释和预测。
核心素养
美妙的分子结构
新课导入
如何用杂化轨道理论解释甲烷的分子组成为CH4及有正四面体的空间结构。
活动探究
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子,4个sp3杂化轨道分别与4个H原子的1s轨道重叠形成4个相同的σ键,从而形成CH4分子,具有正四面体的空间结构。
提示:
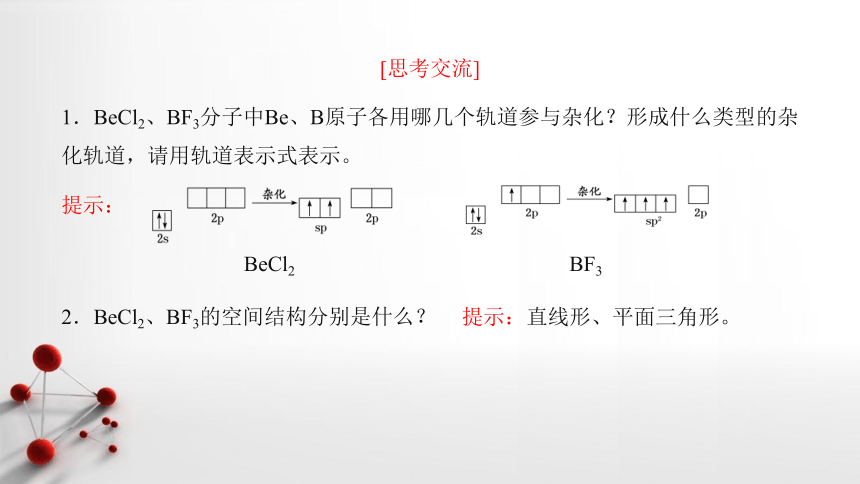
1.BeCl2、BF3分子中Be、B原子各用哪几个轨道参与杂化?形成什么类型的杂化轨道,请用轨道表示式表示。
2.BeCl2、BF3的空间结构分别是什么?
提示:直线形、平面三角形。
[思考交流]
提示:
BeCl2
BF3
提示:
碳原子杂化方式 与周围原子形成σ键个数 π键
乙烷 sp3 4 无
乙烯 sp2 3 1个
乙炔 sp 2 2个
3.请用杂化轨道理论分析乙烷、乙烯和乙炔分子的成键情况。
1.杂化轨道理论
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混杂”,形成能量相等、成分相同的4个sp3杂化轨道,可表示为:
归纳总结
(2)共价键的形成
碳原子的4个sp3杂化轨道分别与氢原子的1s轨道重叠,形成4个相同的σ键。
(3)甲烷分子的空间结构
甲烷分子为正四面体结构,4个C—H键是等同的,C—H键之间的夹角——键角是109°28′。
类型 参与轨道 杂化轨道的夹角 杂化轨道的空间结构 实例
sp3杂化 1个s轨道与3个p轨道 109°28′ 正四面体
sp2杂化 1个s轨道与2个p轨道 120° 平面三角形 BF3、CH2==CH2
sp杂化 1个s轨道与1个p轨道 180° 直线形 BeCl2
2.杂化轨道的类型
分子结构 C原子杂化方式 成键情况
sp3杂化 ①每个C原子的3个sp3轨道与3个H原子的1s轨道重叠形成3个C—H σ键
②2个C原子各以1个sp3轨道发生重叠形成1个C—C σ键
3.用杂化轨道理论分析C2H6、C2H4、C2H2的成键情况
分子结构 C原子杂化方式 成键情况
sp2杂化 ①每个C原子的2个sp2轨道与2个H原子的1s轨道重叠形成2个C—H σ键
②2个C原子各以1个sp2轨道发生重叠形成1个C—C σ键,各以1个未杂化的2p轨道发生重叠,形成1个π键
分子结构 C原子杂化方式 成键情况
sp杂化 ①每个C原子的1个sp轨道与1个H原子的1s轨道重叠形成1个C—H σ键
②2个C原子各以1个sp轨道发生重叠形成1个C—C σ键,各以2个未杂化的2p轨道发生重叠形成2个π键
(1)根据杂化轨道理论,形成苯分子时每个碳原子中一个2s轨道和两个2p轨道发生了sp2杂化,由此形成的三个sp2杂化轨道在同一平面内,每个sp2杂化轨道上有一个未成对电子。
(2)每个碳原子的两个sp2杂化轨道分别与邻近的两个碳原子的sp2杂化轨道重叠形成σ键,于是六个碳原子组成一个正六边形的碳环,每个碳原子的另一个sp2杂化轨道分别与一个氢原子的1s轨道重叠形成σ键。
4.苯分子的杂化类型、空间结构与大π键
(3)每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道(如图甲所示),这六个轨道相互平行且各有一个未成对电子,以“肩并肩”的方式相互重叠,从而形成属于六个碳原子的π键,形象地称为大π键,如图乙所示。
(4)在苯分子中,六个碳原子和六个氢原子都在同一平面内,整个分子呈平面正六边形,键角皆为120°。
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤CH3CH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
当堂检测
A
【解析】sp2杂化形成的为三个夹角为120°的平面三角形杂化轨道,另外中心原子还有未参与杂化的p轨道,可形成一个π键,而杂化轨道只用于形成σ键或容纳未成键的孤电子对,①②③的键角均为120°,④为sp杂化,⑤⑥为sp3杂化。
2.有关杂化轨道的说法不正确的是( )
A.杂化轨道全部形成化学键
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道理论解释
D.杂化前后的轨道数不变,但轨道的形状发生了改变
A
【解析】杂化轨道可以部分参加形成化学键,例如NH3中N发生了sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键,故A错误;sp3、sp2、sp杂化轨道其空间分布分别是正四面体、平面三角形、直线形,夹角分别为109°28′、120°、180°,故B正确;部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道理论解释,如甲烷分子、氨气分子、水分子,故C正确;杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,故D正确。
3.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2 sp2 B.sp3 sp3
C.sp2 sp3 D.sp sp3
C
【解析】 中碳原子形成了3个σ键,需要形成3个杂化轨道,采用的杂化方式是sp2;两边的碳原子各自形成了4个σ键,需要形成4个杂化轨道,采用的是sp3杂化。
本节内容结束
专题4 分子空间结构与物质性质
第一单元 分子的空间结构
第1课时 杂化轨道理论与分子空间结构
1.结合实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。
2.了解杂化轨道理论,能从微观角度理解中心原子的杂化轨道类型对分子空间结构的影响。
学习目标
宏观辨识与微观探析:
辨识共价分子,微观认识其空间结构。
证据推理与模型认知:
构建分子的空间结构模型,能用模型认识分子的空间结构,并运用相关的理论和模型进行解释和预测。
核心素养
美妙的分子结构
新课导入
如何用杂化轨道理论解释甲烷的分子组成为CH4及有正四面体的空间结构。
活动探究
碳原子的4个sp3杂化轨道指向正四面体的4个顶点,每个轨道上都有一个未成对电子,4个sp3杂化轨道分别与4个H原子的1s轨道重叠形成4个相同的σ键,从而形成CH4分子,具有正四面体的空间结构。
提示:
1.BeCl2、BF3分子中Be、B原子各用哪几个轨道参与杂化?形成什么类型的杂化轨道,请用轨道表示式表示。
2.BeCl2、BF3的空间结构分别是什么?
提示:直线形、平面三角形。
[思考交流]
提示:
BeCl2
BF3
提示:
碳原子杂化方式 与周围原子形成σ键个数 π键
乙烷 sp3 4 无
乙烯 sp2 3 1个
乙炔 sp 2 2个
3.请用杂化轨道理论分析乙烷、乙烯和乙炔分子的成键情况。
1.杂化轨道理论
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混杂”,形成能量相等、成分相同的4个sp3杂化轨道,可表示为:
归纳总结
(2)共价键的形成
碳原子的4个sp3杂化轨道分别与氢原子的1s轨道重叠,形成4个相同的σ键。
(3)甲烷分子的空间结构
甲烷分子为正四面体结构,4个C—H键是等同的,C—H键之间的夹角——键角是109°28′。
类型 参与轨道 杂化轨道的夹角 杂化轨道的空间结构 实例
sp3杂化 1个s轨道与3个p轨道 109°28′ 正四面体
sp2杂化 1个s轨道与2个p轨道 120° 平面三角形 BF3、CH2==CH2
sp杂化 1个s轨道与1个p轨道 180° 直线形 BeCl2
2.杂化轨道的类型
分子结构 C原子杂化方式 成键情况
sp3杂化 ①每个C原子的3个sp3轨道与3个H原子的1s轨道重叠形成3个C—H σ键
②2个C原子各以1个sp3轨道发生重叠形成1个C—C σ键
3.用杂化轨道理论分析C2H6、C2H4、C2H2的成键情况
分子结构 C原子杂化方式 成键情况
sp2杂化 ①每个C原子的2个sp2轨道与2个H原子的1s轨道重叠形成2个C—H σ键
②2个C原子各以1个sp2轨道发生重叠形成1个C—C σ键,各以1个未杂化的2p轨道发生重叠,形成1个π键
分子结构 C原子杂化方式 成键情况
sp杂化 ①每个C原子的1个sp轨道与1个H原子的1s轨道重叠形成1个C—H σ键
②2个C原子各以1个sp轨道发生重叠形成1个C—C σ键,各以2个未杂化的2p轨道发生重叠形成2个π键
(1)根据杂化轨道理论,形成苯分子时每个碳原子中一个2s轨道和两个2p轨道发生了sp2杂化,由此形成的三个sp2杂化轨道在同一平面内,每个sp2杂化轨道上有一个未成对电子。
(2)每个碳原子的两个sp2杂化轨道分别与邻近的两个碳原子的sp2杂化轨道重叠形成σ键,于是六个碳原子组成一个正六边形的碳环,每个碳原子的另一个sp2杂化轨道分别与一个氢原子的1s轨道重叠形成σ键。
4.苯分子的杂化类型、空间结构与大π键
(3)每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道(如图甲所示),这六个轨道相互平行且各有一个未成对电子,以“肩并肩”的方式相互重叠,从而形成属于六个碳原子的π键,形象地称为大π键,如图乙所示。
(4)在苯分子中,六个碳原子和六个氢原子都在同一平面内,整个分子呈平面正六边形,键角皆为120°。
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤CH3CH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
当堂检测
A
【解析】sp2杂化形成的为三个夹角为120°的平面三角形杂化轨道,另外中心原子还有未参与杂化的p轨道,可形成一个π键,而杂化轨道只用于形成σ键或容纳未成键的孤电子对,①②③的键角均为120°,④为sp杂化,⑤⑥为sp3杂化。
2.有关杂化轨道的说法不正确的是( )
A.杂化轨道全部形成化学键
B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道理论解释
D.杂化前后的轨道数不变,但轨道的形状发生了改变
A
【解析】杂化轨道可以部分参加形成化学键,例如NH3中N发生了sp3杂化,形成了4个sp3杂化轨道,但是只有3个参与形成化学键,故A错误;sp3、sp2、sp杂化轨道其空间分布分别是正四面体、平面三角形、直线形,夹角分别为109°28′、120°、180°,故B正确;部分四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道理论解释,如甲烷分子、氨气分子、水分子,故C正确;杂化前后的轨道数不变,杂化后,各个轨道尽可能分散、对称分布,导致轨道的形状发生了改变,故D正确。
3.在 中,中间的碳原子和两边的碳原子分别采用的杂化方式是( )
A.sp2 sp2 B.sp3 sp3
C.sp2 sp3 D.sp sp3
C
【解析】 中碳原子形成了3个σ键,需要形成3个杂化轨道,采用的杂化方式是sp2;两边的碳原子各自形成了4个σ键,需要形成4个杂化轨道,采用的是sp3杂化。
本节内容结束
