2023春化学苏教版选择性必修二 4.1.3 分子的极性 手性分子 课件(共35张ppt)
文档属性
| 名称 | 2023春化学苏教版选择性必修二 4.1.3 分子的极性 手性分子 课件(共35张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-23 18:55:38 | ||
图片预览










文档简介
(共35张PPT)
专题4 分子空间结构与物质性质 第一单元 分子的空间结构
第3课时 分子的极性 手性分子
1.知道分子可以分为极性分子和非极性分子,知道分子的极性与分子中键的极性、分子的空间结构密切相关。
2.结合实例初步认识分子的手性对其性质的影响。
3.能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
学习目标
宏观辨识与微观探析:
辨识极性分子和非极性分子,微观认识其键的极性、分子的极性。
证据推理与模型认知:
构建分子的极性与手性分子模型,并能用模型认识分子的极性、键的极性、手性分子等。
核心素养
完成教材P101实验探究有关实验,讨论并回答以下问题:
(1)实验1中观察到水滴是否运动。
提示:是。
(2)试比较碘在水中和在CCl4中的溶解情况。
提示:碘易溶于CCl4,而在水中的溶解度不大。
(3)通过以上实验,你能得出哪些信息?尝试解释产生不同实验现象的原因。
提示:H2O分子有极性,CCl4分子、I2分子无极性;H2O分子在电场作用下发生移动,无极性的I2分子易溶于无极性的CCl4中。
活动探究
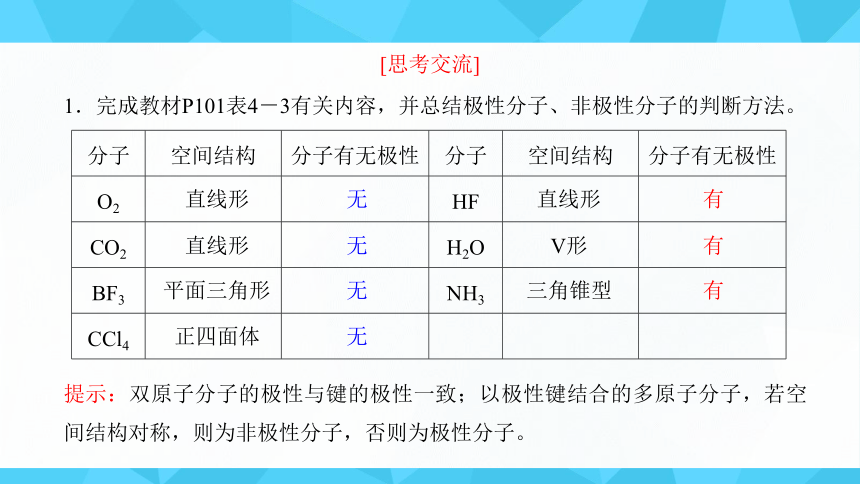
1.完成教材P101表4-3有关内容,并总结极性分子、非极性分子的判断方法。
提示:双原子分子的极性与键的极性一致;以极性键结合的多原子分子,若空间结构对称,则为非极性分子,否则为极性分子。
[思考交流]
分子 空间结构 分子有无极性 分子 空间结构 分子有无极性
O2 HF
CO2 H2O
BF3 NH3
CCl4
直线形
无
直线形
无
平面三角形
无
正四面体
无
直线形
有
V形
有
三角锥型
有
提示:熔点、沸点、溶解性等物理性质;“相似相溶规则”。
3.极性分子中一定不含非极性键吗?非极性分子中一定不含极性键吗?
提示:可能含非极性键;可能含极性键。
2.分子的极性影响物质的哪些物理性质?NH3极易溶于水用什么原理解释?
1.极性分子与非极性分子
极性分子:正电荷重心和负电荷重心不相重合的分子。
非极性分子:正电荷重心和负电荷重心相重合的分子。
一、分子的极性
归纳总结
H2O
F2
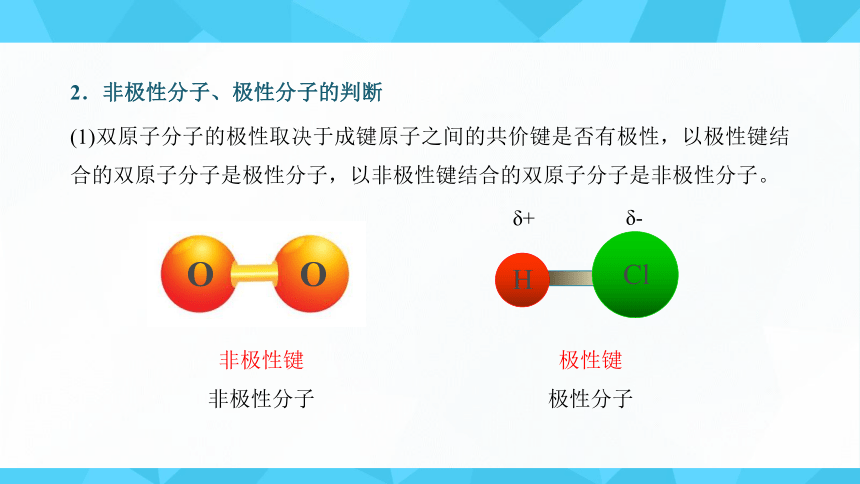
2.非极性分子、极性分子的判断
(1)双原子分子的极性取决于成键原子之间的共价键是否有极性,以极性键结合的双原子分子是极性分子,以非极性键结合的双原子分子是非极性分子。
H
Cl
δ+
δ-
O
O
非极性键
非极性分子
极性键
极性分子
(2)以极性键结合的多原子分子(ABm型),分子是否有极性取决于分子的空间结构。若配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,则分子为非极性分子。
F1
F2
F合≠0
Cl
C
Cl
Cl
Cl
F1
F2
F3
F4
F合=0
极性键
极性分子
极性键
非极性分子
3.分子的极性对物质物理性质的影响
(1)在其他条件相同时,分子的极性越大,范德华力越大,物质的熔点、沸点越高。
(2)对物质溶解性的影响——“相似相溶规则”。
由非极性分子构成的物质一般易溶于非极性溶剂,由极性分子构成的物质一般易溶于极性溶剂。
1.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
【解析】物质的溶解符合“相似相溶规则”,碘分子是非极性分子,水分子是极性分子,而CCl4是非极性分子,故碘在CCl4中溶解度比在水中大。
巩固练习
D
2.下列叙述正确的是( )
A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央
C
【解析】NH3是极性分子,N原子处在三角锥形结构的顶点,3个H原子处于锥底,A错误;CCl4是非极性分子,四个Cl原子构成的是正四面体结构,C原子处在4个Cl原子所组成的四面体的中心,B错误;H2O是极性分子,是V形分子,O原子不处在2个H原子所连成的直线的中央,C正确;CO2是非极性分子,三个原子在一条直线上,C原子处在2个O原子所连成的直线的中央,D错误。
1.观察下图,图中两只相对的手能否重叠?图中的两个乳酸分子能否重叠?是否是同一种物质?
提示:不能重叠,互为镜像,是不同的物质。
活动探究
乳酸分子的对映异构
2.如何理解手性异构体、手性分子等概念?
提示:互为镜像(对映异构)。
1.如何确定是否为手性碳原子?
提示:连接四个不同的原子或基团的碳原子称为手性碳原子。
2. 中含有几个手性碳原子?
[思考交流]
提示:1个。
*
1.手性异构体和手性分子
(1)组成和原子的排列方式完全相同,如同左手和右手一样互为镜像,在三维空间里不能重叠的一对分子互称手性异构体。
(2)含有手性异构体的分子称为手性分子。
二、手性分子
归纳总结
松节油味
橙子味
2.手性碳原子
当四个不同的原子或基团连接在同一碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
﹡C
R1
R2
R4
R3
1.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③互为手性异构体的分子组成相同
④互为手性异构体的分子互为同系物
你认为正确的是( )
A.①②③ B.①②④
C.②③④ D.全部
同分异构体
巩固练习
A
2.下列有机化合物分子中属于手性分子的是( )
A.只有① B.①③
C.①② D.①②③
【解析】有机化合物分子中含有手性碳原子的分子是手性分子,手性碳原子连接四个不同的原子或基团。
③乙酸
C
CH3—C—OH
=
O
(1)ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_________________________________________。
提示:ZnF2为离子化合物,极性较大,不溶于有机溶剂,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小,能溶于有机溶剂。
(2)SiCl4分子属于________分子(填“极性”或“非极性”)。
提示:SiCl4分子中Si原子采用sp3杂化,分子的空间结构为正四面体;SiCl4分子中只含Si—Cl键,分子结构对称,则SiCl4是非极性分子。
能力提升
提示:HCN是直线形分子,正、负电荷重心不重合,因此HCN是极性分子。HClO含有共价键,O原子分别与H、Cl原子形成单键,其电子式为 。
(3)HCN是直线形分子,HCN是________分子(填“极性”或“非极性”)。HClO的电子式为________。
判断分子极性的方法
(1)根据分子的对称性判断
分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
(2)根据键的极性判断
归纳总结
(3)经验规律
①化合价法:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,否则为极性分子。
②孤电子对法:若中心原子有孤电子对则为极性分子,否则为非极性分子。如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
在HF、H2O、NH3、CS2、CH4、N2中:
(1)以非极性键结合的非极性分子是_________。
(2)以极性键相结合,具有直线形结构的非极性分子是____________。
(3)以极性键相结合,具有三角锥形结构的极性分子是____________。
(4)以极性键相结合,具有四面体形结构的非极性分子是____________。
(5)以极性键相结合,具有V形结构的极性分子是________。
(6)以极性键相结合,而且分子极性最大的是__________。
HF
举一反三
N2
CS2
NH3
CH4
H2O
【解析】该题要求判断键的极性、分子的空间结构与分子的极性之间的关系,实质是要掌握分析分子极性的正确思路或方法,简言之,就是要明确常见分子的空间结构及其对称性。另外,分子极性强弱与成键原子的电负性数值的差值有关,HF分子中元素的电负性相差最大,所以键的极性最强,则HF分子的极性也最大。
1.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O是非极性分子
当堂检测
B
【解析】H2O2是极性分子,故A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及极性键H—O键的断裂和非极性键H—H键、O—O键的形成,故B正确;分子的极性与分子内共价键的极性和分子的空间结构密切相关,分子中的正、负电荷重心是否重合是分子极性的依据,电荷重心重合是非极性分子,不重合是极性分子,如甲烷是极性键形成的非极性分子,故C错误;H2O是极性分子,故D错误。
2.已知乙烯(C2H4)的电子式为 ,乙烯分子中六个原子在同一个平面上,H—C键之间、H—C键与C==C键之间的夹角都是120°,下列说法正确的是( )
A.乙烯分子为极性分子
B.乙烯分子为非极性分子
C.乙烯分子中只含有极性键
D.乙烯分子中只含有非极性键
B
【解析】由于乙烯分子中6个原子在同一平面上,且分子内所有的键角均为120°,虽然分子中有4个C—H极性键,1个C==C非极性键,但由于分子高度对称,因此整个分子正、负电荷重心完全重合,为非极性分子。
3.下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.C60、C2H4 D.NH3、HCl
【解析】A错,CO2是含极性键的非极性分子,H2S是含极性键的极性分子;B对,C2H4、CH4都是含极性键的非极性分子;C错,C60是含非极性键的非极性分子;D错,NH3、HCl都是含极性键的极性分子。
B
4.下列化合物中含有手性碳原子的是( )
B
*
5.在下列物质中:①HCl ②N2 ③NH3 ④Na2O2 ⑤H2O2 ⑥NH4Cl ⑦NaOH ⑧Ar ⑨CO2 ⑩C2H4
(1)只存在非极性键的分子是___________;既存在非极性键又存在极性键的分子是___________;只存在极性键的分子是___________。
(2)不存在化学键的是___________。
(3)既存在离子键又存在极性键的是___________;既存在离子键又存在非极性键的是___________。
②
⑤⑩
①③⑨
⑧
⑥⑦
④
本节内容结束
专题4 分子空间结构与物质性质 第一单元 分子的空间结构
第3课时 分子的极性 手性分子
1.知道分子可以分为极性分子和非极性分子,知道分子的极性与分子中键的极性、分子的空间结构密切相关。
2.结合实例初步认识分子的手性对其性质的影响。
3.能根据分子结构特点和键的极性来判断分子的极性,并据此对分子的一些典型性质及其应用作出解释。
学习目标
宏观辨识与微观探析:
辨识极性分子和非极性分子,微观认识其键的极性、分子的极性。
证据推理与模型认知:
构建分子的极性与手性分子模型,并能用模型认识分子的极性、键的极性、手性分子等。
核心素养
完成教材P101实验探究有关实验,讨论并回答以下问题:
(1)实验1中观察到水滴是否运动。
提示:是。
(2)试比较碘在水中和在CCl4中的溶解情况。
提示:碘易溶于CCl4,而在水中的溶解度不大。
(3)通过以上实验,你能得出哪些信息?尝试解释产生不同实验现象的原因。
提示:H2O分子有极性,CCl4分子、I2分子无极性;H2O分子在电场作用下发生移动,无极性的I2分子易溶于无极性的CCl4中。
活动探究
1.完成教材P101表4-3有关内容,并总结极性分子、非极性分子的判断方法。
提示:双原子分子的极性与键的极性一致;以极性键结合的多原子分子,若空间结构对称,则为非极性分子,否则为极性分子。
[思考交流]
分子 空间结构 分子有无极性 分子 空间结构 分子有无极性
O2 HF
CO2 H2O
BF3 NH3
CCl4
直线形
无
直线形
无
平面三角形
无
正四面体
无
直线形
有
V形
有
三角锥型
有
提示:熔点、沸点、溶解性等物理性质;“相似相溶规则”。
3.极性分子中一定不含非极性键吗?非极性分子中一定不含极性键吗?
提示:可能含非极性键;可能含极性键。
2.分子的极性影响物质的哪些物理性质?NH3极易溶于水用什么原理解释?
1.极性分子与非极性分子
极性分子:正电荷重心和负电荷重心不相重合的分子。
非极性分子:正电荷重心和负电荷重心相重合的分子。
一、分子的极性
归纳总结
H2O
F2
2.非极性分子、极性分子的判断
(1)双原子分子的极性取决于成键原子之间的共价键是否有极性,以极性键结合的双原子分子是极性分子,以非极性键结合的双原子分子是非极性分子。
H
Cl
δ+
δ-
O
O
非极性键
非极性分子
极性键
极性分子
(2)以极性键结合的多原子分子(ABm型),分子是否有极性取决于分子的空间结构。若配位原子对称地分布在中心原子周围,整个分子的正、负电荷重心相重合,则分子为非极性分子。
F1
F2
F合≠0
Cl
C
Cl
Cl
Cl
F1
F2
F3
F4
F合=0
极性键
极性分子
极性键
非极性分子
3.分子的极性对物质物理性质的影响
(1)在其他条件相同时,分子的极性越大,范德华力越大,物质的熔点、沸点越高。
(2)对物质溶解性的影响——“相似相溶规则”。
由非极性分子构成的物质一般易溶于非极性溶剂,由极性分子构成的物质一般易溶于极性溶剂。
1.碘单质在水中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大
B.CCl4与I2都是直线形分子,而H2O不是直线形分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
【解析】物质的溶解符合“相似相溶规则”,碘分子是非极性分子,水分子是极性分子,而CCl4是非极性分子,故碘在CCl4中溶解度比在水中大。
巩固练习
D
2.下列叙述正确的是( )
A.NH3是极性分子,N原子处在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央
C
【解析】NH3是极性分子,N原子处在三角锥形结构的顶点,3个H原子处于锥底,A错误;CCl4是非极性分子,四个Cl原子构成的是正四面体结构,C原子处在4个Cl原子所组成的四面体的中心,B错误;H2O是极性分子,是V形分子,O原子不处在2个H原子所连成的直线的中央,C正确;CO2是非极性分子,三个原子在一条直线上,C原子处在2个O原子所连成的直线的中央,D错误。
1.观察下图,图中两只相对的手能否重叠?图中的两个乳酸分子能否重叠?是否是同一种物质?
提示:不能重叠,互为镜像,是不同的物质。
活动探究
乳酸分子的对映异构
2.如何理解手性异构体、手性分子等概念?
提示:互为镜像(对映异构)。
1.如何确定是否为手性碳原子?
提示:连接四个不同的原子或基团的碳原子称为手性碳原子。
2. 中含有几个手性碳原子?
[思考交流]
提示:1个。
*
1.手性异构体和手性分子
(1)组成和原子的排列方式完全相同,如同左手和右手一样互为镜像,在三维空间里不能重叠的一对分子互称手性异构体。
(2)含有手性异构体的分子称为手性分子。
二、手性分子
归纳总结
松节油味
橙子味
2.手性碳原子
当四个不同的原子或基团连接在同一碳原子上时,形成的化合物存在手性异构体。其中,连接四个不同的原子或基团的碳原子称为手性碳原子。
﹡C
R1
R2
R4
R3
1.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③互为手性异构体的分子组成相同
④互为手性异构体的分子互为同系物
你认为正确的是( )
A.①②③ B.①②④
C.②③④ D.全部
同分异构体
巩固练习
A
2.下列有机化合物分子中属于手性分子的是( )
A.只有① B.①③
C.①② D.①②③
【解析】有机化合物分子中含有手性碳原子的分子是手性分子,手性碳原子连接四个不同的原子或基团。
③乙酸
C
CH3—C—OH
=
O
(1)ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_________________________________________。
提示:ZnF2为离子化合物,极性较大,不溶于有机溶剂,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小,能溶于有机溶剂。
(2)SiCl4分子属于________分子(填“极性”或“非极性”)。
提示:SiCl4分子中Si原子采用sp3杂化,分子的空间结构为正四面体;SiCl4分子中只含Si—Cl键,分子结构对称,则SiCl4是非极性分子。
能力提升
提示:HCN是直线形分子,正、负电荷重心不重合,因此HCN是极性分子。HClO含有共价键,O原子分别与H、Cl原子形成单键,其电子式为 。
(3)HCN是直线形分子,HCN是________分子(填“极性”或“非极性”)。HClO的电子式为________。
判断分子极性的方法
(1)根据分子的对称性判断
分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
(2)根据键的极性判断
归纳总结
(3)经验规律
①化合价法:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,否则为极性分子。
②孤电子对法:若中心原子有孤电子对则为极性分子,否则为非极性分子。如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
在HF、H2O、NH3、CS2、CH4、N2中:
(1)以非极性键结合的非极性分子是_________。
(2)以极性键相结合,具有直线形结构的非极性分子是____________。
(3)以极性键相结合,具有三角锥形结构的极性分子是____________。
(4)以极性键相结合,具有四面体形结构的非极性分子是____________。
(5)以极性键相结合,具有V形结构的极性分子是________。
(6)以极性键相结合,而且分子极性最大的是__________。
HF
举一反三
N2
CS2
NH3
CH4
H2O
【解析】该题要求判断键的极性、分子的空间结构与分子的极性之间的关系,实质是要掌握分析分子极性的正确思路或方法,简言之,就是要明确常见分子的空间结构及其对称性。另外,分子极性强弱与成键原子的电负性数值的差值有关,HF分子中元素的电负性相差最大,所以键的极性最强,则HF分子的极性也最大。
1.中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O是非极性分子
当堂检测
B
【解析】H2O2是极性分子,故A错误;反应Ⅰ是在催化剂作用下H2O生成H2和H2O2,涉及极性键H—O键的断裂和非极性键H—H键、O—O键的形成,故B正确;分子的极性与分子内共价键的极性和分子的空间结构密切相关,分子中的正、负电荷重心是否重合是分子极性的依据,电荷重心重合是非极性分子,不重合是极性分子,如甲烷是极性键形成的非极性分子,故C错误;H2O是极性分子,故D错误。
2.已知乙烯(C2H4)的电子式为 ,乙烯分子中六个原子在同一个平面上,H—C键之间、H—C键与C==C键之间的夹角都是120°,下列说法正确的是( )
A.乙烯分子为极性分子
B.乙烯分子为非极性分子
C.乙烯分子中只含有极性键
D.乙烯分子中只含有非极性键
B
【解析】由于乙烯分子中6个原子在同一平面上,且分子内所有的键角均为120°,虽然分子中有4个C—H极性键,1个C==C非极性键,但由于分子高度对称,因此整个分子正、负电荷重心完全重合,为非极性分子。
3.下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.C60、C2H4 D.NH3、HCl
【解析】A错,CO2是含极性键的非极性分子,H2S是含极性键的极性分子;B对,C2H4、CH4都是含极性键的非极性分子;C错,C60是含非极性键的非极性分子;D错,NH3、HCl都是含极性键的极性分子。
B
4.下列化合物中含有手性碳原子的是( )
B
*
5.在下列物质中:①HCl ②N2 ③NH3 ④Na2O2 ⑤H2O2 ⑥NH4Cl ⑦NaOH ⑧Ar ⑨CO2 ⑩C2H4
(1)只存在非极性键的分子是___________;既存在非极性键又存在极性键的分子是___________;只存在极性键的分子是___________。
(2)不存在化学键的是___________。
(3)既存在离子键又存在极性键的是___________;既存在离子键又存在非极性键的是___________。
②
⑤⑩
①③⑨
⑧
⑥⑦
④
本节内容结束
