人教版(2019)必修第一册 1.3.1 氧化还原反应 课件(20张ppt)
文档属性
| 名称 | 人教版(2019)必修第一册 1.3.1 氧化还原反应 课件(20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 869.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 11:00:44 | ||
图片预览






文档简介
(共20张PPT)
第3节 氧化还原反应
第一章 物质及其变化
高中人教版新教材
化学必修一
(1)氧化还原反应
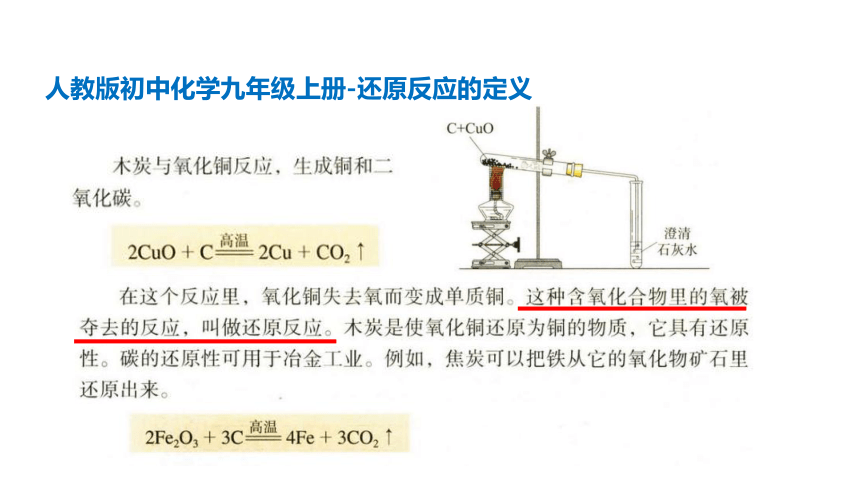
思考1:在初中阶段我们学过哪四种基本反应类型? 各举一个反应实例。思考2:这四种基本反应类型分类的依据是什么?一、氧化还原反应复习导入根据反应物和生成物的类别以及反应前后物质的种类的多少化合反应分解反应置换反应复分解反应人教版初中化学九年级上册-还原反应的定义
初中对氧化反应和还原反应的定义
氧化反应:
还原反应:
物质失去氧的反应
物质得到氧的反应
氧元素的得失
分类依据:
B
氧化还原反应:氧化反应和还原反应是同时发生的,符合质量守恒定律。
C的角度:得到氧,发生氧化反应。
CuO的角度:失去氧,发生还原反应。
思考交流
氧化反应和还原反应是分别独立进行的吗?为什么?
结论1:
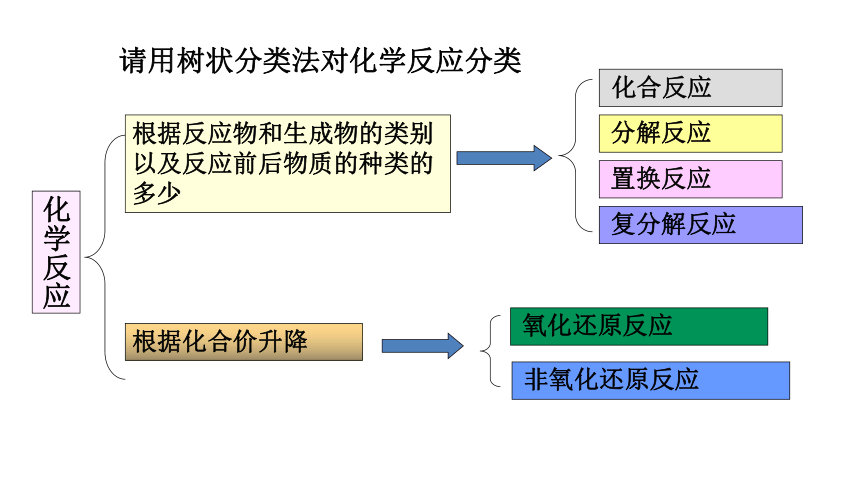
下列氧化还原反应中各种元素的化合价在反应前后有无变化?讨论氧化还原反应与元素化合价的升降有什么关系?思考与交流22CuO + C == 2Cu + CO2↑高温H2O + C == H2+ CO高温CuO + H2== Cu + H2O△+200 +4+100+2+2 00+1一、氧化还原反应结论2:物质所含元素化合价升高的反应是氧化反应物质所含元素化合价降低的反应是还原反应有元素化合价升降的化学反应是氧化还原反应氧化还原反应的判断依据:是否有元素化合价升降【学以致用】分析反应:H2+Cl2=2HClFe + CuSO4= FeSO4+ Cu 2Na+Cl2=2NaCl是不是氧化还原反应,为什么?一、氧化还原反应怎样判断一个反应是不是氧化还原反应?请用树状分类法对化学反应分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
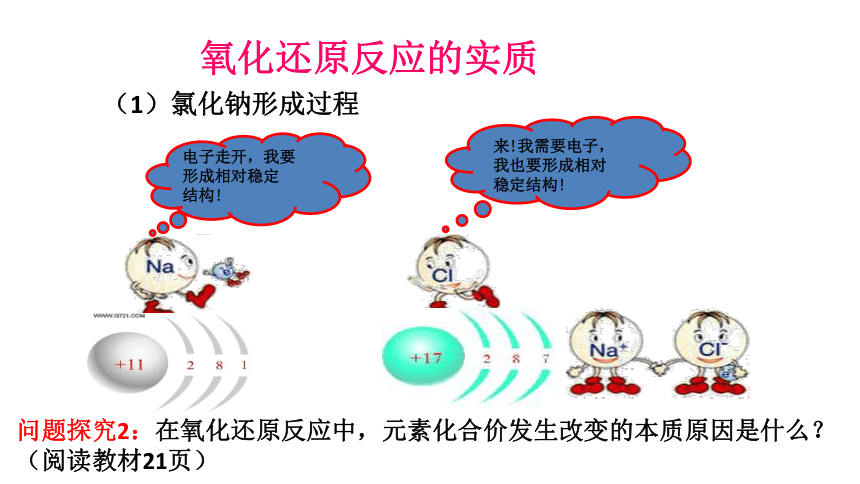
氧化还原反应的实质
(1)氯化钠形成过程
问题探究2:在氧化还原反应中,元素化合价发生改变的本质原因是什么?(阅读教材21页)
氯气与钠的反应:
+17
2
8
7
+11
2
8
1
+17
2
8
8
+11
2
8
点燃
0
0
-1
+1
+1
-1
氯原子, 1个电子,生成 ,化合价 ,发生 反应。
钠原子, 1个电子,生成 ,化合价 ,发生 反应。
得到
降低
还原
氧化
升高
失去
化合价变化本质原因的分析:以NaCl为例+11+17+17+11Na+Cl-NaClCl-Na+化合价的升降——电子的得失2Na + Cl2== 2NaCl化合价升高,失去电子化合价降低,得到电子一、氧化还原反应点燃
+17
2
8
7
+1
1
+1
+17
+1
+17
氯气与氢气的反应:
0
0
+1
-1
氯原子,共用电子对 ,化合价 ,发生 反应。
钠原子,共用电子对 ,化合价 ,发生 反应。
降低
还原
氧化
升高
HCl+17+1+1+17H Cl+1 -1HClHCl化合价的升降的原因:H2+ Cl2= 2HCl00+1-1共用电子对的偏移化合价变化本质原因的分析:以HCl为例一、氧化还原反应总结与归纳
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化反应:失去电子(或共用电子对偏离)的反应
还原反应:得到电子(或共用电子对偏向)的反应
失电子(或电子对偏离)→化合价升高→氧化反应得电子(或电子对偏向)→化合价降低→还原反应↓本质↓特征规律:升、失、氧;降、得、还一、氧化还原反应Cu+Cl2=== CuCl2△CaO + H2O === Ca(OH)2Fe+CuSO4== Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?属于哪种基本反应类型?CaCO3===CaO+CO2↑高温2KClO3===2KCl+3O2↑△NaOH+HCl==NaCl+H2O一、氧化还原反应化学反应结论3:氧化还原反应与四种基本反应类型的关系非氧化还原反应氧化还原反应复分解反应分解反应化合反应置换反应一、氧化还原反应基本反应类型 实例 是否氧化还原反应
H2+Cl2 2HCl
CO2+H2O H2CO3 2HClO 2HCl+O2
CaCO3 CaO+CO2 2F2+2H2O 4HF+O2 Cl2+2KI 2KCl+I2
HCl+NaOH NaCl+H2O
点燃
光
高温
基本反应类型与氧化还原反应的关系
有单质参加的化合反应一定是氧化还原反应
有单质生成的分解反应一定是氧化还原反应
置换反应一定属于氧化还原反应
一定不属于
化合反应
分解反应
置换反应
复分解反应
1、下列反应属于氧化还原反应的是( )A. CuO+2HCl=CuCl2+H2OB. 2Na2O2+2H2O=4NaOH+O2↑C. Zn+CuSO4=ZnSO4+CuD. Ca(OH)2+CO2=CaCO3↓+H2OBC课堂练习2、下列四种基本类型的反应中,一定是氧化还原反应的是( )A.化合反应B.分解反应C.置换反应D.复分解反应C一、氧化还原反应3、下列叙述正确的是( )A.在氧化还原反应中,失去电子的物质,所含元素化合价降低B.凡是有元素化合价升降的化学反应都是氧化还原反应C.在氧化还原反应中一定所有的元素化合价都发生变化D.氧化还原反应的本质是电子的转移(得失或偏移)BD一、氧化还原反应
第3节 氧化还原反应
第一章 物质及其变化
高中人教版新教材
化学必修一
(1)氧化还原反应
思考1:在初中阶段我们学过哪四种基本反应类型? 各举一个反应实例。思考2:这四种基本反应类型分类的依据是什么?一、氧化还原反应复习导入根据反应物和生成物的类别以及反应前后物质的种类的多少化合反应分解反应置换反应复分解反应人教版初中化学九年级上册-还原反应的定义
初中对氧化反应和还原反应的定义
氧化反应:
还原反应:
物质失去氧的反应
物质得到氧的反应
氧元素的得失
分类依据:
B
氧化还原反应:氧化反应和还原反应是同时发生的,符合质量守恒定律。
C的角度:得到氧,发生氧化反应。
CuO的角度:失去氧,发生还原反应。
思考交流
氧化反应和还原反应是分别独立进行的吗?为什么?
结论1:
下列氧化还原反应中各种元素的化合价在反应前后有无变化?讨论氧化还原反应与元素化合价的升降有什么关系?思考与交流22CuO + C == 2Cu + CO2↑高温H2O + C == H2+ CO高温CuO + H2== Cu + H2O△+200 +4+100+2+2 00+1一、氧化还原反应结论2:物质所含元素化合价升高的反应是氧化反应物质所含元素化合价降低的反应是还原反应有元素化合价升降的化学反应是氧化还原反应氧化还原反应的判断依据:是否有元素化合价升降【学以致用】分析反应:H2+Cl2=2HClFe + CuSO4= FeSO4+ Cu 2Na+Cl2=2NaCl是不是氧化还原反应,为什么?一、氧化还原反应怎样判断一个反应是不是氧化还原反应?请用树状分类法对化学反应分类
化学反应
根据反应物和生成物的类别以及反应前后物质的种类的多少
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
根据化合价升降
非氧化还原反应
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
氧化还原反应的实质
(1)氯化钠形成过程
问题探究2:在氧化还原反应中,元素化合价发生改变的本质原因是什么?(阅读教材21页)
氯气与钠的反应:
+17
2
8
7
+11
2
8
1
+17
2
8
8
+11
2
8
点燃
0
0
-1
+1
+1
-1
氯原子, 1个电子,生成 ,化合价 ,发生 反应。
钠原子, 1个电子,生成 ,化合价 ,发生 反应。
得到
降低
还原
氧化
升高
失去
化合价变化本质原因的分析:以NaCl为例+11+17+17+11Na+Cl-NaClCl-Na+化合价的升降——电子的得失2Na + Cl2== 2NaCl化合价升高,失去电子化合价降低,得到电子一、氧化还原反应点燃
+17
2
8
7
+1
1
+1
+17
+1
+17
氯气与氢气的反应:
0
0
+1
-1
氯原子,共用电子对 ,化合价 ,发生 反应。
钠原子,共用电子对 ,化合价 ,发生 反应。
降低
还原
氧化
升高
HCl+17+1+1+17H Cl+1 -1HClHCl化合价的升降的原因:H2+ Cl2= 2HCl00+1-1共用电子对的偏移化合价变化本质原因的分析:以HCl为例一、氧化还原反应总结与归纳
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化反应:失去电子(或共用电子对偏离)的反应
还原反应:得到电子(或共用电子对偏向)的反应
失电子(或电子对偏离)→化合价升高→氧化反应得电子(或电子对偏向)→化合价降低→还原反应↓本质↓特征规律:升、失、氧;降、得、还一、氧化还原反应Cu+Cl2=== CuCl2△CaO + H2O === Ca(OH)2Fe+CuSO4== Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?属于哪种基本反应类型?CaCO3===CaO+CO2↑高温2KClO3===2KCl+3O2↑△NaOH+HCl==NaCl+H2O一、氧化还原反应化学反应结论3:氧化还原反应与四种基本反应类型的关系非氧化还原反应氧化还原反应复分解反应分解反应化合反应置换反应一、氧化还原反应基本反应类型 实例 是否氧化还原反应
H2+Cl2 2HCl
CO2+H2O H2CO3 2HClO 2HCl+O2
CaCO3 CaO+CO2 2F2+2H2O 4HF+O2 Cl2+2KI 2KCl+I2
HCl+NaOH NaCl+H2O
点燃
光
高温
基本反应类型与氧化还原反应的关系
有单质参加的化合反应一定是氧化还原反应
有单质生成的分解反应一定是氧化还原反应
置换反应一定属于氧化还原反应
一定不属于
化合反应
分解反应
置换反应
复分解反应
1、下列反应属于氧化还原反应的是( )A. CuO+2HCl=CuCl2+H2OB. 2Na2O2+2H2O=4NaOH+O2↑C. Zn+CuSO4=ZnSO4+CuD. Ca(OH)2+CO2=CaCO3↓+H2OBC课堂练习2、下列四种基本类型的反应中,一定是氧化还原反应的是( )A.化合反应B.分解反应C.置换反应D.复分解反应C一、氧化还原反应3、下列叙述正确的是( )A.在氧化还原反应中,失去电子的物质,所含元素化合价降低B.凡是有元素化合价升降的化学反应都是氧化还原反应C.在氧化还原反应中一定所有的元素化合价都发生变化D.氧化还原反应的本质是电子的转移(得失或偏移)BD一、氧化还原反应
