人教版(2019)必修第一册 2.1 钠及其化合物 课件(18张ppt)
文档属性
| 名称 | 人教版(2019)必修第一册 2.1 钠及其化合物 课件(18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 11:03:10 | ||
图片预览





文档简介
(共18张PPT)
钠及其化合物
第二课时
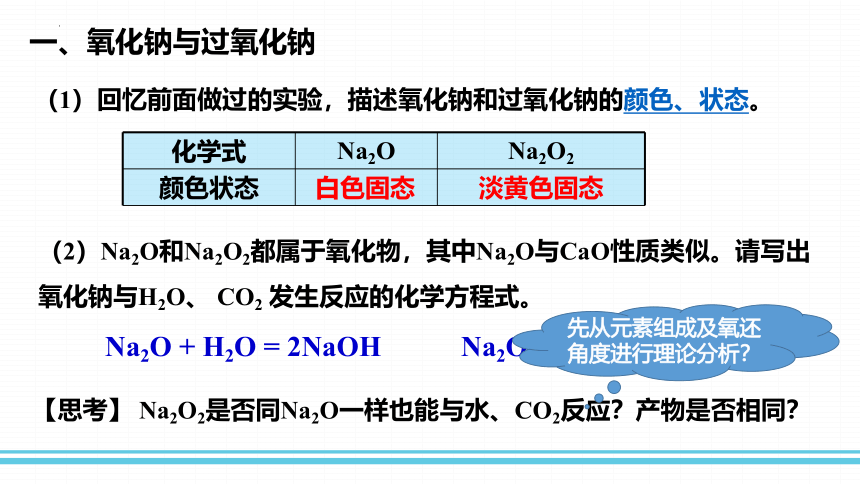
一、氧化钠与过氧化钠
(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
化学式 Na2O Na2O2
颜色状态
白色固态
淡黄色固态
(2)Na2O和Na2O2都属于氧化物,其中Na2O与CaO性质类似。请写出氧化钠与H2O、 CO2 发生反应的化学方程式。
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
【思考】 Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
先从元素组成及氧还角度进行理论分析?
过氧化钠与水的反应
-1 -2 0
2Na2O2+2H2O=4NaOH+O2↑
失去2 X e-,化合价升高,被氧化
得到2 X e-,化合价降低,被还原
既是氧化剂又是还原剂
歧化反应
2e-
2Na2O2+2H2O=4NaOH+O2↑
阅读
过氧化钠及超氧化物(如KO2)与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收空气中的CO2,利用该技术将药板装备于潜艇、宇宙飞船、矿井等密闭环境中,供人们呼吸应急使用。
其主要反应的化学方程式(以Na2O2为例)如下:
2Na2O2+2CO2=2Na2CO3+O2
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
【讨论】如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价,介于氧的中间价态,因此Na2O2既可以表现氧化性又可以表现还原性,但主要以氧化性为主。
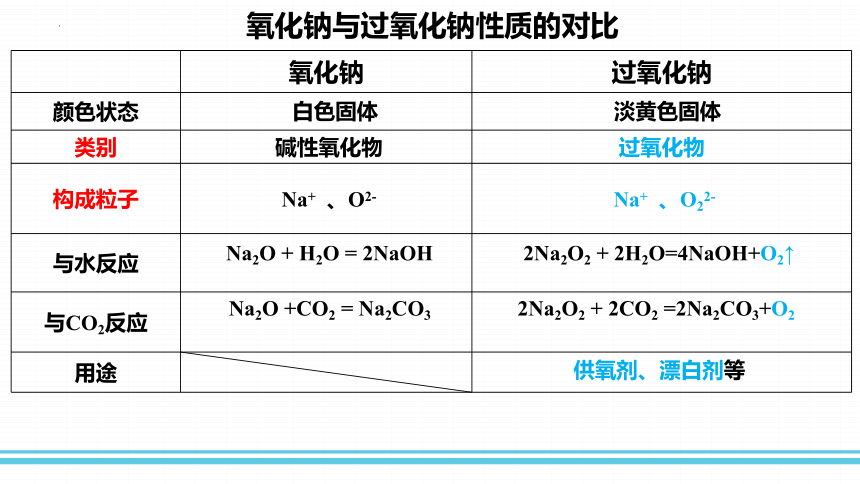
氧化钠与过氧化钠性质的对比
氧化钠 过氧化钠
颜色状态
类别 碱性氧化物 过氧化物
构成粒子 Na+ 、O2- Na+ 、O22-
与水反应
与CO2反应
用途
Na2O + H2O = 2NaOH
Na2O +CO2 = Na2CO3
2Na2O2 + 2H2O=4NaOH+O2↑
2Na2O2 + 2CO2 =2Na2CO3+O2
白色固体
淡黄色固体
供氧剂、漂白剂等
二、碳酸钠(Na2CO3)与碳酸氢钠(NaHCO3)
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
(1)观察两者的外观
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
细小的白色晶体
结块变成晶体
温度上升
少量溶解
温度下降
震荡后可以溶解
固体量有所减少
溶液变红颜色较深
溶液变红颜色较浅
【实验2-4】探究碳酸钠和碳酸氢钠的性质差异
与水形成水合碳酸钠(Na2CO3 xH2O)
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g)
碳酸钠 碳酸氢钠
外观
溶解性 热稳定性 溶液所显性质
用途
【小结】碳酸钠和碳酸氢钠的性质差异
白色粉末
白色细小晶体
碳酸钠 > 碳酸氢钠
滴入酚酞溶液呈红色(碱性)
滴入酚酞溶液呈浅红色(弱碱性)
应用于制药(如治疗胃酸过多)、烘焙糕点
应用于纺织、制皂、造纸、制玻璃等产业
碳酸钠 > 碳酸氢钠
21.5g
9.6g
物质 Na2CO3 NaHCO3
类别
构成微粒
碳酸盐 碳酸氢盐
钠 盐 钠盐
Na+ CO32- Na+ HCO3-
思考
1、厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠?
2、治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠?
碳酸钠:纯碱、苏打 碳酸氢钠:小苏打
化工之母——纯碱
侯德榜和侯氏制碱法
纯碱:碳酸钠(Na2CO3)
【探究】氨碱法(索尔维法)制取纯碱Na2CO3
原料:饱和食盐水、氨气、二氧化碳
原理:NaCl+NH3+CO2+H2O =========== NaHCO3↓+NH4Cl
思考:上述利用了NaHCO3的哪些性质
2 NaHCO3=========== Na2CO3+CO2 ↑+H2O
NaHCO3
方法导引
金属及其化合物的研究思路
代表物
单质
物质类别
研究内容
研究视角
氧化物
氢氧化物
盐
Na
Na2O和Na2O2
NaOH
Na2CO3和NaHCO3
物理性质
化学性质
制法
用途
......
物质分类
反应规律
元素化合价
方法导引
科学探究的步骤和方法
预测
实验
解释和结论
验证预测
作出新的预测
物质类别
元素化合价
反应规律
基于实验证据、
进行分析、归纳、概括、推论
分类法
类比法
观察法
对比法
实验法
归纳法
钠及其化合物
第二课时
一、氧化钠与过氧化钠
(1)回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。
化学式 Na2O Na2O2
颜色状态
白色固态
淡黄色固态
(2)Na2O和Na2O2都属于氧化物,其中Na2O与CaO性质类似。请写出氧化钠与H2O、 CO2 发生反应的化学方程式。
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
【思考】 Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
先从元素组成及氧还角度进行理论分析?
过氧化钠与水的反应
-1 -2 0
2Na2O2+2H2O=4NaOH+O2↑
失去2 X e-,化合价升高,被氧化
得到2 X e-,化合价降低,被还原
既是氧化剂又是还原剂
歧化反应
2e-
2Na2O2+2H2O=4NaOH+O2↑
阅读
过氧化钠及超氧化物(如KO2)与含有CO2和水蒸气的空气接触时,既能产生O2,又能吸收空气中的CO2,利用该技术将药板装备于潜艇、宇宙飞船、矿井等密闭环境中,供人们呼吸应急使用。
其主要反应的化学方程式(以Na2O2为例)如下:
2Na2O2+2CO2=2Na2CO3+O2
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
【讨论】如何理解Na2O、Na2O2性质上的差异?
在Na2O2中,氧是-1价,介于氧的中间价态,因此Na2O2既可以表现氧化性又可以表现还原性,但主要以氧化性为主。
氧化钠与过氧化钠性质的对比
氧化钠 过氧化钠
颜色状态
类别 碱性氧化物 过氧化物
构成粒子 Na+ 、O2- Na+ 、O22-
与水反应
与CO2反应
用途
Na2O + H2O = 2NaOH
Na2O +CO2 = Na2CO3
2Na2O2 + 2H2O=4NaOH+O2↑
2Na2O2 + 2CO2 =2Na2CO3+O2
白色固体
淡黄色固体
供氧剂、漂白剂等
二、碳酸钠(Na2CO3)与碳酸氢钠(NaHCO3)
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
(1)观察两者的外观
(2)分别加入几滴水,观察现象,插入温度计,观察其示数的变化
(3)向(2)的试管中分别加5ml水,用力振荡,观察现象
(4)向(3)所得溶液中分别滴加1-2滴酚酞,观察现象
白色粉末
细小的白色晶体
结块变成晶体
温度上升
少量溶解
温度下降
震荡后可以溶解
固体量有所减少
溶液变红颜色较深
溶液变红颜色较浅
【实验2-4】探究碳酸钠和碳酸氢钠的性质差异
与水形成水合碳酸钠(Na2CO3 xH2O)
20℃时,Na2CO3的溶解度为21.5g,NaHCO3的溶解度为9.6g)
碳酸钠 碳酸氢钠
外观
溶解性 热稳定性 溶液所显性质
用途
【小结】碳酸钠和碳酸氢钠的性质差异
白色粉末
白色细小晶体
碳酸钠 > 碳酸氢钠
滴入酚酞溶液呈红色(碱性)
滴入酚酞溶液呈浅红色(弱碱性)
应用于制药(如治疗胃酸过多)、烘焙糕点
应用于纺织、制皂、造纸、制玻璃等产业
碳酸钠 > 碳酸氢钠
21.5g
9.6g
物质 Na2CO3 NaHCO3
类别
构成微粒
碳酸盐 碳酸氢盐
钠 盐 钠盐
Na+ CO32- Na+ HCO3-
思考
1、厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠?
2、治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠?
碳酸钠:纯碱、苏打 碳酸氢钠:小苏打
化工之母——纯碱
侯德榜和侯氏制碱法
纯碱:碳酸钠(Na2CO3)
【探究】氨碱法(索尔维法)制取纯碱Na2CO3
原料:饱和食盐水、氨气、二氧化碳
原理:NaCl+NH3+CO2+H2O =========== NaHCO3↓+NH4Cl
思考:上述利用了NaHCO3的哪些性质
2 NaHCO3=========== Na2CO3+CO2 ↑+H2O
NaHCO3
方法导引
金属及其化合物的研究思路
代表物
单质
物质类别
研究内容
研究视角
氧化物
氢氧化物
盐
Na
Na2O和Na2O2
NaOH
Na2CO3和NaHCO3
物理性质
化学性质
制法
用途
......
物质分类
反应规律
元素化合价
方法导引
科学探究的步骤和方法
预测
实验
解释和结论
验证预测
作出新的预测
物质类别
元素化合价
反应规律
基于实验证据、
进行分析、归纳、概括、推论
分类法
类比法
观察法
对比法
实验法
归纳法
