人教版(2019)选修第二册 1.1 原子结构 课件(23张ppt)
文档属性
| 名称 | 人教版(2019)选修第二册 1.1 原子结构 课件(23张ppt) |
|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 11:05:49 | ||
图片预览



文档简介
(共23张PPT)
原子结构
1
2
5
3
4
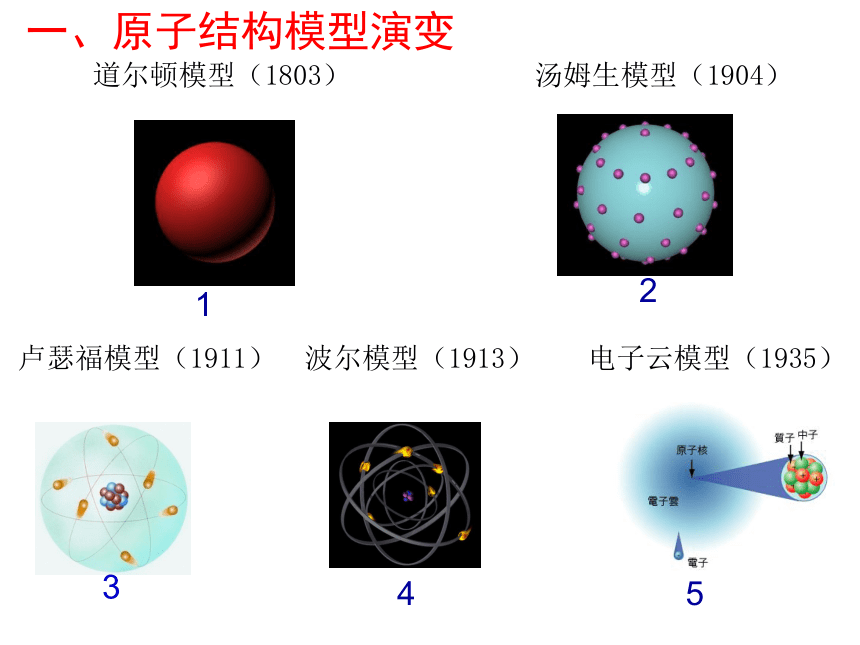
道尔顿模型(1803)
汤姆生模型(1904)
卢瑟福模型(1911)
波尔模型(1913)
电子云模型(1935)
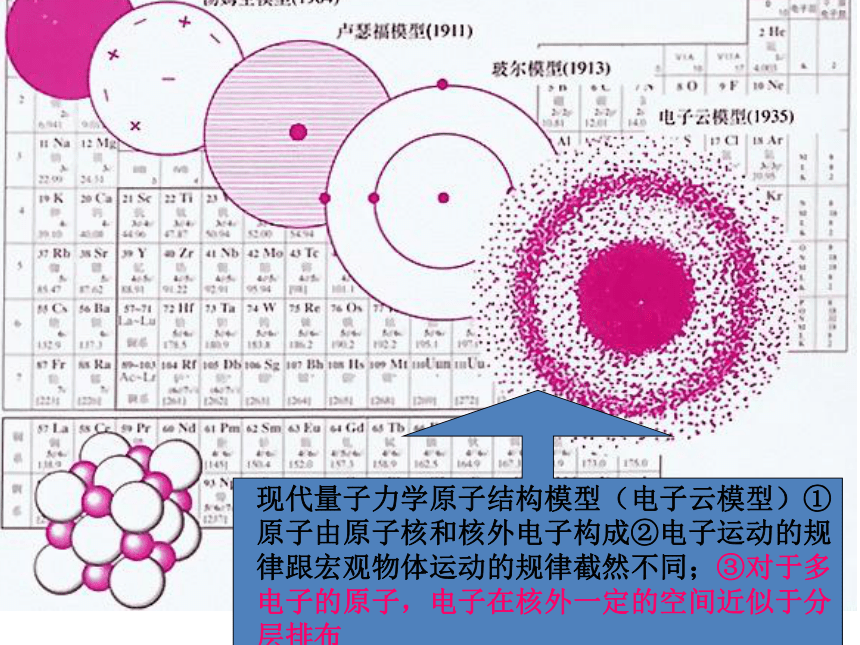
一、原子结构模型演变
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布
(1)电子的质量很小,带负电荷。
(2)电子运动的空间范围小。
(3)电子做高速运动,接近光速。
由于上述原因,核外电子的运动规律与
宏观物体不同:它没有确定的轨道,我
们不能测定或计算它在某一时刻所在的
位置,也不能描绘出它的运动轨道。
资料:核外电子运动的特点:
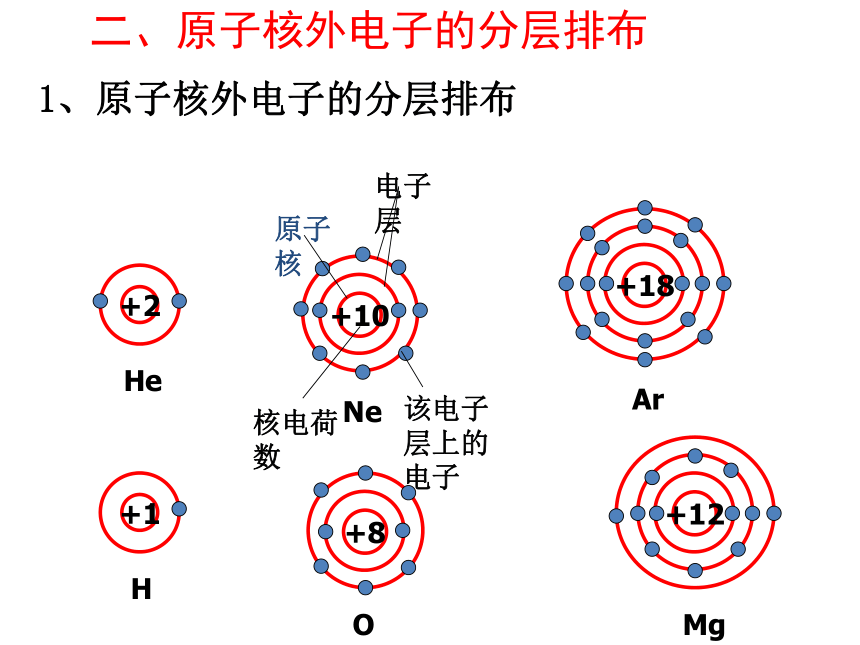
二、原子核外电子的分层排布
+2
He
+18
Ar
1、原子核外电子的分层排布
+10
Ne
该电子层上的电子
核电荷数
电子层
原子核
+1
H
+8
O
+12
Mg
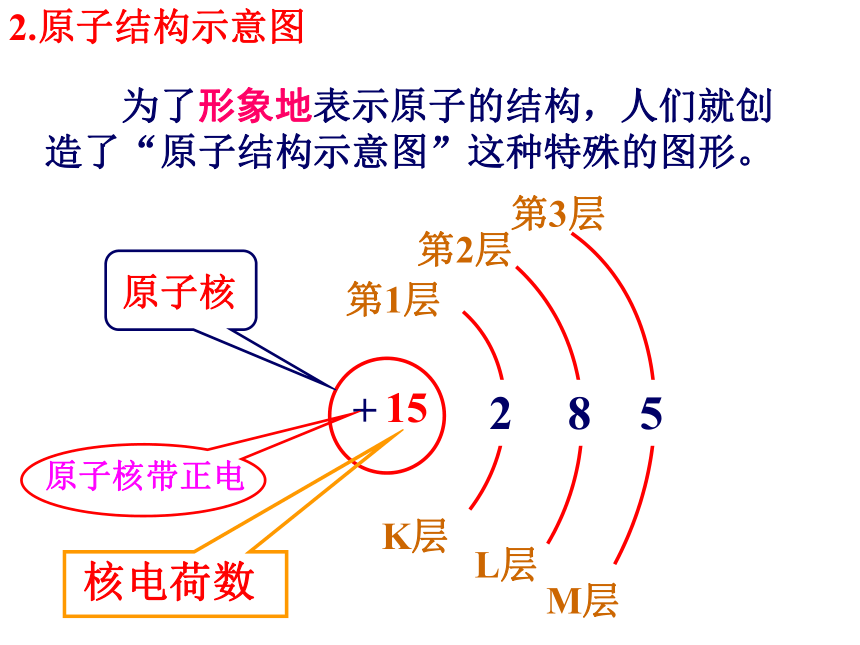
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
核电荷数
2
8
5
2.原子结构示意图
3、原子核外电子排布规律(完成书本P93思考与讨论)
① 电子总是尽先排布在能量最低的电子层里, 由里到外(能量最低原理)
先排K层,排满K层后再排L层,排满L层后再排M层
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子
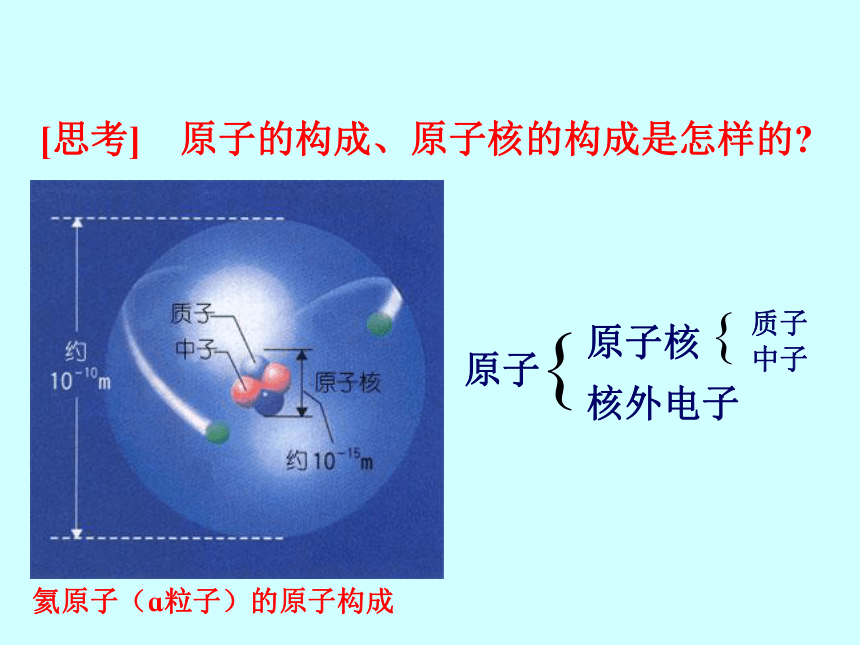
[思考] 原子的构成、原子核的构成是怎样的
原子
原子核
核外电子
质子
中子
{
{
氦原子(ɑ粒子)的原子构成
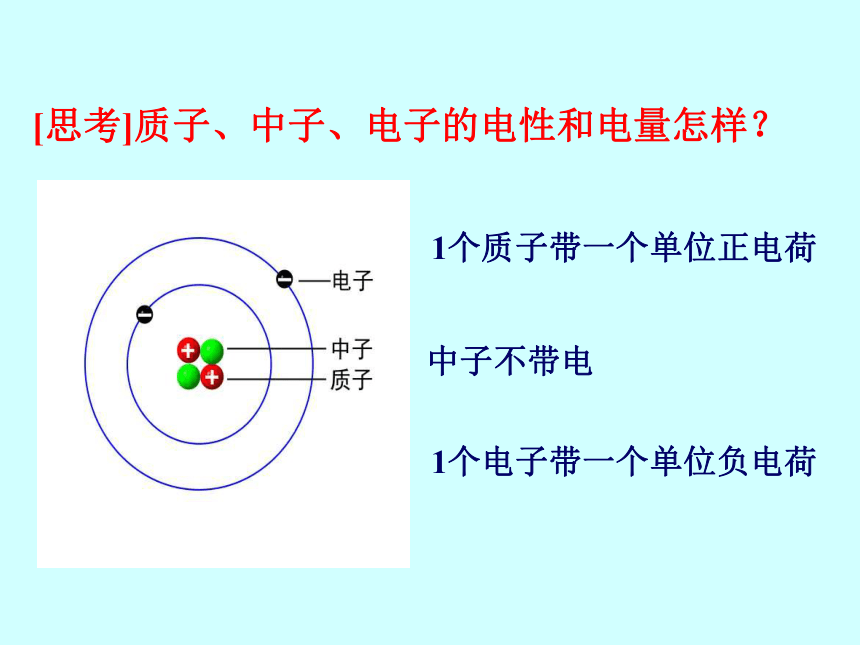
[思考]质子、中子、电子的电性和电量怎样?
1个质子带一个单位正电荷
中子不带电
1个电子带一个单位负电荷
阅读表1-7,质子、中子、电子的电性和电量怎样?比较三种粒子的质量大小、带电荷情况。什么是相对质量?
质量/kg 相对质量 电量/C
质子 1 .673 x 10-27 1.007 1.602 x 10-19
中子 1.675 x 10-27 1.008 0
电子 9.109 x 10-31 1/1 836 1.602 x 10-19
质子、中子的相对质量分别为质子和中子的质量与C-12原子质量(1.9932 x 10-26Kg)的1/12相比较所得的数值。
原子 质子数(Z) 中子数
(N) 质子数+中子数(A) 相对原子
质 量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
表1-8 几种原子的质子数、中子数和相对原子质量
什么是质量数?AX的含义是什么?
z
19
23
27
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。
质量数(A)=质子数(Z)+中子数(N)
核电荷数=核内质子数=核外电子数=原子序数
三、质量关系和电量关系
那么离子呢?
C-12原子指的是什么原子?
16O的含义是什么?与O的含义是否一样?
8
A、Z、c、d、e各代表什么?
A——代表质量数;
Z——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数
A
Z
X
c+
-
-
+d
e
请指出Al、Al3+中所含的质子数和电子数。
四、原子符号
什么是核素?什么是同位素?
阅读p96-97
元素:具有相同质子数的同一类原子的总称。
同位素:质子数相同而中子数不同的核素互称为同位素。
17 Cl ,
35
17 Cl
37
6 C ,
13
6 C ,
12
6 C
14
8 O ,
16
8 O ,
17
8 O
18
核素:具有一定质子数和一定中子数的一种原子。
1H ,
1
1H ,
2
1H
3
氕(pie),氘(dao),氚(chuan)
H
D
T
4、关于元素与同位素的区别和联系
元素 同位素
区别 (1)是具有相同核电荷数的同一类原子的总称H、H+、H等都是氢元素的粒子。
(2)是宏观概念,只表示种类,没有数量含义。 (1)是质子数相同,中子数不同的同一类原子的总称。H(H)、H(D)、H(T)等都是氢元素的同位素。
(2)大多数元素存在同位素。各元素的稳定同位素在自然界中的原子百分组成保持不变。
联系 同一元素的各种同位素,核外电子排布相同,虽然原子种类不同,但化学性质相同。
5、原子和离子的区别和联系
原子 离子
区别 (1)除稀有气体的原子外其余原子为不稳定结构。
(2)电中性。
(3)同种原子半径大小相同,不同原子半径不同。
(4)是化学变化的最小微粒,有自己的性质,可独立存在。 (1)主族元素的简单离子为稳定结构。
(2)阳离子带正电荷。比同种元素的原子少一个电子层,阴离子带负电荷,与同种元素原子的电子层数相同。
(3)阳离子半径小于相应的原子,阴离子半径大于相应的原子。
(4)是带电的原子或原子团。性质与原子不同,阳离子与阴离子共存。
联系 核电荷数相同的原子和离子属于同种元素。在一定条件下同种元素的原子和离子可互变。
6、四种相对原子质量
(1)核素的相对原子质量:是国际上统一的用某种元素的某种同位素原子的绝对质量与12C原子绝对质量的 比较而得的比值,
即同位素相对原子质量=
(2)原子的近似相对原子质量:即质量数,是同位素原子的质子数与中子数之和。
(3)元素的相对原子质量:指某元素各种同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和。
(4)元素的近似相对原子质量:指某元素各同位素的质量数与该同位素原子所占原子个数百分比的乘积之和。
35Cl 34.969 75.77% 35Cl 35 75.77%
37Cl 36.966 24.23% 37Cl 37 24.23%
35.453 35.485
(1)34.969表示____________________
(2)35表示_______________
(3)35.453计算等式__________________________
表示____________________
35.485计算等式为_____________________
表示__________________________
35Cl的相对原子质量
35Cl的质量数
34.969×75.77%+36.966×24.23%
氯元素的相对原子质量
35×75.77%+37×24.23%
氯元素的近似相对原子质量
例题2:某微粒用 Xn-表示。下列关于该粒子的叙述中正确的是( )
A 所含的质子数=A-n
B 所含中子数=A-Z
C 所含电子数=Z-n
D 质量数=A+Z
B
例题3:已知R2+核内共有N个中子,R的质量数为A,mgR2+中含电子的物质的量为( )
A B
C D
D
原子结构
1
2
5
3
4
道尔顿模型(1803)
汤姆生模型(1904)
卢瑟福模型(1911)
波尔模型(1913)
电子云模型(1935)
一、原子结构模型演变
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布
(1)电子的质量很小,带负电荷。
(2)电子运动的空间范围小。
(3)电子做高速运动,接近光速。
由于上述原因,核外电子的运动规律与
宏观物体不同:它没有确定的轨道,我
们不能测定或计算它在某一时刻所在的
位置,也不能描绘出它的运动轨道。
资料:核外电子运动的特点:
二、原子核外电子的分层排布
+2
He
+18
Ar
1、原子核外电子的分层排布
+10
Ne
该电子层上的电子
核电荷数
电子层
原子核
+1
H
+8
O
+12
Mg
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+
15
第1层
第2层
第3层
K层
L层
M层
原子核
原子核带正电
核电荷数
2
8
5
2.原子结构示意图
3、原子核外电子排布规律(完成书本P93思考与讨论)
① 电子总是尽先排布在能量最低的电子层里, 由里到外(能量最低原理)
先排K层,排满K层后再排L层,排满L层后再排M层
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外层时不能超过2个
倒数第三层最多只能容纳32个电子
[思考] 原子的构成、原子核的构成是怎样的
原子
原子核
核外电子
质子
中子
{
{
氦原子(ɑ粒子)的原子构成
[思考]质子、中子、电子的电性和电量怎样?
1个质子带一个单位正电荷
中子不带电
1个电子带一个单位负电荷
阅读表1-7,质子、中子、电子的电性和电量怎样?比较三种粒子的质量大小、带电荷情况。什么是相对质量?
质量/kg 相对质量 电量/C
质子 1 .673 x 10-27 1.007 1.602 x 10-19
中子 1.675 x 10-27 1.008 0
电子 9.109 x 10-31 1/1 836 1.602 x 10-19
质子、中子的相对质量分别为质子和中子的质量与C-12原子质量(1.9932 x 10-26Kg)的1/12相比较所得的数值。
原子 质子数(Z) 中子数
(N) 质子数+中子数(A) 相对原子
质 量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
表1-8 几种原子的质子数、中子数和相对原子质量
什么是质量数?AX的含义是什么?
z
19
23
27
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数。
质量数(A)=质子数(Z)+中子数(N)
核电荷数=核内质子数=核外电子数=原子序数
三、质量关系和电量关系
那么离子呢?
C-12原子指的是什么原子?
16O的含义是什么?与O的含义是否一样?
8
A、Z、c、d、e各代表什么?
A——代表质量数;
Z——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数
A
Z
X
c+
-
-
+d
e
请指出Al、Al3+中所含的质子数和电子数。
四、原子符号
什么是核素?什么是同位素?
阅读p96-97
元素:具有相同质子数的同一类原子的总称。
同位素:质子数相同而中子数不同的核素互称为同位素。
17 Cl ,
35
17 Cl
37
6 C ,
13
6 C ,
12
6 C
14
8 O ,
16
8 O ,
17
8 O
18
核素:具有一定质子数和一定中子数的一种原子。
1H ,
1
1H ,
2
1H
3
氕(pie),氘(dao),氚(chuan)
H
D
T
4、关于元素与同位素的区别和联系
元素 同位素
区别 (1)是具有相同核电荷数的同一类原子的总称H、H+、H等都是氢元素的粒子。
(2)是宏观概念,只表示种类,没有数量含义。 (1)是质子数相同,中子数不同的同一类原子的总称。H(H)、H(D)、H(T)等都是氢元素的同位素。
(2)大多数元素存在同位素。各元素的稳定同位素在自然界中的原子百分组成保持不变。
联系 同一元素的各种同位素,核外电子排布相同,虽然原子种类不同,但化学性质相同。
5、原子和离子的区别和联系
原子 离子
区别 (1)除稀有气体的原子外其余原子为不稳定结构。
(2)电中性。
(3)同种原子半径大小相同,不同原子半径不同。
(4)是化学变化的最小微粒,有自己的性质,可独立存在。 (1)主族元素的简单离子为稳定结构。
(2)阳离子带正电荷。比同种元素的原子少一个电子层,阴离子带负电荷,与同种元素原子的电子层数相同。
(3)阳离子半径小于相应的原子,阴离子半径大于相应的原子。
(4)是带电的原子或原子团。性质与原子不同,阳离子与阴离子共存。
联系 核电荷数相同的原子和离子属于同种元素。在一定条件下同种元素的原子和离子可互变。
6、四种相对原子质量
(1)核素的相对原子质量:是国际上统一的用某种元素的某种同位素原子的绝对质量与12C原子绝对质量的 比较而得的比值,
即同位素相对原子质量=
(2)原子的近似相对原子质量:即质量数,是同位素原子的质子数与中子数之和。
(3)元素的相对原子质量:指某元素各种同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和。
(4)元素的近似相对原子质量:指某元素各同位素的质量数与该同位素原子所占原子个数百分比的乘积之和。
35Cl 34.969 75.77% 35Cl 35 75.77%
37Cl 36.966 24.23% 37Cl 37 24.23%
35.453 35.485
(1)34.969表示____________________
(2)35表示_______________
(3)35.453计算等式__________________________
表示____________________
35.485计算等式为_____________________
表示__________________________
35Cl的相对原子质量
35Cl的质量数
34.969×75.77%+36.966×24.23%
氯元素的相对原子质量
35×75.77%+37×24.23%
氯元素的近似相对原子质量
例题2:某微粒用 Xn-表示。下列关于该粒子的叙述中正确的是( )
A 所含的质子数=A-n
B 所含中子数=A-Z
C 所含电子数=Z-n
D 质量数=A+Z
B
例题3:已知R2+核内共有N个中子,R的质量数为A,mgR2+中含电子的物质的量为( )
A B
C D
D
