人教版(2019)必修第一册 1.1 物质的分类及转化 课件(23张ppt)
文档属性
| 名称 | 人教版(2019)必修第一册 1.1 物质的分类及转化 课件(23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 11:11:55 | ||
图片预览





文档简介
(共23张PPT)
第一章 物质及其转化
物质的分类及转化
离子反应
氧化还原反应
丰富多彩的物质世界
C
Cl2用于漂白
固态、液态、气态物质
有规则几何外形的晶体
S
Cu
Si
色态各异的单质
水果含有可食用的有机化合物
铜、铁是重要的材料
粮食生产需要肥料和农药
有机高分子材料制造的日用品
高能燃料送神十上天
元素:118种
单质:150种(估算)
化合物:
2019年5月8日,美国化学文摘社(CAS)注册了第1.5亿个独特的化学物质——2-氨基嘧啶甲腈衍生物,这是癌症和免疫疾病(包括类风湿性关节炎、系统性红斑狼疮、狼疮肾炎)治疗过程中作为TBK和IKKε抑制剂研究的几种具有前景的化合物之一。
自然界存在的物质种类繁多,人工合成的物 质种类正在急剧增加,面对丰富多彩、不断变化的物质世界,我们应怎样研究物质的组成、结构和变化呢?
将众多物质进行分类
方法导引——分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的组成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
一、物质的分类
讨论:在我们日常生活中,常会接触到下列物质:
空气、泥浆、乙醇(CH3CH2OH)、水、硫酸铵、铜、碘酒、碘(I2)、
氧气、石墨、生理盐水(0.9%的氯化钠水溶液)
请你将上述物质进行分类,并说明分类的依据。
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
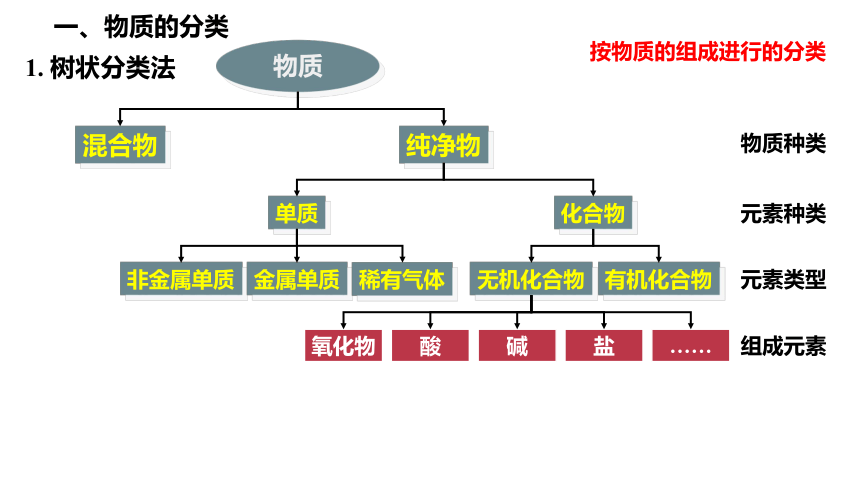
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
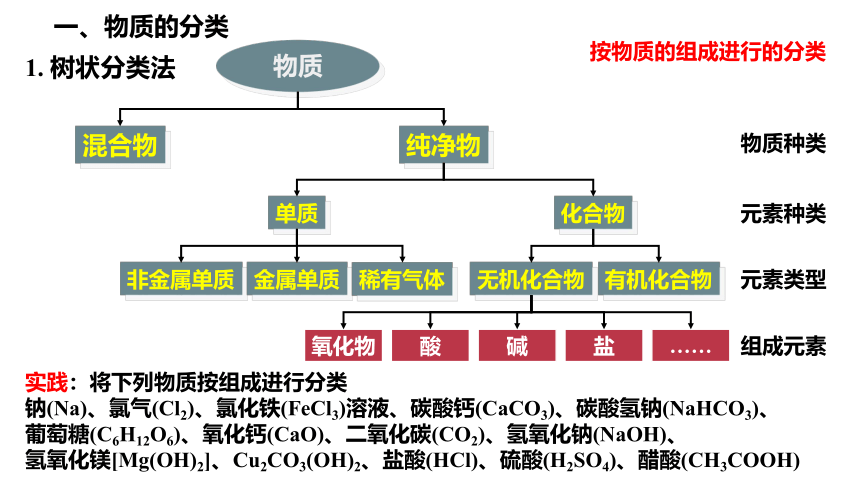
实践:将下列物质按组成进行分类
钠(Na)、氯气(Cl2)、氯化铁(FeCl3)溶液、碳酸钙(CaCO3)、碳酸氢钠(NaHCO3)、
葡萄糖(C6H12O6)、氧化钙(CaO)、二氧化碳(CO2)、氢氧化钠(NaOH)、
氢氧化镁[Mg(OH)2]、Cu2CO3(OH)2、盐酸(HCl)、硫酸(H2SO4)、醋酸(CH3COOH)
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
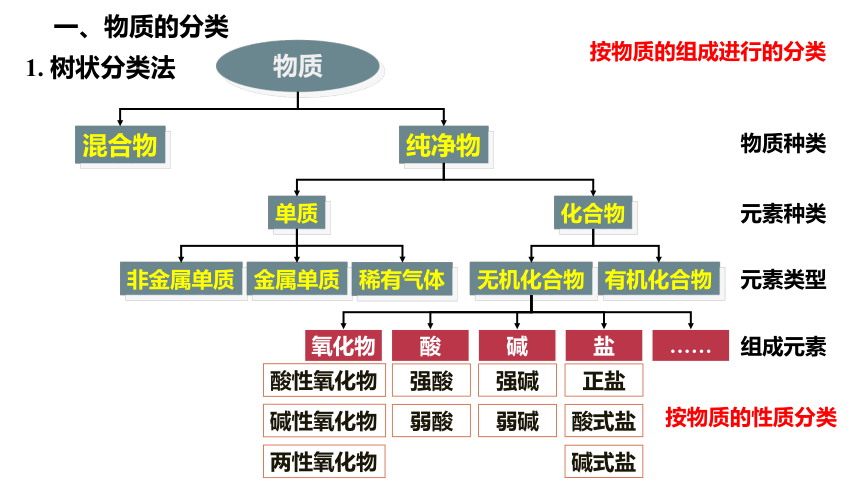
酸性氧化物
碱性氧化物
两性氧化物
强酸
弱酸
强碱
弱碱
正盐
酸式盐
碱式盐
按物质的性质分类
一、物质的分类
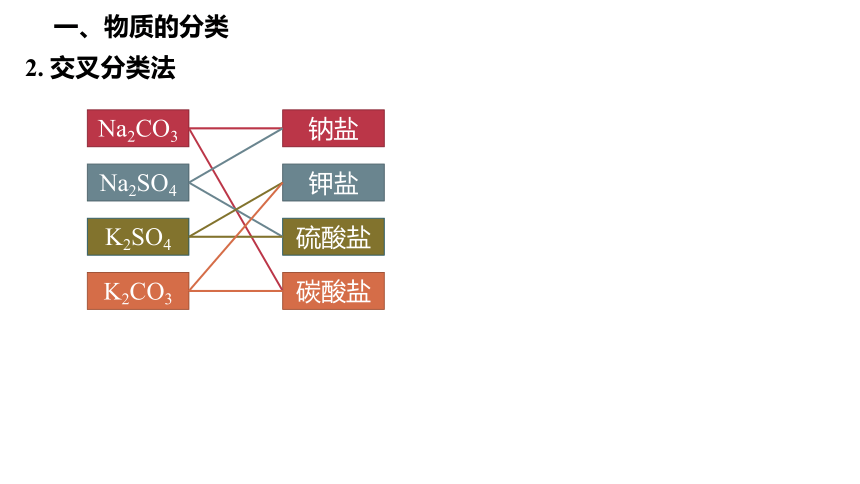
2. 交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠盐
钾盐
硫酸盐
碳酸盐
一、物质的分类
思考:按下列物质的组成进行分类,并预测物质的性质
H5IO6
Al2O3
Mg(OH)2
化合物
非电解质
电解质
一、物质的分类
按物质的组成和性质进行的分类
按物质的结构和用途进行分类也是重要方法
知识回顾:
请从不同的角度对下列六种酸进行分类:
醋酸(CH3COOH)
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
磷酸(H3PO4)
氢硫酸(H2S)
物质
混合物
纯净物
均匀混合物
非均匀混合物
一、物质的分类
树状分类法
溶液
胶体
乳浊液
悬浊液
分散系
分散质
分散剂
分散系 溶液 胶体 乳浊液 悬浊液
分散质 溶质,如离子、小分子 胶体粒子 液体小液滴 固体小颗粒
分散剂 溶剂,如水、乙醇等 如水、乙醇等 如水 如水
物质的分散系及其分类
溶液 胶体 悬浊液 乳浊液
分散质微粒组成 小分子、离子 多分子集合体 大分子集合体
分散质微粒直径 <10-9 m (<1nm) 10-9~10-7 m (1~100 nm) >10-7 m (>100nm) 外观性状 澄清透明 澄清透明 浑浊不透明
稳定性 稳定 稳定 不稳定 分层或沉降
能否透过滤纸 能 能 不能
能否透过半透膜 能 不能 不能
举例 NaCl溶液 Fe(OH)3胶体 泥浆水 牛奶
三大分散系比较:
胶体的性质
实验1-1
取两个100 mL小烧杯,分别加入40 mL蒸馏水和40 mL CuSO4溶液。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热。观察制得的Fe(OH)3胶体。
把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用红色激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,并记录现象。
清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,类似这种自然界的现象,就是丁达尔效应。
云、雾——气溶胶
烟水晶——固溶胶
胶体的应用:
1、农业生产:土壤的保肥作用。土壤里许多物质如粘土,腐殖质等常以胶体形式存在。
2、医疗卫生:血液透析,此外医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
3、日常生活:制豆腐原理(胶体的聚沉),明矾净水.
4、自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉.
5、工业生产:制有色玻璃(由某些胶态金属氧化物分散于玻璃中制成的固溶胶),冶金工业利用电泳原理选矿,原油脱水等.在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改进材料的光学性质。国防工业中有些火药、炸药须制成胶体。一些纳米材料的制备,冶金工业中的选矿,是有原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
应用:
胶体净化、提纯使胶体和溶液分离
拓展视野——胶体的分离(净化)
怎么样来分离淀粉胶体和NaCl溶液?
渗析
为满足人类生活和生产需要,化学家在物质分类研究的基础上,进一步研究了物质转化的规律,以利用化学反应制备更多人类需要的新物质。
单质→化合物:
碱性氧化物→碱:
酸性氧化物→酸:
酸+碱→盐:
酸+活泼金属:
酸+碱性氧化物:
酸+某些盐:
……
交流与讨论
二、物质的转化
二、物质的转化
思考:根据所学知识设计下列物质转化实现途径,并写出有关的化学方程式。
Ca→CaSO4
C→CaCO3
二、物质的转化
实践:NaOH是重要的化学试剂,结合所学知识,尽可能多地写出NaOH制取反应方程式。并考虑反应进行的可能性、原料来源、成本高低和设备要求等因素,选取适合工业生产的方法。
思考:下列反应中哪些属于四种基本反应类型中的哪种?
Zn + H2SO4 == ZnSO4 + H2↑
Fe2O3 + 3CO == Fe + 3CO2
Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
CaO + H2O == Ca(OH)2
2H2O2 == 2H2O + O2↑
2H2 + O2 == 2H2O
3Cu + 8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
高温
MnO2
点燃
哪些是氧化还原反应?
有人认为,化合反应、分解反应、置换反应均是氧化还原反应,你同意这种说法吗?为什么?
二、物质的转化
写出下列反应的反应方程式
二氧化碳和水转化成葡萄糖(C6H12O6)和氧气
氧化铁(Fe2O3)和CO反应生成铁和二氧化碳
氧化铜和H2反应生成红色的铜和水
投入到CuSO4溶液中的锌片表面出现红色物质
Na2SO4溶液与BaCl2溶液混合出现白色浑浊
Na2CO3溶液与盐酸反应产生无色无味气体
稀硫酸和NaOH溶液反应
物质间发生转化往往需要一定的条件
光照条件下
高温条件下
加热条件下
常温条件下
二、物质的转化
第一章 物质及其转化
物质的分类及转化
离子反应
氧化还原反应
丰富多彩的物质世界
C
Cl2用于漂白
固态、液态、气态物质
有规则几何外形的晶体
S
Cu
Si
色态各异的单质
水果含有可食用的有机化合物
铜、铁是重要的材料
粮食生产需要肥料和农药
有机高分子材料制造的日用品
高能燃料送神十上天
元素:118种
单质:150种(估算)
化合物:
2019年5月8日,美国化学文摘社(CAS)注册了第1.5亿个独特的化学物质——2-氨基嘧啶甲腈衍生物,这是癌症和免疫疾病(包括类风湿性关节炎、系统性红斑狼疮、狼疮肾炎)治疗过程中作为TBK和IKKε抑制剂研究的几种具有前景的化合物之一。
自然界存在的物质种类繁多,人工合成的物 质种类正在急剧增加,面对丰富多彩、不断变化的物质世界,我们应怎样研究物质的组成、结构和变化呢?
将众多物质进行分类
方法导引——分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的组成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
一、物质的分类
讨论:在我们日常生活中,常会接触到下列物质:
空气、泥浆、乙醇(CH3CH2OH)、水、硫酸铵、铜、碘酒、碘(I2)、
氧气、石墨、生理盐水(0.9%的氯化钠水溶液)
请你将上述物质进行分类,并说明分类的依据。
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
实践:将下列物质按组成进行分类
钠(Na)、氯气(Cl2)、氯化铁(FeCl3)溶液、碳酸钙(CaCO3)、碳酸氢钠(NaHCO3)、
葡萄糖(C6H12O6)、氧化钙(CaO)、二氧化碳(CO2)、氢氧化钠(NaOH)、
氢氧化镁[Mg(OH)2]、Cu2CO3(OH)2、盐酸(HCl)、硫酸(H2SO4)、醋酸(CH3COOH)
物质
混合物
纯净物
单质
化合物
有机化合物
无机化合物
非金属单质
金属单质
氧化物
酸
碱
盐
……
按物质的组成进行的分类
一、物质的分类
1. 树状分类法
稀有气体
物质种类
元素种类
元素类型
组成元素
酸性氧化物
碱性氧化物
两性氧化物
强酸
弱酸
强碱
弱碱
正盐
酸式盐
碱式盐
按物质的性质分类
一、物质的分类
2. 交叉分类法
Na2CO3
Na2SO4
K2SO4
K2CO3
钠盐
钾盐
硫酸盐
碳酸盐
一、物质的分类
思考:按下列物质的组成进行分类,并预测物质的性质
H5IO6
Al2O3
Mg(OH)2
化合物
非电解质
电解质
一、物质的分类
按物质的组成和性质进行的分类
按物质的结构和用途进行分类也是重要方法
知识回顾:
请从不同的角度对下列六种酸进行分类:
醋酸(CH3COOH)
盐酸(HCl)
硫酸(H2SO4)
硝酸(HNO3)
磷酸(H3PO4)
氢硫酸(H2S)
物质
混合物
纯净物
均匀混合物
非均匀混合物
一、物质的分类
树状分类法
溶液
胶体
乳浊液
悬浊液
分散系
分散质
分散剂
分散系 溶液 胶体 乳浊液 悬浊液
分散质 溶质,如离子、小分子 胶体粒子 液体小液滴 固体小颗粒
分散剂 溶剂,如水、乙醇等 如水、乙醇等 如水 如水
物质的分散系及其分类
溶液 胶体 悬浊液 乳浊液
分散质微粒组成 小分子、离子 多分子集合体 大分子集合体
分散质微粒直径 <10-9 m (<1nm) 10-9~10-7 m (1~100 nm) >10-7 m (>100nm) 外观性状 澄清透明 澄清透明 浑浊不透明
稳定性 稳定 稳定 不稳定 分层或沉降
能否透过滤纸 能 能 不能
能否透过半透膜 能 不能 不能
举例 NaCl溶液 Fe(OH)3胶体 泥浆水 牛奶
三大分散系比较:
胶体的性质
实验1-1
取两个100 mL小烧杯,分别加入40 mL蒸馏水和40 mL CuSO4溶液。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。继续煮沸至液体呈红褐色,停止加热。观察制得的Fe(OH)3胶体。
把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用红色激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,并记录现象。
清晨,在茂密的树林中,常常可以看到从枝叶间透过的一道道光柱,类似这种自然界的现象,就是丁达尔效应。
云、雾——气溶胶
烟水晶——固溶胶
胶体的应用:
1、农业生产:土壤的保肥作用。土壤里许多物质如粘土,腐殖质等常以胶体形式存在。
2、医疗卫生:血液透析,此外医学上越来越多地利用高度分散的胶体来检验或治疗疾病,如胶态磁流体治癌术是将磁性物质制成胶体粒子,作为药物的载体,在磁场作用下将药物送到病灶,从而提高疗效。
3、日常生活:制豆腐原理(胶体的聚沉),明矾净水.
4、自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉.
5、工业生产:制有色玻璃(由某些胶态金属氧化物分散于玻璃中制成的固溶胶),冶金工业利用电泳原理选矿,原油脱水等.在金属、陶瓷、聚合物等材料中加入固态胶体粒子,不仅可以改进材料的耐冲击强度、耐断裂强度、抗拉强度等机械性能,还可以改进材料的光学性质。国防工业中有些火药、炸药须制成胶体。一些纳米材料的制备,冶金工业中的选矿,是有原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体。
应用:
胶体净化、提纯使胶体和溶液分离
拓展视野——胶体的分离(净化)
怎么样来分离淀粉胶体和NaCl溶液?
渗析
为满足人类生活和生产需要,化学家在物质分类研究的基础上,进一步研究了物质转化的规律,以利用化学反应制备更多人类需要的新物质。
单质→化合物:
碱性氧化物→碱:
酸性氧化物→酸:
酸+碱→盐:
酸+活泼金属:
酸+碱性氧化物:
酸+某些盐:
……
交流与讨论
二、物质的转化
二、物质的转化
思考:根据所学知识设计下列物质转化实现途径,并写出有关的化学方程式。
Ca→CaSO4
C→CaCO3
二、物质的转化
实践:NaOH是重要的化学试剂,结合所学知识,尽可能多地写出NaOH制取反应方程式。并考虑反应进行的可能性、原料来源、成本高低和设备要求等因素,选取适合工业生产的方法。
思考:下列反应中哪些属于四种基本反应类型中的哪种?
Zn + H2SO4 == ZnSO4 + H2↑
Fe2O3 + 3CO == Fe + 3CO2
Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
CaO + H2O == Ca(OH)2
2H2O2 == 2H2O + O2↑
2H2 + O2 == 2H2O
3Cu + 8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
高温
MnO2
点燃
哪些是氧化还原反应?
有人认为,化合反应、分解反应、置换反应均是氧化还原反应,你同意这种说法吗?为什么?
二、物质的转化
写出下列反应的反应方程式
二氧化碳和水转化成葡萄糖(C6H12O6)和氧气
氧化铁(Fe2O3)和CO反应生成铁和二氧化碳
氧化铜和H2反应生成红色的铜和水
投入到CuSO4溶液中的锌片表面出现红色物质
Na2SO4溶液与BaCl2溶液混合出现白色浑浊
Na2CO3溶液与盐酸反应产生无色无味气体
稀硫酸和NaOH溶液反应
物质间发生转化往往需要一定的条件
光照条件下
高温条件下
加热条件下
常温条件下
二、物质的转化
