【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第2课时 碱金属元素(55张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第2课时 碱金属元素(55张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 686.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:00:58 | ||
图片预览











文档简介
课件55张PPT。第一节 元素周期表
第2课时 碱金属元素物质结构 元素周期律第2课时 碱金属元素碱金属元素的发现
碱金属元素包括锂、钠、钾、铷、铯、钫,它们被发现的次序是钾、钠、锂、铷、铯、钫。
钾和钠都是在1807年由戴维发现的。他电解熔融的氢氧化钾时,发现阴极表面上出现有金属光泽、酷似水银滴的颗粒,有的颗粒刚形成就燃烧掉了,发出火焰,并发生爆炸。有的颗粒逐渐失去光泽,表面形成一层白色薄膜。这种小的金属颗粒投进水里,即出现火焰。戴维确定它是一种新的元素,因为是从钾碱(potash)制得的,所以定名为钾(potassium)。
同年,戴维又电解氢氧化钠而制得金属钠。
1817年阿尔费特孙(Arfvedson)从矿石分析中确定了锂元素的存在。锂的火焰颜色在1818年由格美林(Gmelin)发现。他们都没有能制出锂的单质。1818年,布朗得斯(Brandes)和戴维电解氧化锂,制得了少量金属锂。一直到1855年,本生(Bunsen)和马提生(Mattiessen)用电解氯化锂的方法才制得较多的锂。1893年根茨(Guntz)提出在400 ℃时电解熔融的LiCl(55%)、KCl(45%)电解液制锂,这种原理应用到生产上,一直沿用到现在。
1860年克希荷夫(Kirchhoff)和本生研究碱金属光谱时,发现蓝色区域有明亮的光谱线,他们把显示这种光谱线的元素叫铯,意思是“天蓝”。1861年,克希荷夫和本生又在暗红色区域发现新的光谱线,他们把显示这种光谱线的元素叫铷,意思是“暗红”。钫这种在碱金属中密度最大的元素,在理论上和性质上都早就相当明了地被预见了。但一直到1939年,贝赫蕾(Perrey)才发现了这第87号元素的一个半衰期很短的同位素223Fr,它是从235U衰变为227Ac,227Ac又经a-衰变而成的。贝赫蕾是法国人,她为了祖国的荣誉命名它为钫,意思是“法兰西”。
碱金属元素在结构和性质上有什么相似性和递变性呢?1.了解碱金属元素的原子结构及特点。
2.了解碱金属元素化学性质的相似性及递变性。
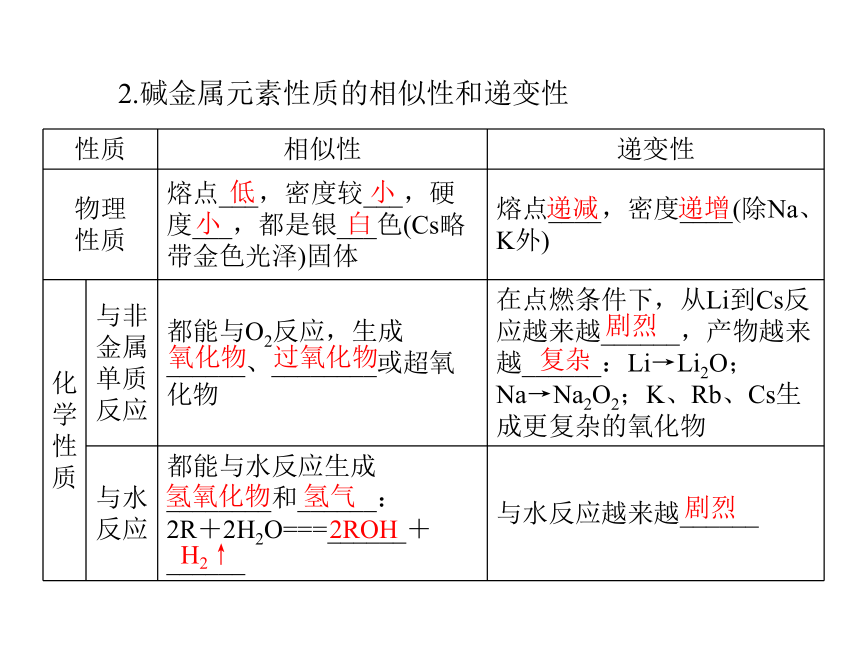
3.认识结构决定物质性质的因果关系。碱金属元素1.碱金属元素原子结构的相似性和递变性一个 失去+1 还原增多增大减弱 增强2.碱金属元素性质的相似性和递变性低 小小 白递减 递增氧化物 过氧化物剧烈复杂氢氧化物 氢气2ROHH2↑剧烈3.原子结构与性质之间的关系+1增大 增强 增强应用思考:1.结合钠、钾的性质,应如何保存单质钾?
2.什么是元素的金属性?提示:因K与O2、H2O等发生反应,故应密闭保存,又因为K密度比煤油大且二者不反应,所以同Na一样,K也常保存在煤油中。 提示:金属性是指元素的原子失去电子难易程度的性质,即元素的原子越易失电子,元素的金属性就越强。知识拓展一、碱金属元素性质相似性与递变性的比较(续上表)(续上表)特别关注:Na、K与盐溶液的反应:
因Na、K等很活泼的金属易与H2O反应,故当Na、K投入到盐溶液中时,不是从溶液中置换出相对不活泼的金属,而是先与水发生反应生成碱与氢气,然后生成的碱再与盐发生复分解反应(若不符合复分解反应的条件,则只发生金属与水的反应)。二、金属性强弱的比较
1.根据原子结构:原子半径越大,金属性越强,反之则越弱。
2.根据元素在周期表中的位置:同周期元素,从左至右,随着原子序数的增加,金属性逐渐减弱,非金属性逐渐增强;同主族元素,从上至下,随着原子序数的增加,金属性逐渐增强,非金属性逐渐减弱。3.根据实验结论
(1)与水或酸反应置换出氢的难易:金属单质与水或酸(非氧化性酸)反应置换出氢的速率越快(反应越剧烈),表明元素金属性越强。
(2)最高价氧化物对应水化物的碱性强弱:碱性越强,表明该元素金属性越强。
(3)置换反应:一种金属能把另一种金属从它的盐溶液里置换出来,表明前一种金属元素比后一种金属元素的金属性强。(4)单质的还原性强弱:还原性越强,则金属性越强。
(5)离子的氧化性强弱:离子的氧化性越强,则对应金属元素的金属性越弱。
4.根据金属活动性顺序表:一般来说,排在前面的金属的金属性较强。特别关注:(1)如某金属元素金属性越强,则单质与水(或酸)反应就越剧烈,最高价氧化物的水化物碱性越强。
(2)金属性强弱的比较,是比较原子失去电子的难易,而不是失去电子的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。尝试应用1.(双选题)金属钠比金属钾( )
A.金属性强 B.还原性弱
C.原子半径大 D.熔点高解析:碱金属中,随原子序数递增,金属性增强,还原性增强,原子半径增大,熔、沸点降低。
答案:BD 2.下列四种演示金属钾与水反应的实验装置,正确的是( )解析:钾与水反应剧烈,从安全角度来看,用B装置反应空间大且加有玻璃片,能防止液体溅出来,C空间太小可能会爆炸,D钾与水反应太剧烈不易操作。
答案:B3.(双选题)按Li、Na、K、Rb、Cs顺序递增的性质是( )
A.单质的还原性 B.阳离子的氧化性
C.氢氧化物的碱性 D.单质的熔点解析:碱金属按Li、Na、K、Rb、Cs的顺序,单质还原性递增,阳离子的氧化性递减,氢氧化物的碱性递增,单质的熔点递减,故A、C两项正确,B、D两项错误。
答案:AC一、碱金属元素的性质 下列关于碱金属的叙述中,不正确的是( )
A.随着原子序数的增加,元素的金属性逐渐增强
B.随着原子序数的减小,单质的还原性逐渐增强
C.熔点最高的也是相对原子质量最小的
D.密度最小的也是金属性最弱的解析:碱金属随着原子序数的增加,元素的金属性逐渐增强,单质的还原性逐渐增强,单质的熔点逐渐降低,单质密度逐渐增大(钾有特殊)。
答案:B
名师点睛:碱金属元素的个体差异:
在分析碱金属元素单质及其化合物有关题目时,既要注意应用碱金属元素的相似性、递变性,还要注意其个体差异。
(1)Na、K通常保存在煤油中,Li通常用石蜡密封。(2)碱金属还原性最强的是Cs,还原性最弱的是Li。
(3)碱金属阳离子氧化性最弱的是Cs+,最强的是Li+。
(4)碱金属元素只有Li与O2反应的产物为Li2O一种,其他元素与O2反应的产物至少有两种。
(5)碱金属元素的最高价氧化物对应水化物中只有LiOH微溶,其他均为易溶于水的强碱。
(6)碱金属元素从Li→Cs,密度逐渐增大,但K的密度小于Na。变式应用1.(2013·湖南长沙检测)铯是一种碱金属元素,下列关于铯的叙述中,正确的是( )
A.CsOH是一种可溶于水的强碱
B.Cs在空气中燃烧,只生成一种氧化物Cs2O
C.Cs与水反应,能发生爆炸,并放出O2
D.用酒精灯加热Cs2CO3,可生成Cs2O和CO2解析:NaOH、KOH是可溶于水的强碱,Cs的金属性强于Na、K的金属性,因此CsOH也是一种强碱,A项正确;除Li与O2反应生成Li2O外,其他碱金属与O2反应时,产物越来越复杂,因此Cs在空气中燃烧,产物不是只有Cs2O,B项错误;Cs的金属性很强,与水反应时能发生爆炸,但只有H2而没有O2生成,C项错误;Cs2CO3、Na2CO3性质稳定,受热一般不会分解,D项错误。
答案:A二、金属活动性的比较 下列事实不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水(或酸)反应置换出氢气的难易程度解析:金属单质在反应中失去电子的多少,不能作为判断金属性强弱的依据,如1 mol Al反应失去的电子比1 mol Mg多,但Al的金属性比Mg弱,1 mol Na反应失去的电子比1 mol Ca少,但Ca的金属性比Na强。
答案:B
名师点睛:(1)不能认为金属原子的最外层电子数越多,金属性越强。
(2)不能认为等量的金属与酸反应时产生的H2越多,金属性越强。 例如:Na、Al最外层电子数分别为1、3,1 mol Na与1 mol Al与酸(足量)反应产生H2的量分别为0.5 mol、1.5 mol,但金属性:Na>Al,因此要牢记应根据金属失去电子的难易程度比较其金属性强弱。变式应用2.下列叙述中肯定能说明金属A比金属B活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换生成的H2比1 mol B从酸中置换生成的H2多
D.常温时,A能从酸中置换出氢,而B不能解析:比较金属的活泼性强弱时应根据失去电子的难易程度,而不应该根据最外层电子数的多少;应根据与水(或酸)反应的剧烈程度,而不应该根据产生H2的量的多少,更不应该根据原子电子层数的多少,故A、B、C三项错误,D项正确。
答案:D水平测试1.Na和Na+两种粒子,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④原子序数
A.①② B.②③ C.③④ D.②③④ B2.下列关于碱金属的描述中正确的是( )
A.碱金属都可以保存在煤油中
B.硬度小,密度小,熔点低
C.在空气中加热均能生成多种氧化物
D.碱金属与水反应,均漂浮在水上面解析:金属锂的密度为0.534 g/cm3,会漂浮在煤油上面,故A错误;通常状况下,碱金属都属于软金属,即硬度小,碱金属中密度最大的铯仅有1.879 g/cm3,熔点最高的锂仅为180.5 ℃,故碱金属“硬度小、密度小、熔点低”是正确的,即B项正确;在空气中加热,Li和O2反应只生成Li2O,即C项错误;铷、铯的密度大于1 g/cm3,所以D项不正确。
答案:B3.某主族元素的原子最外层是第5层,其上有1个电子,下列描述中正确的是( )
A.其单质常温下跟水反应不如钠剧烈
B.其原子半径比钾原子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解解析:根据题意知该元素为37号元素Rb,位于第五周期、第ⅠA族,其性质与我们熟悉的钠、钾相似,且比钠、钾的金属性更强。
答案:C4.(双选)居里夫人发现的镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述正确的是( )
A.单质能置换出CuCl2中的铜
B.在化合物中呈+2价
C.氢氧化物呈两性
D.碳酸盐易溶于水 解析:据同主族金属元素的递变规律,可知金属活泼性Ra>Ca,而活泼性Ca>Na,所以A项Ra不能置换CuCl2中的铜,而是先与水发生反应,A错误;最高正价等于主族序数,故B正确;Ra(OH)2是强碱,C错误;同CaCO3、BaCO3相似,RaCO3也难溶于水,D错误。
答案:B5.钾的活动性比钠强的根本原因是( )
A.钾的密度比钠小
B.钾原子的电子层比钠多一层
C.加热时,钾比钠更易气化
D.钾与水反应比钠剧烈解析:根据结构决定性质可知,钾的活动性比钠强的根本原因是钾原子比钠原子多一个电子层,原子半径比钠大,失电子能力比钠强。
答案:B 6.已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:请回答下列问题。(用化学用语回答)
(1)属于同周期元素的是____________,属于同主族元素的是____________。
(2)短周期中金属性最强的元素是____________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是____________。解析:(1)弄清原子结构示意图与元素在周期表中的位置关系,即电子层数与周期序数相等,所以A、B、C(即分别为Na、Cl、Al)同周期。主族的族序数与最外层电子数相等,所以A、D、E(即分别为Na、K、Li)同主族。
(2)同主族从上到下金属性增强,但K不是短周期元素,故短周期中金属性最强的元素应为Na。
(3)金属性越强,最高价氧化物对应的水化物碱性越强。
答案:(1)Na、Al、Cl Li、Na、K (2)Na (3)KOH能力提升7.已知:①苯与水互不相溶,苯的密度为0.88 g/cm3;②金属钠的密度为0.97 g/cm3;③苯与钠不反应。现将一小粒金属钠投入盛有苯和水的烧杯中,观察到的现象可能是( )
A.钠在水层中四处游动,伴有嘶嘶的声音
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处与水发生反应解析:根据题目提供的信息,钠的密度介于苯和水之间,所以钠会在苯与水的界面处与水发生反应。
答案:D8.用光洁的铂丝蘸取某无色溶液,在无色的火焰上灼烧时观察到有黄色火焰,则下列有关叙述中正确的是( )?
A.只含有Na+?
B.一定含有Na+,也可能含有K+?
C.可能含有Na+或K+中的一种?
D.既含有Na+,又含有K+ B 9.某同学为测定一定量的钠与水反应产生氢气的体积,设计了如下图所示的装置(固定装置已略去)进行实验,图中的量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装有适量水,甲管有刻度,供量气用;乙管可上下移动,以调节液面高低。(1)实验开始时,欲使钠与水接触反应,应如何操作?
______________________________________________。
(2)反应开始后,大试管中观察到的现象是__________________________________________________。
(3)已知有关物质的密度ρ(K)=0.86 g/cm3,ρ(Na)=0.97 g/cm3,ρ(煤油)=0.80 g/cm3。如果将钠换成大小相同的钾进行上述实验,结果钾反应所用的时间比钠反应所用的时间要________(填“长”或“短”),其原因是__________________________________________________。
(4)在标准状况下,相同质量的钠、钾与足量的水反应产生氢气的体积之比为________。 解析:(1)要使反应开始,应使钠与水接触,故应按下橡皮塞,将大头针向上拔出。(2)由于钠的密度小于水,但又大于煤油,所以钠落入试管后,会在水与煤油的交界处与水反应,生成氢气,氢气将钠托起脱离水面,待氢气放出后,钠又落到水与煤油的交界处继续与水反应,再次浮起,如此反复进行,直至完全反应。(3)由于钾的密度比钠小,产生少量的气体就可使钾上浮进入煤油中(每次反应的量少),且钾的密度与煤油的密度很接近,在煤油中滞留的时间较长。(4)由反应方程式:2Na+2H2O===2NaOH+H2↑,2K+2H2O===2KOH+H2↑可知:则有:V1(H2):V2(H2)=39:23。
答案:(1)按下橡皮塞,将大头针向上拔出 (2)钠在煤油与水的接触面之间上下沉浮,并不断减少至消失,同时有气泡产生 (3)长 因为钾的密度比钠小,产生少量的气体就可使钾上浮进入煤油中(每次反应的量少),且钾的密度与煤油的密度很接近,在煤油中滞留的时间较长 (4)39:23 10.已知下列转化关系:请回答下列问题:
(1)写出M、N的化学式:____________、____________。
(2)写出下列反应的化学方程式:
①X+Y:______________________________________;②X+H2O:___________________________________________________;
③M+Y:___________________________________________________。
x的一种氧化物常作潜艇供氧剂,写出由x制取该氧化物的反应方程式并标出氧元素的化合价:___________________________________________________。解析:由图示中“X+Y NaCl”和“X+H2O―→H2+M”,可确定:X为Na,Y为Cl2,M为NaOH,则N为NaClO。
答案:(1)NaOH NaClO
(2)①2Na+Cl2 2NaCl
②2Na+2H2O===2NaOH+H2↑
③2NaOH+Cl2===NaCl+NaClO+H2O感谢您的使用,退出请按ESC键本小节结束
第2课时 碱金属元素物质结构 元素周期律第2课时 碱金属元素碱金属元素的发现
碱金属元素包括锂、钠、钾、铷、铯、钫,它们被发现的次序是钾、钠、锂、铷、铯、钫。
钾和钠都是在1807年由戴维发现的。他电解熔融的氢氧化钾时,发现阴极表面上出现有金属光泽、酷似水银滴的颗粒,有的颗粒刚形成就燃烧掉了,发出火焰,并发生爆炸。有的颗粒逐渐失去光泽,表面形成一层白色薄膜。这种小的金属颗粒投进水里,即出现火焰。戴维确定它是一种新的元素,因为是从钾碱(potash)制得的,所以定名为钾(potassium)。
同年,戴维又电解氢氧化钠而制得金属钠。
1817年阿尔费特孙(Arfvedson)从矿石分析中确定了锂元素的存在。锂的火焰颜色在1818年由格美林(Gmelin)发现。他们都没有能制出锂的单质。1818年,布朗得斯(Brandes)和戴维电解氧化锂,制得了少量金属锂。一直到1855年,本生(Bunsen)和马提生(Mattiessen)用电解氯化锂的方法才制得较多的锂。1893年根茨(Guntz)提出在400 ℃时电解熔融的LiCl(55%)、KCl(45%)电解液制锂,这种原理应用到生产上,一直沿用到现在。
1860年克希荷夫(Kirchhoff)和本生研究碱金属光谱时,发现蓝色区域有明亮的光谱线,他们把显示这种光谱线的元素叫铯,意思是“天蓝”。1861年,克希荷夫和本生又在暗红色区域发现新的光谱线,他们把显示这种光谱线的元素叫铷,意思是“暗红”。钫这种在碱金属中密度最大的元素,在理论上和性质上都早就相当明了地被预见了。但一直到1939年,贝赫蕾(Perrey)才发现了这第87号元素的一个半衰期很短的同位素223Fr,它是从235U衰变为227Ac,227Ac又经a-衰变而成的。贝赫蕾是法国人,她为了祖国的荣誉命名它为钫,意思是“法兰西”。
碱金属元素在结构和性质上有什么相似性和递变性呢?1.了解碱金属元素的原子结构及特点。
2.了解碱金属元素化学性质的相似性及递变性。
3.认识结构决定物质性质的因果关系。碱金属元素1.碱金属元素原子结构的相似性和递变性一个 失去+1 还原增多增大减弱 增强2.碱金属元素性质的相似性和递变性低 小小 白递减 递增氧化物 过氧化物剧烈复杂氢氧化物 氢气2ROHH2↑剧烈3.原子结构与性质之间的关系+1增大 增强 增强应用思考:1.结合钠、钾的性质,应如何保存单质钾?
2.什么是元素的金属性?提示:因K与O2、H2O等发生反应,故应密闭保存,又因为K密度比煤油大且二者不反应,所以同Na一样,K也常保存在煤油中。 提示:金属性是指元素的原子失去电子难易程度的性质,即元素的原子越易失电子,元素的金属性就越强。知识拓展一、碱金属元素性质相似性与递变性的比较(续上表)(续上表)特别关注:Na、K与盐溶液的反应:
因Na、K等很活泼的金属易与H2O反应,故当Na、K投入到盐溶液中时,不是从溶液中置换出相对不活泼的金属,而是先与水发生反应生成碱与氢气,然后生成的碱再与盐发生复分解反应(若不符合复分解反应的条件,则只发生金属与水的反应)。二、金属性强弱的比较
1.根据原子结构:原子半径越大,金属性越强,反之则越弱。
2.根据元素在周期表中的位置:同周期元素,从左至右,随着原子序数的增加,金属性逐渐减弱,非金属性逐渐增强;同主族元素,从上至下,随着原子序数的增加,金属性逐渐增强,非金属性逐渐减弱。3.根据实验结论
(1)与水或酸反应置换出氢的难易:金属单质与水或酸(非氧化性酸)反应置换出氢的速率越快(反应越剧烈),表明元素金属性越强。
(2)最高价氧化物对应水化物的碱性强弱:碱性越强,表明该元素金属性越强。
(3)置换反应:一种金属能把另一种金属从它的盐溶液里置换出来,表明前一种金属元素比后一种金属元素的金属性强。(4)单质的还原性强弱:还原性越强,则金属性越强。
(5)离子的氧化性强弱:离子的氧化性越强,则对应金属元素的金属性越弱。
4.根据金属活动性顺序表:一般来说,排在前面的金属的金属性较强。特别关注:(1)如某金属元素金属性越强,则单质与水(或酸)反应就越剧烈,最高价氧化物的水化物碱性越强。
(2)金属性强弱的比较,是比较原子失去电子的难易,而不是失去电子的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。尝试应用1.(双选题)金属钠比金属钾( )
A.金属性强 B.还原性弱
C.原子半径大 D.熔点高解析:碱金属中,随原子序数递增,金属性增强,还原性增强,原子半径增大,熔、沸点降低。
答案:BD 2.下列四种演示金属钾与水反应的实验装置,正确的是( )解析:钾与水反应剧烈,从安全角度来看,用B装置反应空间大且加有玻璃片,能防止液体溅出来,C空间太小可能会爆炸,D钾与水反应太剧烈不易操作。
答案:B3.(双选题)按Li、Na、K、Rb、Cs顺序递增的性质是( )
A.单质的还原性 B.阳离子的氧化性
C.氢氧化物的碱性 D.单质的熔点解析:碱金属按Li、Na、K、Rb、Cs的顺序,单质还原性递增,阳离子的氧化性递减,氢氧化物的碱性递增,单质的熔点递减,故A、C两项正确,B、D两项错误。
答案:AC一、碱金属元素的性质 下列关于碱金属的叙述中,不正确的是( )
A.随着原子序数的增加,元素的金属性逐渐增强
B.随着原子序数的减小,单质的还原性逐渐增强
C.熔点最高的也是相对原子质量最小的
D.密度最小的也是金属性最弱的解析:碱金属随着原子序数的增加,元素的金属性逐渐增强,单质的还原性逐渐增强,单质的熔点逐渐降低,单质密度逐渐增大(钾有特殊)。
答案:B
名师点睛:碱金属元素的个体差异:
在分析碱金属元素单质及其化合物有关题目时,既要注意应用碱金属元素的相似性、递变性,还要注意其个体差异。
(1)Na、K通常保存在煤油中,Li通常用石蜡密封。(2)碱金属还原性最强的是Cs,还原性最弱的是Li。
(3)碱金属阳离子氧化性最弱的是Cs+,最强的是Li+。
(4)碱金属元素只有Li与O2反应的产物为Li2O一种,其他元素与O2反应的产物至少有两种。
(5)碱金属元素的最高价氧化物对应水化物中只有LiOH微溶,其他均为易溶于水的强碱。
(6)碱金属元素从Li→Cs,密度逐渐增大,但K的密度小于Na。变式应用1.(2013·湖南长沙检测)铯是一种碱金属元素,下列关于铯的叙述中,正确的是( )
A.CsOH是一种可溶于水的强碱
B.Cs在空气中燃烧,只生成一种氧化物Cs2O
C.Cs与水反应,能发生爆炸,并放出O2
D.用酒精灯加热Cs2CO3,可生成Cs2O和CO2解析:NaOH、KOH是可溶于水的强碱,Cs的金属性强于Na、K的金属性,因此CsOH也是一种强碱,A项正确;除Li与O2反应生成Li2O外,其他碱金属与O2反应时,产物越来越复杂,因此Cs在空气中燃烧,产物不是只有Cs2O,B项错误;Cs的金属性很强,与水反应时能发生爆炸,但只有H2而没有O2生成,C项错误;Cs2CO3、Na2CO3性质稳定,受热一般不会分解,D项错误。
答案:A二、金属活动性的比较 下列事实不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水(或酸)反应置换出氢气的难易程度解析:金属单质在反应中失去电子的多少,不能作为判断金属性强弱的依据,如1 mol Al反应失去的电子比1 mol Mg多,但Al的金属性比Mg弱,1 mol Na反应失去的电子比1 mol Ca少,但Ca的金属性比Na强。
答案:B
名师点睛:(1)不能认为金属原子的最外层电子数越多,金属性越强。
(2)不能认为等量的金属与酸反应时产生的H2越多,金属性越强。 例如:Na、Al最外层电子数分别为1、3,1 mol Na与1 mol Al与酸(足量)反应产生H2的量分别为0.5 mol、1.5 mol,但金属性:Na>Al,因此要牢记应根据金属失去电子的难易程度比较其金属性强弱。变式应用2.下列叙述中肯定能说明金属A比金属B活泼性强的是( )
A.A原子最外层电子数比B原子的最外层电子数少
B.A原子电子层数比B原子的电子层数多
C.1 mol A从酸中置换生成的H2比1 mol B从酸中置换生成的H2多
D.常温时,A能从酸中置换出氢,而B不能解析:比较金属的活泼性强弱时应根据失去电子的难易程度,而不应该根据最外层电子数的多少;应根据与水(或酸)反应的剧烈程度,而不应该根据产生H2的量的多少,更不应该根据原子电子层数的多少,故A、B、C三项错误,D项正确。
答案:D水平测试1.Na和Na+两种粒子,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④原子序数
A.①② B.②③ C.③④ D.②③④ B2.下列关于碱金属的描述中正确的是( )
A.碱金属都可以保存在煤油中
B.硬度小,密度小,熔点低
C.在空气中加热均能生成多种氧化物
D.碱金属与水反应,均漂浮在水上面解析:金属锂的密度为0.534 g/cm3,会漂浮在煤油上面,故A错误;通常状况下,碱金属都属于软金属,即硬度小,碱金属中密度最大的铯仅有1.879 g/cm3,熔点最高的锂仅为180.5 ℃,故碱金属“硬度小、密度小、熔点低”是正确的,即B项正确;在空气中加热,Li和O2反应只生成Li2O,即C项错误;铷、铯的密度大于1 g/cm3,所以D项不正确。
答案:B3.某主族元素的原子最外层是第5层,其上有1个电子,下列描述中正确的是( )
A.其单质常温下跟水反应不如钠剧烈
B.其原子半径比钾原子半径小
C.其碳酸盐易溶于水
D.其氢氧化物不能使氢氧化铝溶解解析:根据题意知该元素为37号元素Rb,位于第五周期、第ⅠA族,其性质与我们熟悉的钠、钾相似,且比钠、钾的金属性更强。
答案:C4.(双选)居里夫人发现的镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述正确的是( )
A.单质能置换出CuCl2中的铜
B.在化合物中呈+2价
C.氢氧化物呈两性
D.碳酸盐易溶于水 解析:据同主族金属元素的递变规律,可知金属活泼性Ra>Ca,而活泼性Ca>Na,所以A项Ra不能置换CuCl2中的铜,而是先与水发生反应,A错误;最高正价等于主族序数,故B正确;Ra(OH)2是强碱,C错误;同CaCO3、BaCO3相似,RaCO3也难溶于水,D错误。
答案:B5.钾的活动性比钠强的根本原因是( )
A.钾的密度比钠小
B.钾原子的电子层比钠多一层
C.加热时,钾比钠更易气化
D.钾与水反应比钠剧烈解析:根据结构决定性质可知,钾的活动性比钠强的根本原因是钾原子比钠原子多一个电子层,原子半径比钠大,失电子能力比钠强。
答案:B 6.已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:请回答下列问题。(用化学用语回答)
(1)属于同周期元素的是____________,属于同主族元素的是____________。
(2)短周期中金属性最强的元素是____________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是____________。解析:(1)弄清原子结构示意图与元素在周期表中的位置关系,即电子层数与周期序数相等,所以A、B、C(即分别为Na、Cl、Al)同周期。主族的族序数与最外层电子数相等,所以A、D、E(即分别为Na、K、Li)同主族。
(2)同主族从上到下金属性增强,但K不是短周期元素,故短周期中金属性最强的元素应为Na。
(3)金属性越强,最高价氧化物对应的水化物碱性越强。
答案:(1)Na、Al、Cl Li、Na、K (2)Na (3)KOH能力提升7.已知:①苯与水互不相溶,苯的密度为0.88 g/cm3;②金属钠的密度为0.97 g/cm3;③苯与钠不反应。现将一小粒金属钠投入盛有苯和水的烧杯中,观察到的现象可能是( )
A.钠在水层中四处游动,伴有嘶嘶的声音
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处与水发生反应解析:根据题目提供的信息,钠的密度介于苯和水之间,所以钠会在苯与水的界面处与水发生反应。
答案:D8.用光洁的铂丝蘸取某无色溶液,在无色的火焰上灼烧时观察到有黄色火焰,则下列有关叙述中正确的是( )?
A.只含有Na+?
B.一定含有Na+,也可能含有K+?
C.可能含有Na+或K+中的一种?
D.既含有Na+,又含有K+ B 9.某同学为测定一定量的钠与水反应产生氢气的体积,设计了如下图所示的装置(固定装置已略去)进行实验,图中的量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装有适量水,甲管有刻度,供量气用;乙管可上下移动,以调节液面高低。(1)实验开始时,欲使钠与水接触反应,应如何操作?
______________________________________________。
(2)反应开始后,大试管中观察到的现象是__________________________________________________。
(3)已知有关物质的密度ρ(K)=0.86 g/cm3,ρ(Na)=0.97 g/cm3,ρ(煤油)=0.80 g/cm3。如果将钠换成大小相同的钾进行上述实验,结果钾反应所用的时间比钠反应所用的时间要________(填“长”或“短”),其原因是__________________________________________________。
(4)在标准状况下,相同质量的钠、钾与足量的水反应产生氢气的体积之比为________。 解析:(1)要使反应开始,应使钠与水接触,故应按下橡皮塞,将大头针向上拔出。(2)由于钠的密度小于水,但又大于煤油,所以钠落入试管后,会在水与煤油的交界处与水反应,生成氢气,氢气将钠托起脱离水面,待氢气放出后,钠又落到水与煤油的交界处继续与水反应,再次浮起,如此反复进行,直至完全反应。(3)由于钾的密度比钠小,产生少量的气体就可使钾上浮进入煤油中(每次反应的量少),且钾的密度与煤油的密度很接近,在煤油中滞留的时间较长。(4)由反应方程式:2Na+2H2O===2NaOH+H2↑,2K+2H2O===2KOH+H2↑可知:则有:V1(H2):V2(H2)=39:23。
答案:(1)按下橡皮塞,将大头针向上拔出 (2)钠在煤油与水的接触面之间上下沉浮,并不断减少至消失,同时有气泡产生 (3)长 因为钾的密度比钠小,产生少量的气体就可使钾上浮进入煤油中(每次反应的量少),且钾的密度与煤油的密度很接近,在煤油中滞留的时间较长 (4)39:23 10.已知下列转化关系:请回答下列问题:
(1)写出M、N的化学式:____________、____________。
(2)写出下列反应的化学方程式:
①X+Y:______________________________________;②X+H2O:___________________________________________________;
③M+Y:___________________________________________________。
x的一种氧化物常作潜艇供氧剂,写出由x制取该氧化物的反应方程式并标出氧元素的化合价:___________________________________________________。解析:由图示中“X+Y NaCl”和“X+H2O―→H2+M”,可确定:X为Na,Y为Cl2,M为NaOH,则N为NaClO。
答案:(1)NaOH NaClO
(2)①2Na+Cl2 2NaCl
②2Na+2H2O===2NaOH+H2↑
③2NaOH+Cl2===NaCl+NaClO+H2O感谢您的使用,退出请按ESC键本小节结束
