【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第3课时 卤族元素(54张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第3课时 卤族元素(54张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 685.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:02:11 | ||
图片预览







文档简介
课件54张PPT。第一节 元素周期表
第3课时 卤 族 元 素物质结构 元素周期律第3课时 卤 族 元 素大家知道,有雨必先有云,但是有云不一定有雨。自然界过冷云降雨(或雪)是由于云中除小水滴外,还有足够的冰晶——饱和水汽或过冷却水滴在冰核(不溶于水的尘粒)作用下凝华或冻结而形成的冰相胚胎。过冷云中水滴的水分子会不断蒸发并凝华到冰晶上,冰晶不断长大以致下落为雪,如果云下气温高于0 ℃,它们就会融化成雨。如果自然界这种云雾中缺少足够的冰晶,因云中水滴十分细小,能够长期稳定地在空气中悬浮而降不下来,于是就只有云而无雨。这时候如果向这种云雾中播撒碘化银微粒,则能产生很多冰晶,云中水滴上的水分经蒸发、凝华迅速转化到这些人工冰晶上,使冰晶很快长大产生降雪,如果地面气温较高,雪降落过程中边融化边碰撞合并为水滴,最终成为降雨。这就是人工降雨。
碘化银在人工降雨中所起的作用在气象学上称为冷云催化。碘化银只要受热后就会在空气中形成极多极细(只有头发直径的百分之一到千分之一)的碘化银粒子。1 g碘化银可以形成几十万亿个微粒。这些微粒会随气流运动进入云中,在冷云中产生几万亿到上百万亿个冰晶。因此,用碘化银催化降雨不需飞机,设备简单,用量很少,费用低廉,可以大面积推广。
除了人工降水(雨、雪)外,碘化银还可以用于人工消云雾,消闪电、消弱台风、抑制冰雹等。
碘属于卤族元素,卤族元素有哪些物理性质和化学性质呢?1.了解卤族元素在周期表中的位置。
2.了解卤素原子的结构特点。
3.了解卤素单质的物理性质和化学性质。
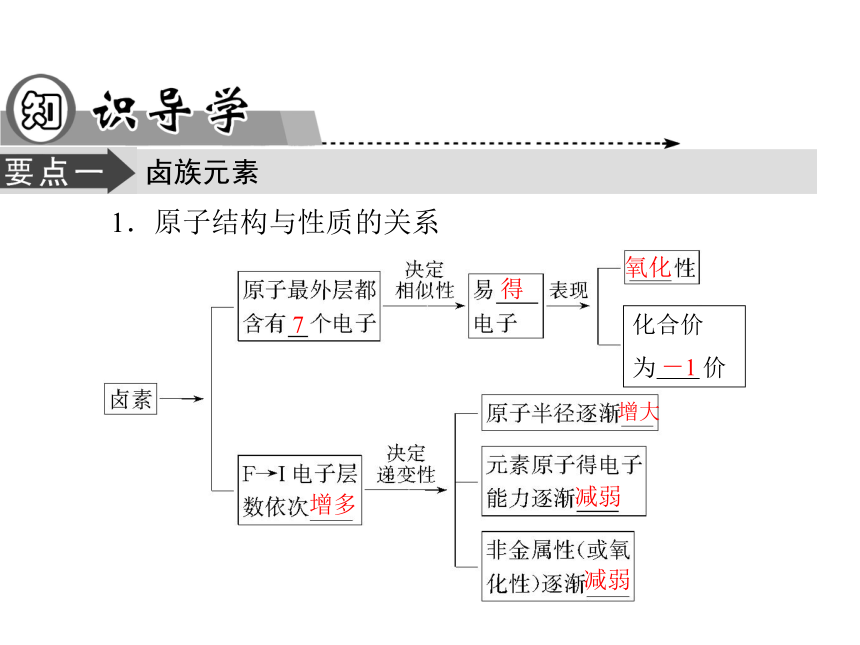
4.揭示结构与性质的内在联系。卤族元素1.原子结构与性质的关系7得氧化增多增大减弱减弱化合价
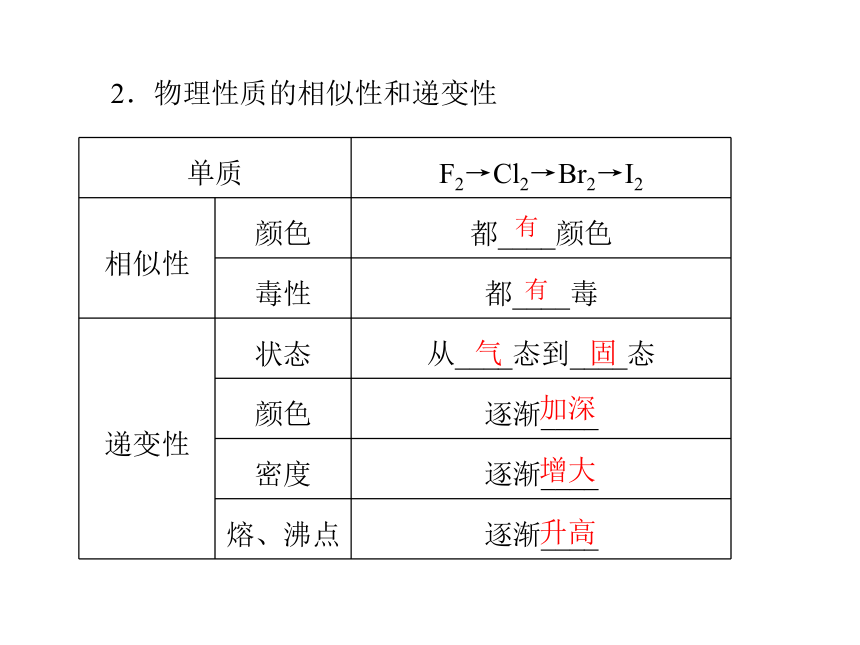
为 价-12.物理性质的相似性和递变性有有气 固加深
增大
升高3.化学性质的相似性和递变性
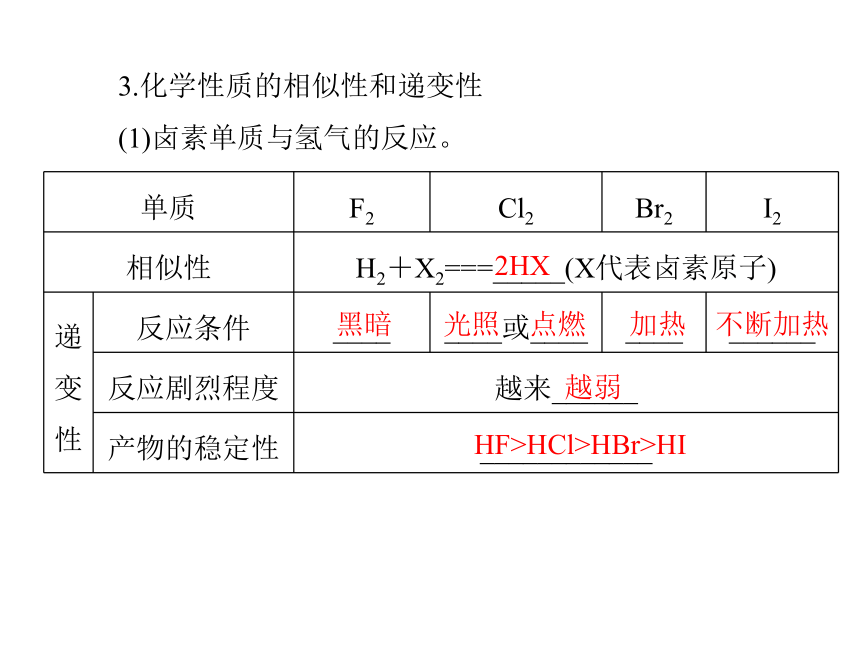
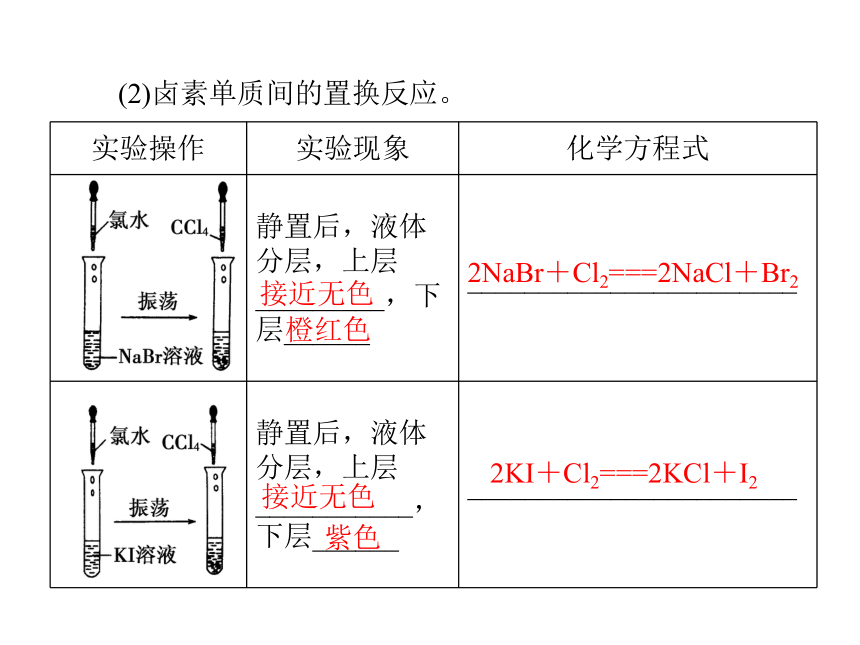
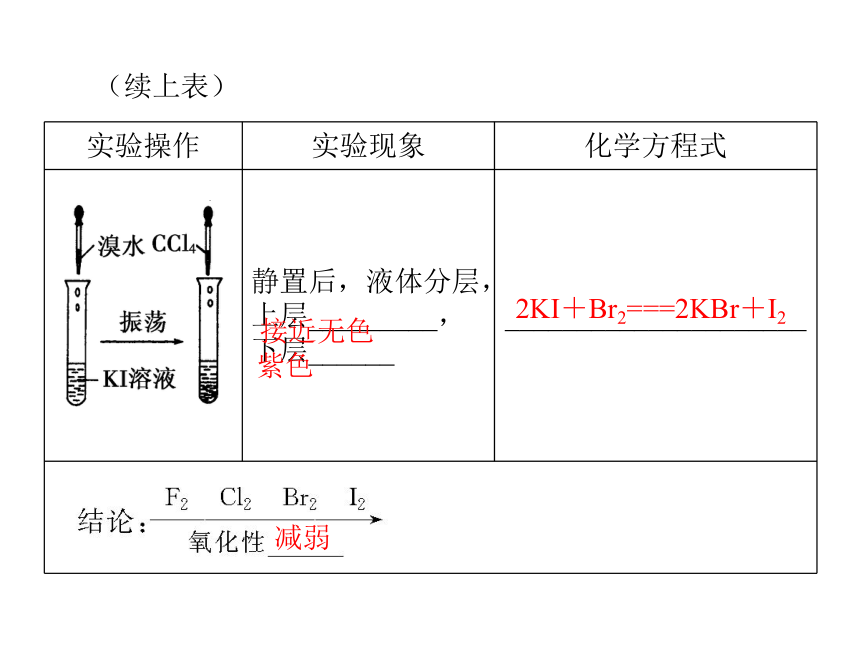
(1)卤素单质与氢气的反应。2HX 黑暗 光照 点燃 加热 不断加热越弱HF>HCl>HBr>HI(2)卤素单质间的置换反应。接近无色橙红色2NaBr+Cl2===2NaCl+Br2接近无色紫色2KI+Cl2===2KCl+I2(续上表)接近无色紫色2KI+Br2===2KBr+I2减弱 同主族元素的性质与原子结构的关系1.元素性质的影响因素
元素的性质主要取决于原子______________。
2.同主族元素性质的递变规律最外层电子数增多增大增强减弱增强减弱应用思考:1.结合同主族元素性质的递变规律,判断H3PO4和H3AsO4酸性的强弱;H2O和H2S的稳定性。
2.请写出两个离子反应以证明氧化性强弱为:Cl2>Br2>I2。提示:Cl2+2Br-===Br2+2Cl-,Br2+2I-===I2+2Br-。 提示:同主族元素,原子序数越大,非金属性越弱,其最高价含氧酸酸性越弱,气态氢化物稳定性越弱。所以酸性:H3PO4>H3AsO4,稳定性:H2O>H2S。综合拓展一、元素非金属性强弱的判断方法
1.同周期元素,从左到右非金属性逐渐增强。如非金属性:Cl>S。
同主族元素,从上到下非金属性逐渐减弱。如非金属性:Cl>Br。
2.根据最高价氧化物对应水化物的酸性强弱,酸性越强,表明非金属性越强。如酸性:HClO4(高氯酸)>H2SO4,则非金属性:Cl>S。3.根据与氢气反应生成气态氢化物的难易程度,越易化合则其非金属性越强。如H2+F2 2HF,H2+Cl2 2HCl,则非金属性:F>Cl。
4.根据氢化物的稳定性,氢化物越稳定则其非金属性越强。如氢化物的稳定性:HF>HCl>HBr>HI,则非金属性:F>Cl>Br>I。5.根据置换反应,活动性强的非金属单质可置换出活动性相对较弱的非金属单质。如Cl2+2NaBr===2NaCl+Br2,则非金属性:Cl>Br。
6.非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。二、同主族元素性质递变规律
由碱金属元素和卤素的性质来看,元素的化学性质,主要由原子的最外层电子数决定,其次是电子层数。原子结构相似的元素,它们的化学性质表现出相似性和递变性。同主族从上至下,元素及其典型化合物性质递变规律,如下表所示: 特别关注:(1)金属性和非金属性讨论的对象是元素,具体表现为该元素的单质或特定化合物的性质。
(2)氧化性和还原性讨论的对象是具体物质或某物质中的特定粒子,具体表现在该物质中某元素得失电子的能力。三、卤素(用X表示)单质的性质的相似性、递变性和特性
1.相似性(1)与H2反应:X2+H2 2HX。
(2)与活泼金属(如Na)反应:2Na+X2 2NaX。
(3)与H2O反应。
2F2+2H2O 4HF+O2,
Cl2+H2O HCl+HClO,
X2+H2O?? HX+HXO(X=Br、I)。(4)与碱反应。
X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。
2.递变性
(1)氧化性与还原性。(2)与H2反应的难易及氢化物稳定性(由F2→I2)。
①与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。②氢化物中HCl、HBr、HI的熔、沸点依次升高。
(3)卤素单质与变价金属(如Fe)反应。2Fe+3X2 2FeX3(X=F、Cl、Br),
Fe+X2 FeX2(X=I)。
3.卤素单质的特殊性质
(1)Br2在常温下是惟一的液态非金属单质,易挥发。
(2)碘为紫黑色固体,易升华,淀粉遇I2变蓝色。尝试应用 1.(2013·梅州高一检测)(双选题)下列变化规律中错误的是( )?
A.粒子半径:F- < Cl- < Br-B.稳定性:HI > HBr > HCl > HF?
C.还原性:F- < Cl- < Br- < I-?
D.氧化性:F2 < Cl2 < Br2 < I2?BD2.卤素单质(从氟到碘)性质的递变规律正确的是( )
A.密度逐渐减小,颜色逐渐加深
B.氧化性逐渐增强
C.还原性逐渐减弱
D.与氢化合逐渐困难D3.(2013·厦门检测) F、Cl和Br都是第ⅦA族元素,关于这三种元素原子的说法正确的是( )?
A.原子半径:F>Cl>Br?
B.最外层电子数都相同?
C.核外电子层数都相同?
D.最外层电子数都不相同B一、卤族元素的性质 (2013·北京海淀模拟)按照氟、氯、溴、碘的顺序,下列递变规律中正确的是( )
A.单质的熔、沸点逐渐降低
B.与H2反应越来越容易
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.单质的氧化性逐渐增强解析:按照氟、氯、溴、碘的顺序,卤素单质的熔、沸点逐渐升高,常温下F2、Cl2为气态,Br2为液态,I2为固态,A项错误;卤素单质与H2反应的条件越来越难,B项错误;单质的氧化性逐渐减弱,如Cl2+2KI===2KCl+I2,D项错误。
答案:C
名师点睛:卤族元素单质及其化合物的性质总结:
(1)按由F→I的顺序,元素的非金属性逐渐减弱。
(2)氢化物稳定性:HF>HCl>HBr>HI。
(3)氢化物还原性:HFHBrO4>HIO4,F无正价,故无含氧酸。
(5)密度:卤族元素同碱金属一致,自上而下,单质密度逐渐增大。
(6)熔、沸点:卤族元素同碱金属相反,自上而下,单质熔、沸点逐渐升高。
(7)溶解性:除F2外,卤素单质在水中的溶解性均不大,均易溶于有机溶剂。变式应用1.(双选题)下列关于卤素(从F→I)的说法正确的是( )
A.单质的颜色逐渐加深
B.气态氢化物的稳定性逐渐增强
C.原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D.与水反应,自身氧化还原剧烈程度为F2>Cl2>Br2>I2解析:卤族元素从F→I,单质的颜色逐渐加深,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱,非金属性减弱,则气态氢化物的稳定性减弱。与水反应时,F2和H2O剧烈反应,F2是氧化剂,H2O是还原剂,而不是F2的自身氧化还原反应。
答案:AC二、元素非金属性强弱比较 (2011年长沙检测)X、Y是元素周期表第ⅦA 族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强 解析:因X、Y是元素周期表中第ⅦA族的元素,若X的电子层数多,则说明X比Y的非金属性弱,A项错误;事实说明Y比X更活泼,B项错误;据单质与H2化合的难易判断,且X2与H2化合更容易,说明氧化性:X2>Y2,则非金属性:X>Y,C项正确;应据最高价氧化物对应水化物的酸性强弱来判断非金属性的强弱,D项错误。
答案:C变式应用2.(2011年青岛检测)甲、乙两种非金属:①甲比乙容易与氢化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的有( )
A.只有④ B.只有⑤
C.①②③ D.①②③④⑤C水平测试1.向下列物质的水溶液里加入用硝酸酸化的硝酸银溶液,不能生成沉淀的是( )
A.CaCl2 B.KClO3 C.KI D.NaBr解析:卤素离子如Cl-、Br-、I-均可与Ag+反应产生沉淀,而KClO3在水溶液中不能电离出Cl-,因此不能产生沉淀。
答案:B2.砹是原子序数最大的卤族元素,根据卤族元素性质的递变性,对砹及其化合物的叙述,正确的是( )
A.与H2的化合能力:At2>I2
B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹易溶于水,难溶于四氯化碳解析:从F到At,元素的非金属性逐渐减弱,与H2的化合能力逐渐减弱,A项不正确;从F2到I2,单质的颜色逐渐加深,I2是紫黑色晶体,砹是黑色固体,B项不正确;卤族元素的原子,最外电子层上都有7个电子,C项正确;由I2微溶于水,易溶于四氯化碳溶液,可推知At2微溶于水,易溶于四氯化碳溶液,D项不正确。
答案:C3.下列对溴性质的描述,其中错误的是 ( )
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热条件下反应生成HBrB4.(2011年嘉兴检测)下列不能说明氯元素的非金属性比硫元素强的事实是 ( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤解析:含氧酸的氧化性不能作为判断元素非金属性强弱的依据;最外层电子数多,元素的非金属性不一定强,如非金属性:O>Cl,但最外层电子数:O答案:A 5.已知常温下KClO3与HCl(浓)反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )解析:在锥形瓶中,KClO3与HCl(浓)反应产生Cl2,所以①处为黄绿色;Cl2在②处与Br-反应生成Br2,所以②处为橙色;Cl2(可能还有挥发的Br2)在③处与I-反应生成I2,淀粉遇I2变蓝,所以③处为蓝色;Cl2(可能还有挥发的Br2)全部被NaOH溶液吸收,所以④处是白色棉球的本色(析出的NaCl、NaClO固体均为白色)。
答案:A6.(2011年长沙检测)下表为元素周期表的一部分。(1)表中元素____________(填写元素符号,下同)的非金属性最强;元素____________的金属性最强;元素____________的单质室温下呈液态。FKBr(2)表中元素⑦的原子结构示意图是____________。
(3)表中元素⑥⑩氢化物的稳定性顺序为__________>____________(填写化学式,下同)。
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:____________>____________。HClO4 H2SO4HF HCl能力提升7.甲、乙、丙、丁四个集气瓶中装有Cl2、H2、HCl、HBr中的任意一种气体。若将甲和丁两瓶气体混合,见强光则发生爆炸;若将甲和乙两瓶气体混合,则见瓶壁上出现红棕色的小液滴,那么气体乙是( )
A.H2 B.Cl2
C.HBr D.HClC8.下列关于碱金属元素和卤素的说法中,错误的是( )
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水的反应比氯单质与水的反应更剧烈D9.某学生往一支试管里按一定次序分别加入下列几种物质:
A.KI溶液,B.淀粉溶液,C.NaOH溶液,D.氯水。
发现溶液颜色按下面次序变化:
①无色―→②棕黄色―→③蓝色―→④无色。
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是__________________________________________________。(2)写出①→②的离子反应方程式:________________________________________________________________________。
(3)写出③→④的化学反应方程式:________________________________________________________________________。解析:溶液显棕黄色,说明溶液中有I2生成,氯水和KI溶液反应生成I2,而氯水显浅黄绿色,故①为KI溶液,②为加入氯水,溶液显蓝色是由于淀粉遇I2形成的,故③为加入淀粉溶液;又由于I2+2NaOH===NaI+NaIO+H2O,加入NaOH溶液后I2逐渐消失,蓝色将逐渐褪为无色,故④为加入NaOH溶液。
答案:(1)A、D、B、C
(2)2I-+Cl2===I2+2Cl-
(3)I2+2NaOH===NaI+NaIO+H2O10.某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。(4)实验结论:________________________________________________________________________。
(5)问题和讨论。
①上述两个实验中发生反应的离子方程式分别为________________________、________________________________________________________________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________________、____________________________。解析:向溴化钠溶液中加入新制氯水,发生反应:Cl2+2Br-===Br2+2Cl-,证明氧化性:Cl2>Br2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈橙红色。向碘化钠溶液中加入新制溴水,发生反应:Br2+2I-===I2+2Br-,证明氧化性:Br2>I2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下原子的得电子能力逐渐减弱。
答案: (3)①橙红 ②紫红
(4)同主族元素从上到下原子的得电子能力逐渐减弱 (5)①Cl2+2Br-===Br2+2Cl- 2I-+Br2===2Br-+I2 ②HF的稳定性比HCl强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(其他合理答案也可) 感谢您的使用,退出请按ESC键本小节结束
第3课时 卤 族 元 素物质结构 元素周期律第3课时 卤 族 元 素大家知道,有雨必先有云,但是有云不一定有雨。自然界过冷云降雨(或雪)是由于云中除小水滴外,还有足够的冰晶——饱和水汽或过冷却水滴在冰核(不溶于水的尘粒)作用下凝华或冻结而形成的冰相胚胎。过冷云中水滴的水分子会不断蒸发并凝华到冰晶上,冰晶不断长大以致下落为雪,如果云下气温高于0 ℃,它们就会融化成雨。如果自然界这种云雾中缺少足够的冰晶,因云中水滴十分细小,能够长期稳定地在空气中悬浮而降不下来,于是就只有云而无雨。这时候如果向这种云雾中播撒碘化银微粒,则能产生很多冰晶,云中水滴上的水分经蒸发、凝华迅速转化到这些人工冰晶上,使冰晶很快长大产生降雪,如果地面气温较高,雪降落过程中边融化边碰撞合并为水滴,最终成为降雨。这就是人工降雨。
碘化银在人工降雨中所起的作用在气象学上称为冷云催化。碘化银只要受热后就会在空气中形成极多极细(只有头发直径的百分之一到千分之一)的碘化银粒子。1 g碘化银可以形成几十万亿个微粒。这些微粒会随气流运动进入云中,在冷云中产生几万亿到上百万亿个冰晶。因此,用碘化银催化降雨不需飞机,设备简单,用量很少,费用低廉,可以大面积推广。
除了人工降水(雨、雪)外,碘化银还可以用于人工消云雾,消闪电、消弱台风、抑制冰雹等。
碘属于卤族元素,卤族元素有哪些物理性质和化学性质呢?1.了解卤族元素在周期表中的位置。
2.了解卤素原子的结构特点。
3.了解卤素单质的物理性质和化学性质。
4.揭示结构与性质的内在联系。卤族元素1.原子结构与性质的关系7得氧化增多增大减弱减弱化合价
为 价-12.物理性质的相似性和递变性有有气 固加深
增大
升高3.化学性质的相似性和递变性
(1)卤素单质与氢气的反应。2HX 黑暗 光照 点燃 加热 不断加热越弱HF>HCl>HBr>HI(2)卤素单质间的置换反应。接近无色橙红色2NaBr+Cl2===2NaCl+Br2接近无色紫色2KI+Cl2===2KCl+I2(续上表)接近无色紫色2KI+Br2===2KBr+I2减弱 同主族元素的性质与原子结构的关系1.元素性质的影响因素
元素的性质主要取决于原子______________。
2.同主族元素性质的递变规律最外层电子数增多增大增强减弱增强减弱应用思考:1.结合同主族元素性质的递变规律,判断H3PO4和H3AsO4酸性的强弱;H2O和H2S的稳定性。
2.请写出两个离子反应以证明氧化性强弱为:Cl2>Br2>I2。提示:Cl2+2Br-===Br2+2Cl-,Br2+2I-===I2+2Br-。 提示:同主族元素,原子序数越大,非金属性越弱,其最高价含氧酸酸性越弱,气态氢化物稳定性越弱。所以酸性:H3PO4>H3AsO4,稳定性:H2O>H2S。综合拓展一、元素非金属性强弱的判断方法
1.同周期元素,从左到右非金属性逐渐增强。如非金属性:Cl>S。
同主族元素,从上到下非金属性逐渐减弱。如非金属性:Cl>Br。
2.根据最高价氧化物对应水化物的酸性强弱,酸性越强,表明非金属性越强。如酸性:HClO4(高氯酸)>H2SO4,则非金属性:Cl>S。3.根据与氢气反应生成气态氢化物的难易程度,越易化合则其非金属性越强。如H2+F2 2HF,H2+Cl2 2HCl,则非金属性:F>Cl。
4.根据氢化物的稳定性,氢化物越稳定则其非金属性越强。如氢化物的稳定性:HF>HCl>HBr>HI,则非金属性:F>Cl>Br>I。5.根据置换反应,活动性强的非金属单质可置换出活动性相对较弱的非金属单质。如Cl2+2NaBr===2NaCl+Br2,则非金属性:Cl>Br。
6.非金属阴离子的还原性越强,则其单质的氧化性越弱,元素的非金属性越弱。二、同主族元素性质递变规律
由碱金属元素和卤素的性质来看,元素的化学性质,主要由原子的最外层电子数决定,其次是电子层数。原子结构相似的元素,它们的化学性质表现出相似性和递变性。同主族从上至下,元素及其典型化合物性质递变规律,如下表所示: 特别关注:(1)金属性和非金属性讨论的对象是元素,具体表现为该元素的单质或特定化合物的性质。
(2)氧化性和还原性讨论的对象是具体物质或某物质中的特定粒子,具体表现在该物质中某元素得失电子的能力。三、卤素(用X表示)单质的性质的相似性、递变性和特性
1.相似性(1)与H2反应:X2+H2 2HX。
(2)与活泼金属(如Na)反应:2Na+X2 2NaX。
(3)与H2O反应。
2F2+2H2O 4HF+O2,
Cl2+H2O HCl+HClO,
X2+H2O?? HX+HXO(X=Br、I)。(4)与碱反应。
X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。
2.递变性
(1)氧化性与还原性。(2)与H2反应的难易及氢化物稳定性(由F2→I2)。
①与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。②氢化物中HCl、HBr、HI的熔、沸点依次升高。
(3)卤素单质与变价金属(如Fe)反应。2Fe+3X2 2FeX3(X=F、Cl、Br),
Fe+X2 FeX2(X=I)。
3.卤素单质的特殊性质
(1)Br2在常温下是惟一的液态非金属单质,易挥发。
(2)碘为紫黑色固体,易升华,淀粉遇I2变蓝色。尝试应用 1.(2013·梅州高一检测)(双选题)下列变化规律中错误的是( )?
A.粒子半径:F- < Cl- < Br-
C.还原性:F- < Cl- < Br- < I-?
D.氧化性:F2 < Cl2 < Br2 < I2?BD2.卤素单质(从氟到碘)性质的递变规律正确的是( )
A.密度逐渐减小,颜色逐渐加深
B.氧化性逐渐增强
C.还原性逐渐减弱
D.与氢化合逐渐困难D3.(2013·厦门检测) F、Cl和Br都是第ⅦA族元素,关于这三种元素原子的说法正确的是( )?
A.原子半径:F>Cl>Br?
B.最外层电子数都相同?
C.核外电子层数都相同?
D.最外层电子数都不相同B一、卤族元素的性质 (2013·北京海淀模拟)按照氟、氯、溴、碘的顺序,下列递变规律中正确的是( )
A.单质的熔、沸点逐渐降低
B.与H2反应越来越容易
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.单质的氧化性逐渐增强解析:按照氟、氯、溴、碘的顺序,卤素单质的熔、沸点逐渐升高,常温下F2、Cl2为气态,Br2为液态,I2为固态,A项错误;卤素单质与H2反应的条件越来越难,B项错误;单质的氧化性逐渐减弱,如Cl2+2KI===2KCl+I2,D项错误。
答案:C
名师点睛:卤族元素单质及其化合物的性质总结:
(1)按由F→I的顺序,元素的非金属性逐渐减弱。
(2)氢化物稳定性:HF>HCl>HBr>HI。
(3)氢化物还原性:HF
(5)密度:卤族元素同碱金属一致,自上而下,单质密度逐渐增大。
(6)熔、沸点:卤族元素同碱金属相反,自上而下,单质熔、沸点逐渐升高。
(7)溶解性:除F2外,卤素单质在水中的溶解性均不大,均易溶于有机溶剂。变式应用1.(双选题)下列关于卤素(从F→I)的说法正确的是( )
A.单质的颜色逐渐加深
B.气态氢化物的稳定性逐渐增强
C.原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D.与水反应,自身氧化还原剧烈程度为F2>Cl2>Br2>I2解析:卤族元素从F→I,单质的颜色逐渐加深,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱,非金属性减弱,则气态氢化物的稳定性减弱。与水反应时,F2和H2O剧烈反应,F2是氧化剂,H2O是还原剂,而不是F2的自身氧化还原反应。
答案:AC二、元素非金属性强弱比较 (2011年长沙检测)X、Y是元素周期表第ⅦA 族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.Y的单质能将X从NaX的溶液中置换出来
C.X的单质比Y的单质更容易与氢气反应
D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强 解析:因X、Y是元素周期表中第ⅦA族的元素,若X的电子层数多,则说明X比Y的非金属性弱,A项错误;事实说明Y比X更活泼,B项错误;据单质与H2化合的难易判断,且X2与H2化合更容易,说明氧化性:X2>Y2,则非金属性:X>Y,C项正确;应据最高价氧化物对应水化物的酸性强弱来判断非金属性的强弱,D项错误。
答案:C变式应用2.(2011年青岛检测)甲、乙两种非金属:①甲比乙容易与氢化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的有( )
A.只有④ B.只有⑤
C.①②③ D.①②③④⑤C水平测试1.向下列物质的水溶液里加入用硝酸酸化的硝酸银溶液,不能生成沉淀的是( )
A.CaCl2 B.KClO3 C.KI D.NaBr解析:卤素离子如Cl-、Br-、I-均可与Ag+反应产生沉淀,而KClO3在水溶液中不能电离出Cl-,因此不能产生沉淀。
答案:B2.砹是原子序数最大的卤族元素,根据卤族元素性质的递变性,对砹及其化合物的叙述,正确的是( )
A.与H2的化合能力:At2>I2
B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹易溶于水,难溶于四氯化碳解析:从F到At,元素的非金属性逐渐减弱,与H2的化合能力逐渐减弱,A项不正确;从F2到I2,单质的颜色逐渐加深,I2是紫黑色晶体,砹是黑色固体,B项不正确;卤族元素的原子,最外电子层上都有7个电子,C项正确;由I2微溶于水,易溶于四氯化碳溶液,可推知At2微溶于水,易溶于四氯化碳溶液,D项不正确。
答案:C3.下列对溴性质的描述,其中错误的是 ( )
A.溴单质溶于水时,部分与H2O反应生成HBrO和HBr
B.溴单质只具有氧化性
C.溴原子最外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴蒸气与氢气在加热条件下反应生成HBrB4.(2011年嘉兴检测)下列不能说明氯元素的非金属性比硫元素强的事实是 ( )
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
A.②⑤ B.①② C.①②④ D.①③⑤解析:含氧酸的氧化性不能作为判断元素非金属性强弱的依据;最外层电子数多,元素的非金属性不一定强,如非金属性:O>Cl,但最外层电子数:O
答案:A6.(2011年长沙检测)下表为元素周期表的一部分。(1)表中元素____________(填写元素符号,下同)的非金属性最强;元素____________的金属性最强;元素____________的单质室温下呈液态。FKBr(2)表中元素⑦的原子结构示意图是____________。
(3)表中元素⑥⑩氢化物的稳定性顺序为__________>____________(填写化学式,下同)。
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:____________>____________。HClO4 H2SO4HF HCl能力提升7.甲、乙、丙、丁四个集气瓶中装有Cl2、H2、HCl、HBr中的任意一种气体。若将甲和丁两瓶气体混合,见强光则发生爆炸;若将甲和乙两瓶气体混合,则见瓶壁上出现红棕色的小液滴,那么气体乙是( )
A.H2 B.Cl2
C.HBr D.HClC8.下列关于碱金属元素和卤素的说法中,错误的是( )
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.溴单质与水的反应比氯单质与水的反应更剧烈D9.某学生往一支试管里按一定次序分别加入下列几种物质:
A.KI溶液,B.淀粉溶液,C.NaOH溶液,D.氯水。
发现溶液颜色按下面次序变化:
①无色―→②棕黄色―→③蓝色―→④无色。
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是__________________________________________________。(2)写出①→②的离子反应方程式:________________________________________________________________________。
(3)写出③→④的化学反应方程式:________________________________________________________________________。解析:溶液显棕黄色,说明溶液中有I2生成,氯水和KI溶液反应生成I2,而氯水显浅黄绿色,故①为KI溶液,②为加入氯水,溶液显蓝色是由于淀粉遇I2形成的,故③为加入淀粉溶液;又由于I2+2NaOH===NaI+NaIO+H2O,加入NaOH溶液后I2逐渐消失,蓝色将逐渐褪为无色,故④为加入NaOH溶液。
答案:(1)A、D、B、C
(2)2I-+Cl2===I2+2Cl-
(3)I2+2NaOH===NaI+NaIO+H2O10.某学生在做元素性质与原子结构的关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的。
探究同一主族元素性质的递变规律。
(2)实验用品。
仪器:试管、胶头滴管。药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容)。(4)实验结论:________________________________________________________________________。
(5)问题和讨论。
①上述两个实验中发生反应的离子方程式分别为________________________、________________________________________________________________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________________、____________________________。解析:向溴化钠溶液中加入新制氯水,发生反应:Cl2+2Br-===Br2+2Cl-,证明氧化性:Cl2>Br2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈橙红色。向碘化钠溶液中加入新制溴水,发生反应:Br2+2I-===I2+2Br-,证明氧化性:Br2>I2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下原子的得电子能力逐渐减弱。
答案: (3)①橙红 ②紫红
(4)同主族元素从上到下原子的得电子能力逐渐减弱 (5)①Cl2+2Br-===Br2+2Cl- 2I-+Br2===2Br-+I2 ②HF的稳定性比HCl强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(其他合理答案也可) 感谢您的使用,退出请按ESC键本小节结束
