【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第4课时 核素 同位素(47张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第一节 第4课时 核素 同位素(47张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 690.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:02:58 | ||
图片预览










文档简介
课件47张PPT。第一节 元素周期表
第4课时 核素 同位素物质结构 元素周期律第4课时 核素 同位素在1911年前后,英国物理学家卢瑟福把一束做高速运动的α粒子(质量数为4的带2个单位正电荷的氦核)射向一片极薄的金箔。他惊奇地发现,过去人们一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟能使大多数α粒子畅通无阻地通过,好像金箔不在那儿似的!但也有少数的α粒子发生偏转,极少数α粒子被笔直弹回。1.了解质量数的定义。
2.了解原子的表示方法。
3.了解核素和同位素的概念。
4.能识别不同概念间的相互关系。原子的组成1.原子的构成2.数值关系
(1)质量数:忽略电子的质量,将核内所有__________的相对质量取近似值相加所得的数值。质子
中子核外电子 负质子和中子(2)数值关系。
质量关系:质量数(A)=________________________。
数量关系:原子序数=核电荷数=______=_________。
3.表示方法
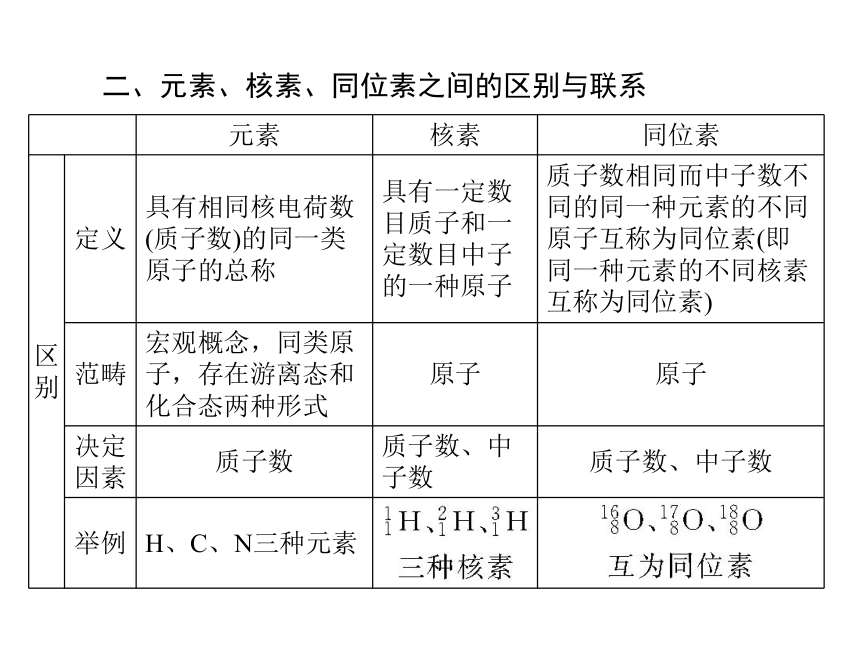
X中X表示某元素的______,Z表示________,A表示________。质子数(Z)+中子数(N)质子数 核外电子数原子 质子数质量数核素、同位素1.核素
把具有一定数目的______和一定数目的______的一种原子叫做核素。
2.同位素
(1)定义。
______相同而______不同的同一元素的不同原子互称为同位素,即同一元素的不同______互称为同位素。质子 中子质子数 中子数核素(2)特点。
天然存在的同位素,相互间保持一定的比率。
(3)核素与元素之间的关系:有的元素有多种核素,有的元素只有一种核素,所以元素分单核素元素和多核素元素。(4)同位素的用途。
同位素在日常生活、工农业生产和科学研究中有着重要的用途,如:① C在考古工作中用于测定一些文物的______;② U用于制造原子弹、核电站______;③ 用于制造______;④放射性同位素释放的射线可用于育种、治疗癌症和肿瘤等。年代 发电氢弹应用思考:1.所有原子的原子核都有质子和中子吗?
2.质子数相同而中子数不同的微粒一定互为同位素吗?
3.结合核外电子排布讨论:互称同位素的不同核素为什么具有几乎完全相同的化学性质?提示:不一定。原子核中一定含质子,但不一定有中子,如H中只有质子而没有中子。提示:不一定。例如:OH-与F-,它们质子数均为9,核外电子数均为10,但不能说它们互为同位素,因为它们不是同一种元素构成的。 提示:同种元素的不同核素核内质子数相同,具有完全相同的核外电子排布,因此化学性质几乎完全相同。综合拓展一、原子或离子中各微粒间的数目关系
1.原子的质子数=核电荷数=原子序数=核外电子数。
2.阳离子所带电荷数=质子数-核外电子数;
阴离子所带电荷数=核外电子数-质子数。
3.质量数(A)=质子数(Z)+中子数(N)。
4.质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
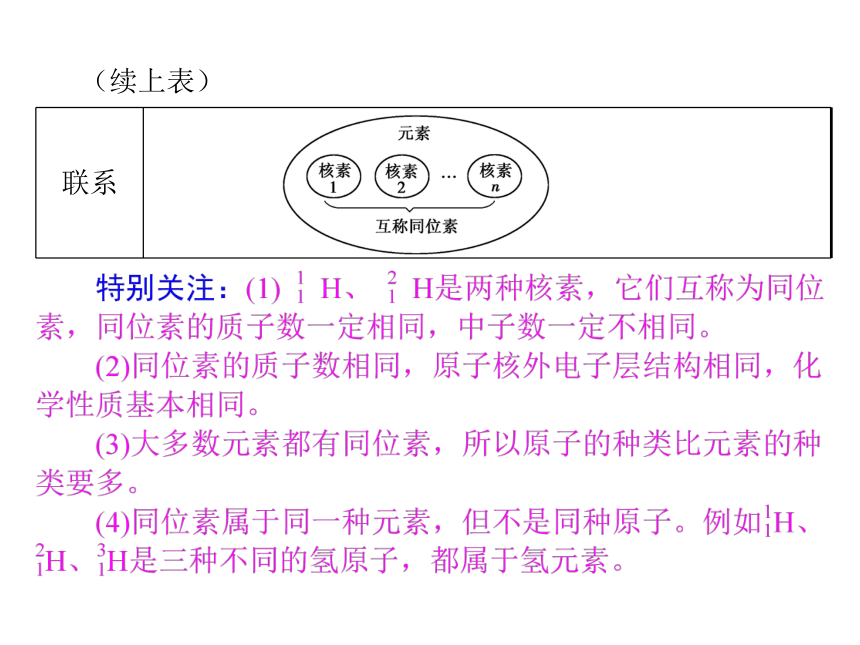
5.质子数(Z)=阴离子的核外电子数-阴离子的电荷数。 二、元素、核素、同位素之间的区别与联系(续上表)3.元素的近似相对原子质量
核素的相对原子质量取整数值即核素的近似相对原子质量,此整数值与核素的质量数相等。因此,如果用元素的各种核素的质量数代替核素的相对原子质量进行平均相对原子质量计算,则得到元素的近似相对原子质量。
Ar(E)=A(E1)·x(E1)+A(E2)·x(E2)+A(E3)·x(E3)+…=(Ei)·x(Ei)。其中,A(Ei)是E的各种同位素原子的质量数,x(Ei)是E的各种同位素原子所占的百分比。 特别关注:(1)关于相对原子质量的计算题,要先看清求的是原子还是元素的相对原子质量。
(2)x(Ei)不是质量分数,是物质的量分数或各原子个数百分比。1.(2013·厦门检测)下列互为同位素的是( )
A.H2与D2
B.14N与14C
C.16O与17O
D.金刚石与石墨尝试应用C2.据报道,某医院正在研究用放射性的碘 I治疗肿瘤。该原子的原子核内中子数与核外电子数之差为( )
A.72 B.19 C.53 D.125B解析:32S与33S互为同位素,应具有相同的质子数、电子数,不同的中子数,硫原子的最外层电子数为6。
答案:D3.32S与33S互为同位素,下列说法正确的是( )
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数一、核素、同位素的概念辨析 我国稀土资源丰富。下列有关稀土元素 Sm与 Sm的说法正确的是( )
A. Sm与 Sm互为同位素
B. Sm与 Sm的质量数相同
C. Sm与 Sm是同一种核素
D. Sm与 Sm的核外电子数和中子数均为62解析:质子数相同而中子数不同的核素互称为同位素,具有一定数目的质子数和中子数的原子称为核素。 Sm 与 Sm质量数不同,B错; Sm与 Sm是不同种核素,C错; Sm与 Sm的中子数不同,D错。
答案:A
名师点睛:元素、核素、同位素的判断方法:
(1)判断元素、同位素和核素时,要抓住各种微粒区别的本质。即质子数相同的原子就是同种元素;质子数和中子数均相同的就是同种原子,也称为核素;同种元素的不同核素互称为同位素。 (2)答题时要认真分析原子表示符号的n组数字。 X,只要Z相同,就是同种元素;Z和A均相同,是同种核素;Z相同,A不相同的互称同位素;Z不相同的无论A是否相同,均不是同种元素,更不能称为同位素。变式应用解析:83Bi和83Bi互为同位素,质子数相同,电子数相同,中子数不同。
答案:B二、原子中各微粒间的数量关系某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )解析:答案:A名师点睛:
(1)没有明确某分子的相对分子质量时,可以用分子中各原子质量数之和来代替。?
(2)判断一个分子所含的质子、电子或中子数时要注意分子中原子的个数,例如,本题中HmX分子中含有m个H,所以H元素的质子总数为m。变式应用解析:解答本题应明确符号 表示的含义及同位素的概念。 是铀元素的一种核素,质量数为235,核内质子数和核外电子数都是92,核内中子数为235-92=143;由同位素的概念知, 互为同位素。
答案:CD水平测试1.只含有一种元素的物质不可能是( )
A.混合物 B.化合物
C.纯净物 D.单质解析:化合物是由两种或两种以上元素组成的纯净物。
答案:B2.下列说法中正确的是( )
A.质子数相同的微粒一定属于同一种元素
B.质子数相同,电子数也相同的两种微粒,不可能是一种原子和一种离子
C.原子核内的质子数一定等于中子数
D.电子数相同的微粒一定是同一种元素解析:对于A,如HF、NH3、H2O分子中质子数均为10,但不是同一种元素,A错;多数原子中质子数和中子数不相等,C错;D和A类似,如Na+、Mg2+、Al3+、NH 均有10个电子,但不是同一种元素。
答案:B3.重水(D2O)是重要的核工业原料,下列说法错误的是( )?
A.氘(D)原子核外有1个电子?
B. 1H与D互称同位素?
C.H2O与D2O互称同素异形体?
D. 1H218O与D216O的相对分子质量相同C5.同温同压下,等容积的两个密闭集气瓶中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量不等
B.分子数和质量分别不相等
C.分子数、质量分别相等
D.原子数、中子数和质子数都分别相等解析:同温同压下,等体积的气体含有相同的分子数,故分子数相等;12C18O和14N2均为双原子分子,则所含原子数也相等;一个12C18O分子中含6+8=14个质子,30-14=16个中子,一个14N2分子中含7×2=14个质子,28-14=14个中子,所以两种气体所含质子数相等,中子数不等,质量数不等,质量不等。
答案:A6.(1)用X表示原子:
①中性原子的中子数:N=____________。
②阳离子的中子数:AXn+共有x个电子,则N=_______。
③阴离子的中子数:AXn-共有x个电子,则N=_______。
④分子或原子团的中子数:12C16O2分子中,N=______。
(2)已知某元素R原子的质量数为A,其阴离子Rn-含有x个电子,则m g Rn-中含中子的物质的量是_________mol。A-ZA-x-nA-x+n22能力提升7.具有相同质子数的两种粒子( )
A.一定是同种元素
B.一定是一种分子和一种离子
C.一定是不同离子
D.无法判断解析:采用举例验证的方法,如H、D、T即为具有相同质子数的同种元素,H+、D+、T+即为具有相同质子数的不同离子;NH 、Na+均为具有11个质子的微粒,但它们不是同种元素,而是两种离子;Ne、H2O均为含有10个质子的微粒,它们都是分子。
答案:D8.9.2 g金属钠投入到足量的重水中,则产生的气体中含有( )
A.0.2 mol中子
B.0.4 mol电子
C.0.2 mol质子
D.0.4 mol分子Na与重水反应的化学方程式为:
2Na+2D2O===2NaOD+D2↑
2 1
0.4 mol 0.2 mol
由方程式可知生成D2气体0.2 mol,所以气体中含中子0.4 mol,含电子0.4 mol,含质子0.4 mol,含分子0.2 mol,故B项正确。
答案:B9.用下列选项填空。
A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数
(1)同位素种类由____________决定。
(2)元素种类由 ____________决定。
(3)某元素有无同位素由 ____________决定。
(4)核素相对原子质量由____________决定。
(5)主族元素的化学性质主要由____________决定。ABABABD(6)核电荷数由____________决定。
(7)碱金属原子失电子能力相对强弱由________决定。
(8)原子得失电子能力相对强弱由____________决定。AEDE10.某元素的同位素 X,已知A=30,且A-Z=16,则:
(1)X元素为____________。
(2)X的气态氢化物与碳的氢化物中较稳定的是______(填化学式)。
(3)X单质与NaOH溶液反应的化学方程式为___________________________________________________。
(4)X的氧化物与HF反应的化学方程式为___________________________________________________。解析:30-Z=16,所以Z=14,即硅元素,其非金属性比碳弱,故CH4比SiH4更稳定。Si与NaOH溶液反应的化学方程式为Si+2NaOH+H2O===Na2SiO3+2H2↑。SiO2与HF反应的化学方程式为SiO2+4HF===SiF4+2H2O。
答案:(1)Si (2)CH4
(3)Si+2NaOH+H2O===Na2SiO3+2H2↑
(4)SiO2+4HF===SiF4+2H2O感谢您的使用,退出请按ESC键本小节结束
第4课时 核素 同位素物质结构 元素周期律第4课时 核素 同位素在1911年前后,英国物理学家卢瑟福把一束做高速运动的α粒子(质量数为4的带2个单位正电荷的氦核)射向一片极薄的金箔。他惊奇地发现,过去人们一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟能使大多数α粒子畅通无阻地通过,好像金箔不在那儿似的!但也有少数的α粒子发生偏转,极少数α粒子被笔直弹回。1.了解质量数的定义。
2.了解原子的表示方法。
3.了解核素和同位素的概念。
4.能识别不同概念间的相互关系。原子的组成1.原子的构成2.数值关系
(1)质量数:忽略电子的质量,将核内所有__________的相对质量取近似值相加所得的数值。质子
中子核外电子 负质子和中子(2)数值关系。
质量关系:质量数(A)=________________________。
数量关系:原子序数=核电荷数=______=_________。
3.表示方法
X中X表示某元素的______,Z表示________,A表示________。质子数(Z)+中子数(N)质子数 核外电子数原子 质子数质量数核素、同位素1.核素
把具有一定数目的______和一定数目的______的一种原子叫做核素。
2.同位素
(1)定义。
______相同而______不同的同一元素的不同原子互称为同位素,即同一元素的不同______互称为同位素。质子 中子质子数 中子数核素(2)特点。
天然存在的同位素,相互间保持一定的比率。
(3)核素与元素之间的关系:有的元素有多种核素,有的元素只有一种核素,所以元素分单核素元素和多核素元素。(4)同位素的用途。
同位素在日常生活、工农业生产和科学研究中有着重要的用途,如:① C在考古工作中用于测定一些文物的______;② U用于制造原子弹、核电站______;③ 用于制造______;④放射性同位素释放的射线可用于育种、治疗癌症和肿瘤等。年代 发电氢弹应用思考:1.所有原子的原子核都有质子和中子吗?
2.质子数相同而中子数不同的微粒一定互为同位素吗?
3.结合核外电子排布讨论:互称同位素的不同核素为什么具有几乎完全相同的化学性质?提示:不一定。原子核中一定含质子,但不一定有中子,如H中只有质子而没有中子。提示:不一定。例如:OH-与F-,它们质子数均为9,核外电子数均为10,但不能说它们互为同位素,因为它们不是同一种元素构成的。 提示:同种元素的不同核素核内质子数相同,具有完全相同的核外电子排布,因此化学性质几乎完全相同。综合拓展一、原子或离子中各微粒间的数目关系
1.原子的质子数=核电荷数=原子序数=核外电子数。
2.阳离子所带电荷数=质子数-核外电子数;
阴离子所带电荷数=核外电子数-质子数。
3.质量数(A)=质子数(Z)+中子数(N)。
4.质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
5.质子数(Z)=阴离子的核外电子数-阴离子的电荷数。 二、元素、核素、同位素之间的区别与联系(续上表)3.元素的近似相对原子质量
核素的相对原子质量取整数值即核素的近似相对原子质量,此整数值与核素的质量数相等。因此,如果用元素的各种核素的质量数代替核素的相对原子质量进行平均相对原子质量计算,则得到元素的近似相对原子质量。
Ar(E)=A(E1)·x(E1)+A(E2)·x(E2)+A(E3)·x(E3)+…=(Ei)·x(Ei)。其中,A(Ei)是E的各种同位素原子的质量数,x(Ei)是E的各种同位素原子所占的百分比。 特别关注:(1)关于相对原子质量的计算题,要先看清求的是原子还是元素的相对原子质量。
(2)x(Ei)不是质量分数,是物质的量分数或各原子个数百分比。1.(2013·厦门检测)下列互为同位素的是( )
A.H2与D2
B.14N与14C
C.16O与17O
D.金刚石与石墨尝试应用C2.据报道,某医院正在研究用放射性的碘 I治疗肿瘤。该原子的原子核内中子数与核外电子数之差为( )
A.72 B.19 C.53 D.125B解析:32S与33S互为同位素,应具有相同的质子数、电子数,不同的中子数,硫原子的最外层电子数为6。
答案:D3.32S与33S互为同位素,下列说法正确的是( )
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数一、核素、同位素的概念辨析 我国稀土资源丰富。下列有关稀土元素 Sm与 Sm的说法正确的是( )
A. Sm与 Sm互为同位素
B. Sm与 Sm的质量数相同
C. Sm与 Sm是同一种核素
D. Sm与 Sm的核外电子数和中子数均为62解析:质子数相同而中子数不同的核素互称为同位素,具有一定数目的质子数和中子数的原子称为核素。 Sm 与 Sm质量数不同,B错; Sm与 Sm是不同种核素,C错; Sm与 Sm的中子数不同,D错。
答案:A
名师点睛:元素、核素、同位素的判断方法:
(1)判断元素、同位素和核素时,要抓住各种微粒区别的本质。即质子数相同的原子就是同种元素;质子数和中子数均相同的就是同种原子,也称为核素;同种元素的不同核素互称为同位素。 (2)答题时要认真分析原子表示符号的n组数字。 X,只要Z相同,就是同种元素;Z和A均相同,是同种核素;Z相同,A不相同的互称同位素;Z不相同的无论A是否相同,均不是同种元素,更不能称为同位素。变式应用解析:83Bi和83Bi互为同位素,质子数相同,电子数相同,中子数不同。
答案:B二、原子中各微粒间的数量关系某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )解析:答案:A名师点睛:
(1)没有明确某分子的相对分子质量时,可以用分子中各原子质量数之和来代替。?
(2)判断一个分子所含的质子、电子或中子数时要注意分子中原子的个数,例如,本题中HmX分子中含有m个H,所以H元素的质子总数为m。变式应用解析:解答本题应明确符号 表示的含义及同位素的概念。 是铀元素的一种核素,质量数为235,核内质子数和核外电子数都是92,核内中子数为235-92=143;由同位素的概念知, 互为同位素。
答案:CD水平测试1.只含有一种元素的物质不可能是( )
A.混合物 B.化合物
C.纯净物 D.单质解析:化合物是由两种或两种以上元素组成的纯净物。
答案:B2.下列说法中正确的是( )
A.质子数相同的微粒一定属于同一种元素
B.质子数相同,电子数也相同的两种微粒,不可能是一种原子和一种离子
C.原子核内的质子数一定等于中子数
D.电子数相同的微粒一定是同一种元素解析:对于A,如HF、NH3、H2O分子中质子数均为10,但不是同一种元素,A错;多数原子中质子数和中子数不相等,C错;D和A类似,如Na+、Mg2+、Al3+、NH 均有10个电子,但不是同一种元素。
答案:B3.重水(D2O)是重要的核工业原料,下列说法错误的是( )?
A.氘(D)原子核外有1个电子?
B. 1H与D互称同位素?
C.H2O与D2O互称同素异形体?
D. 1H218O与D216O的相对分子质量相同C5.同温同压下,等容积的两个密闭集气瓶中分别充满12C18O和14N2两种气体。关于这两个容器中气体的说法正确的是( )
A.质子数相等,质量不等
B.分子数和质量分别不相等
C.分子数、质量分别相等
D.原子数、中子数和质子数都分别相等解析:同温同压下,等体积的气体含有相同的分子数,故分子数相等;12C18O和14N2均为双原子分子,则所含原子数也相等;一个12C18O分子中含6+8=14个质子,30-14=16个中子,一个14N2分子中含7×2=14个质子,28-14=14个中子,所以两种气体所含质子数相等,中子数不等,质量数不等,质量不等。
答案:A6.(1)用X表示原子:
①中性原子的中子数:N=____________。
②阳离子的中子数:AXn+共有x个电子,则N=_______。
③阴离子的中子数:AXn-共有x个电子,则N=_______。
④分子或原子团的中子数:12C16O2分子中,N=______。
(2)已知某元素R原子的质量数为A,其阴离子Rn-含有x个电子,则m g Rn-中含中子的物质的量是_________mol。A-ZA-x-nA-x+n22能力提升7.具有相同质子数的两种粒子( )
A.一定是同种元素
B.一定是一种分子和一种离子
C.一定是不同离子
D.无法判断解析:采用举例验证的方法,如H、D、T即为具有相同质子数的同种元素,H+、D+、T+即为具有相同质子数的不同离子;NH 、Na+均为具有11个质子的微粒,但它们不是同种元素,而是两种离子;Ne、H2O均为含有10个质子的微粒,它们都是分子。
答案:D8.9.2 g金属钠投入到足量的重水中,则产生的气体中含有( )
A.0.2 mol中子
B.0.4 mol电子
C.0.2 mol质子
D.0.4 mol分子Na与重水反应的化学方程式为:
2Na+2D2O===2NaOD+D2↑
2 1
0.4 mol 0.2 mol
由方程式可知生成D2气体0.2 mol,所以气体中含中子0.4 mol,含电子0.4 mol,含质子0.4 mol,含分子0.2 mol,故B项正确。
答案:B9.用下列选项填空。
A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数
(1)同位素种类由____________决定。
(2)元素种类由 ____________决定。
(3)某元素有无同位素由 ____________决定。
(4)核素相对原子质量由____________决定。
(5)主族元素的化学性质主要由____________决定。ABABABD(6)核电荷数由____________决定。
(7)碱金属原子失电子能力相对强弱由________决定。
(8)原子得失电子能力相对强弱由____________决定。AEDE10.某元素的同位素 X,已知A=30,且A-Z=16,则:
(1)X元素为____________。
(2)X的气态氢化物与碳的氢化物中较稳定的是______(填化学式)。
(3)X单质与NaOH溶液反应的化学方程式为___________________________________________________。
(4)X的氧化物与HF反应的化学方程式为___________________________________________________。解析:30-Z=16,所以Z=14,即硅元素,其非金属性比碳弱,故CH4比SiH4更稳定。Si与NaOH溶液反应的化学方程式为Si+2NaOH+H2O===Na2SiO3+2H2↑。SiO2与HF反应的化学方程式为SiO2+4HF===SiF4+2H2O。
答案:(1)Si (2)CH4
(3)Si+2NaOH+H2O===Na2SiO3+2H2↑
(4)SiO2+4HF===SiF4+2H2O感谢您的使用,退出请按ESC键本小节结束
