第九单元 课题3 溶液的浓度 课件(共32张PPT 内嵌视频) -2022-2023学年九年级下册人教版化学同步精品课件
文档属性
| 名称 | 第九单元 课题3 溶液的浓度 课件(共32张PPT 内嵌视频) -2022-2023学年九年级下册人教版化学同步精品课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 08:24:23 | ||
图片预览









文档简介
(共32张PPT)
课题3 溶液的浓度
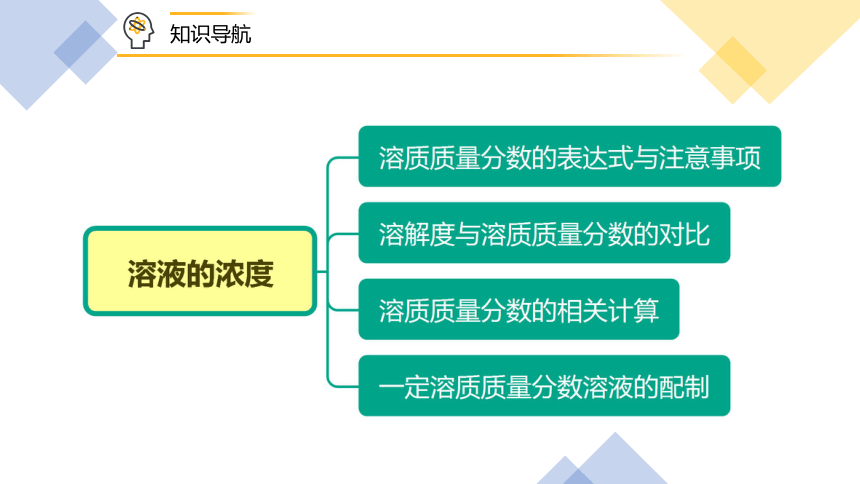
知识导航
点奶茶时,你喝的是哪种甜度?
甜度不同,通俗来说,就是糖水的浓稀不同。
那么,在化学中如何定量地表示溶液的浓稀呢?
实验探究——三种浓稀不同的硫酸铜溶液
在室温下,向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。
实验探究——三种浓稀不同的硫酸铜溶液
向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,振荡,使硫酸铜全部溶解。
试管编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
较浅
适中
较深
20
20
20
0.1
0.5
2
20.1
20.5
22
哪种溶液最浓?哪种溶液最稀?你判断的根据是什么?
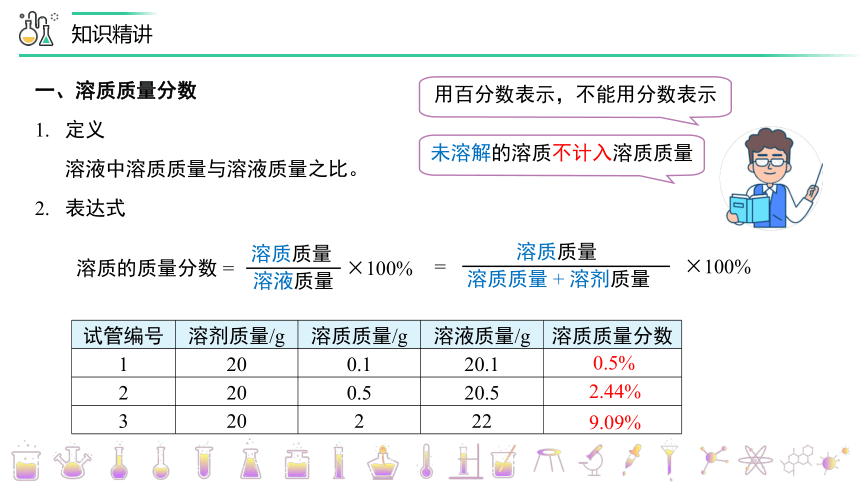
一、溶质质量分数
1. 定义
溶液中溶质质量与溶液质量之比。
2. 表达式
溶质的质量分数 = ×100%
溶质质量
溶液质量
= ×100%
溶质质量
溶质质量 + 溶剂质量
用百分数表示,不能用分数表示
未溶解的溶质不计入溶质质量
试管编号 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
1 20 0.1 20.1
2 20 0.5 20.5
3 20 2 22
0.5%
2.44%
9.09%
一些常见的溶液
体积分数,不是质量分数
资料卡片——体积分数
除质量分数以外,人们有时也用体积分数来表示溶液的浓度。例如,用作消毒剂的医用酒精中乙醇的体积分数为75%,就是指每100体积的医用酒精中含75体积的乙醇。
二、溶解度与溶质质量分数的对比
溶解度 溶质质量分数
温度 一定 不一定
溶剂量 100g 不定量
溶液状态 达到饱和 饱和或不饱和
单位 克 无单位
影响因素 受外界条件(温度、压强等)影响 不受外界条件影响
转化关系 某温度时,某物质的饱和溶液中,溶解度与溶质质量分数的关系为:
饱和溶液中的溶质的质量分数 =
三、溶质质量分数的相关计算
1. 公式的直接计算
①溶质的质量分数=
②溶质质量=溶液质量×溶质的质量分数
③溶液质量=
×100%
溶质质量
溶液质量
溶质质量
溶质的质量分数
三、溶质质量分数的相关计算
2. 溶液稀释/浓缩的计算
(1)加水:A×a%=(A + m水)×b%
(2)加稀溶液:A×a% + B×b%=(A + B)×c%
(3)加溶质:A×a% + B=(A + B)×b%
(4)蒸发溶剂:A×a%=(A - m水)×b%
(5)加浓溶液:A×a% + B×b%=(A + B)×c%
三、溶质质量分数的相关计算
3.与溶解度的换算
溶质的质量分数 =
三、溶质质量分数的相关计算
4. 配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量。
5. 基于化学方程式的溶液浓度计算
(1)书写正确的化学方程式,根据化学方程式列出有关物质的比例式(溶质的质量)。
(2)反应后溶液的总质量,可根据质量守恒定律来求。
即将反应前所有物质的质量相加,再减去反应后放出的气体或沉淀的质量:
m(溶液)=m(反应物)-m(沉淀)-m(气体)。
四、溶液的配制
1. 用固体配制过程(以配制50 g质量分数为6%的氯化钠溶液为例)
实验仪器
实验 步骤 计算 所需氯化钠的质量分别为:_____g;所需水的体积为:_____mL。
称量 用托盘天平称量所需的氯化钠,放入烧杯中。
量取 用量筒量取,倒入盛有氯化钠的烧杯中。
溶解 用玻璃棒搅拌,__________________。
装瓶 把配好的溶液装入试剂瓶,盖好瓶塞并贴上标签,注明试剂的_____、__________。
托盘天平、药匙、烧杯、量筒、胶头滴管、玻璃棒
3
47
加速溶解
名称 质量分数
2. 若是用浓溶液配制稀溶液,则操作步骤为:计算、量取、混匀、装瓶保存。
3. 误差分析
操作 质量分数变化
称量的溶质不纯,含其他杂质
称量时将砝码与药品位置颠倒,并使用了游码
砝码生锈
用量筒量取水时仰视读数
用量筒量取水时俯视读数
将量筒内的水倒入烧杯时,有水溅出
装瓶时溶液溅出
偏小
偏小
偏大
偏小
偏大
偏大
无影响
知识点都掌握了吗?来做几道题检测下~
【例1】关于50g 10%的氯化钠溶液,下列叙述正确的是
A.50g水中溶有5g氯化钠
B.将10g氯化钠溶于90g水中,可制得该浓度溶液
C.溶液中氯化钠与水的质量比为1:10
D.溶液中氯化钠与水的质量比为9:1
B
题型一:溶液质量分数的理解
【变1-4】图1是甲,乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50gR如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
B
题型一:溶液质量分数的理解
【变2-1】把30克质量分数为20%的氢氧化钠溶液,加水稀释到100克,取出稀释后溶液20克,此溶液中NaOH的质量分数为
A.5% B.6% C.3% D.2%
B
题型二:溶液质量分数的相关计算
【变4-1】20℃时,NaCl的溶解度为36.0g,现有该温度下200g 5%的NaCl溶液,求下列变化后溶液中NaCl的质量分数。
(1)加10gNaCl完全溶解:_______;
(2)加20g水:_______;
(3)蒸发20g水:_______。(计算结果精确到0.1%)
题型二:溶液质量分数的相关计算
【答案】(1)9.5%;(2)4.5%;(3)5.6%
【变4-3】将40g溶质质量分数为20%的NaCl溶液变为10%,下列方法中正确的是
A.加人8gNaCl固体
B.加入40g水
C.倒掉20g溶液
D.加入40g5%的NaCl溶液
B
题型二:溶液质量分数的相关计算
【例5】实验室用6g石灰石样品(杂质不参加反应)与20g稀盐酸恰好完全反应,测得残留物质量为23.8g。求:
(1)生成的二氧化碳的质量是______。
(2)稀盐酸溶液中溶质的质量分数。
题型二:溶液质量分数的相关计算
【答案】(1)2.2g (2)18.25%
【变5-2】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取10 g该样品,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算:
(1)样品中铜的质量分数______。
(2)反应所消耗的稀硫酸的质量______。
(3)反应后所得溶液中溶质的质量分数______。
(计算结果精确到0.1%)
题型二:溶液质量分数的相关计算
【答案】(1)67.5%(2)50 g(3)15.1%
【例7】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
(1)4.0g石灰石样品中碳酸钙的质量是__________g。
(2)求稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
题型二:溶液质量分数的相关计算
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
【答案】(1)3.6g (2)7.3%
【例10】在进行“一定溶质质量分数的氯化钠溶液的配制”实验活动中常出现以下错误操作。
(1)其中不影响所配溶液浓度的操作是______(填序号,下同)。
(2)造成所配溶液浓度偏大的操作为_______,其原因是______。
题型三:溶液的配制
【答案】(1)D (2) C 俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大
【例11】如图是配制50g
质量分数为5%的氯化钠
溶液的操作,试回答:
(1)正确的操作顺序是_______(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
题型三:溶液的配制
【例11】
题型三:溶液的配制
【答案】(1)④⑤①②③
(2)取出氯化钠直至天平平衡
(3) 50mL 偏小
(4)搅拌,加快溶解速率
(5)75g
知识导航
课题3 溶液的浓度
知识导航
点奶茶时,你喝的是哪种甜度?
甜度不同,通俗来说,就是糖水的浓稀不同。
那么,在化学中如何定量地表示溶液的浓稀呢?
实验探究——三种浓稀不同的硫酸铜溶液
在室温下,向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,振荡,使硫酸铜全部溶解,比较三种硫酸铜溶液的颜色。
实验探究——三种浓稀不同的硫酸铜溶液
向三个小烧杯中各加入20mL水,然后分别加入0.1g、0.5g、2g无水硫酸铜,振荡,使硫酸铜全部溶解。
试管编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
较浅
适中
较深
20
20
20
0.1
0.5
2
20.1
20.5
22
哪种溶液最浓?哪种溶液最稀?你判断的根据是什么?
一、溶质质量分数
1. 定义
溶液中溶质质量与溶液质量之比。
2. 表达式
溶质的质量分数 = ×100%
溶质质量
溶液质量
= ×100%
溶质质量
溶质质量 + 溶剂质量
用百分数表示,不能用分数表示
未溶解的溶质不计入溶质质量
试管编号 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
1 20 0.1 20.1
2 20 0.5 20.5
3 20 2 22
0.5%
2.44%
9.09%
一些常见的溶液
体积分数,不是质量分数
资料卡片——体积分数
除质量分数以外,人们有时也用体积分数来表示溶液的浓度。例如,用作消毒剂的医用酒精中乙醇的体积分数为75%,就是指每100体积的医用酒精中含75体积的乙醇。
二、溶解度与溶质质量分数的对比
溶解度 溶质质量分数
温度 一定 不一定
溶剂量 100g 不定量
溶液状态 达到饱和 饱和或不饱和
单位 克 无单位
影响因素 受外界条件(温度、压强等)影响 不受外界条件影响
转化关系 某温度时,某物质的饱和溶液中,溶解度与溶质质量分数的关系为:
饱和溶液中的溶质的质量分数 =
三、溶质质量分数的相关计算
1. 公式的直接计算
①溶质的质量分数=
②溶质质量=溶液质量×溶质的质量分数
③溶液质量=
×100%
溶质质量
溶液质量
溶质质量
溶质的质量分数
三、溶质质量分数的相关计算
2. 溶液稀释/浓缩的计算
(1)加水:A×a%=(A + m水)×b%
(2)加稀溶液:A×a% + B×b%=(A + B)×c%
(3)加溶质:A×a% + B=(A + B)×b%
(4)蒸发溶剂:A×a%=(A - m水)×b%
(5)加浓溶液:A×a% + B×b%=(A + B)×c%
三、溶质质量分数的相关计算
3.与溶解度的换算
溶质的质量分数 =
三、溶质质量分数的相关计算
4. 配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量。
5. 基于化学方程式的溶液浓度计算
(1)书写正确的化学方程式,根据化学方程式列出有关物质的比例式(溶质的质量)。
(2)反应后溶液的总质量,可根据质量守恒定律来求。
即将反应前所有物质的质量相加,再减去反应后放出的气体或沉淀的质量:
m(溶液)=m(反应物)-m(沉淀)-m(气体)。
四、溶液的配制
1. 用固体配制过程(以配制50 g质量分数为6%的氯化钠溶液为例)
实验仪器
实验 步骤 计算 所需氯化钠的质量分别为:_____g;所需水的体积为:_____mL。
称量 用托盘天平称量所需的氯化钠,放入烧杯中。
量取 用量筒量取,倒入盛有氯化钠的烧杯中。
溶解 用玻璃棒搅拌,__________________。
装瓶 把配好的溶液装入试剂瓶,盖好瓶塞并贴上标签,注明试剂的_____、__________。
托盘天平、药匙、烧杯、量筒、胶头滴管、玻璃棒
3
47
加速溶解
名称 质量分数
2. 若是用浓溶液配制稀溶液,则操作步骤为:计算、量取、混匀、装瓶保存。
3. 误差分析
操作 质量分数变化
称量的溶质不纯,含其他杂质
称量时将砝码与药品位置颠倒,并使用了游码
砝码生锈
用量筒量取水时仰视读数
用量筒量取水时俯视读数
将量筒内的水倒入烧杯时,有水溅出
装瓶时溶液溅出
偏小
偏小
偏大
偏小
偏大
偏大
无影响
知识点都掌握了吗?来做几道题检测下~
【例1】关于50g 10%的氯化钠溶液,下列叙述正确的是
A.50g水中溶有5g氯化钠
B.将10g氯化钠溶于90g水中,可制得该浓度溶液
C.溶液中氯化钠与水的质量比为1:10
D.溶液中氯化钠与水的质量比为9:1
B
题型一:溶液质量分数的理解
【变1-4】图1是甲,乙、丙三种物质的溶解度曲线,R是其中一种物质。现取50gR如图2进行有关实验,观察到①②中没有固体析出,③中有固体析出。下列说法正确的是
A.从图2的实验结合图1分析,R是丙物质
B.①和②的溶液中,溶质的质量分数不相等
C.①②③中,只有③的上层清液是饱和溶液
D.①②③中,①的溶液中溶质的质量分数最大
B
题型一:溶液质量分数的理解
【变2-1】把30克质量分数为20%的氢氧化钠溶液,加水稀释到100克,取出稀释后溶液20克,此溶液中NaOH的质量分数为
A.5% B.6% C.3% D.2%
B
题型二:溶液质量分数的相关计算
【变4-1】20℃时,NaCl的溶解度为36.0g,现有该温度下200g 5%的NaCl溶液,求下列变化后溶液中NaCl的质量分数。
(1)加10gNaCl完全溶解:_______;
(2)加20g水:_______;
(3)蒸发20g水:_______。(计算结果精确到0.1%)
题型二:溶液质量分数的相关计算
【答案】(1)9.5%;(2)4.5%;(3)5.6%
【变4-3】将40g溶质质量分数为20%的NaCl溶液变为10%,下列方法中正确的是
A.加人8gNaCl固体
B.加入40g水
C.倒掉20g溶液
D.加入40g5%的NaCl溶液
B
题型二:溶液质量分数的相关计算
【例5】实验室用6g石灰石样品(杂质不参加反应)与20g稀盐酸恰好完全反应,测得残留物质量为23.8g。求:
(1)生成的二氧化碳的质量是______。
(2)稀盐酸溶液中溶质的质量分数。
题型二:溶液质量分数的相关计算
【答案】(1)2.2g (2)18.25%
【变5-2】为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取10 g该样品,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如图所示。试计算:
(1)样品中铜的质量分数______。
(2)反应所消耗的稀硫酸的质量______。
(3)反应后所得溶液中溶质的质量分数______。
(计算结果精确到0.1%)
题型二:溶液质量分数的相关计算
【答案】(1)67.5%(2)50 g(3)15.1%
【例7】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
(1)4.0g石灰石样品中碳酸钙的质量是__________g。
(2)求稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
题型二:溶液质量分数的相关计算
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
【答案】(1)3.6g (2)7.3%
【例10】在进行“一定溶质质量分数的氯化钠溶液的配制”实验活动中常出现以下错误操作。
(1)其中不影响所配溶液浓度的操作是______(填序号,下同)。
(2)造成所配溶液浓度偏大的操作为_______,其原因是______。
题型三:溶液的配制
【答案】(1)D (2) C 俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,溶液质量偏小,溶质质量分数偏大
【例11】如图是配制50g
质量分数为5%的氯化钠
溶液的操作,试回答:
(1)正确的操作顺序是_______(填序号)。
(2)操作⑤中称量氯化钠时,若指针左偏,应进行的操作_______。
(3)操作②应选用_______量筒(50mL或100mL);量水时,若仰视读数,配得溶液的质量分数会_______(“偏大”或“偏小”)。
(4)操作③中玻璃棒的作用是_______。
(5)若用已配好的50g溶质质量分数为5%的氯化钠溶液配制溶质质量分数为2%的氯化钠溶液,需要加水的质量为_______。
题型三:溶液的配制
【例11】
题型三:溶液的配制
【答案】(1)④⑤①②③
(2)取出氯化钠直至天平平衡
(3) 50mL 偏小
(4)搅拌,加快溶解速率
(5)75g
知识导航
同课章节目录
