【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第二节 第2课时 元素周期律(56张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第二节 第2课时 元素周期律(56张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 805.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:04:19 | ||
图片预览







文档简介
课件56张PPT。第二节 元素周期律
第2课时 元素周期律物质结构 元素周期律第2课时 元素周期律 1865年,英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一种元素算起,每到第八种元素就和第一种元素的性质相近,很像音乐上的八度音循环,他干脆把元素的这种周期性叫做了标示元素关系的“八音律”表。但是,条件限制了他作进一步的探索,因为当时相对原子质量的测定值有错误,而且他“八音律”,并画出也没有考虑到还有尚未发现的元素,只是机械地按相对原子质量大小将元素排列起来,所以他没能揭示出元素之间的内在规律。纽兰兹已经下意识地摸到了“真理女神”的裙角,差点就揭示元素周期律了,一个伟大的发现与他擦肩而过!
那么,在现行元素周期表中一百多种元素之间的内在规律是什么呢?1.了解元素原子结构的周期性变化。
2.了解元素性质的周期性变化。
3.理解元素周期律的内容及实质。
4.形成结构决定性质的科学思想。元素周期律1.元素的原子核外电子排布、原子半径、元素化合价的变化规律
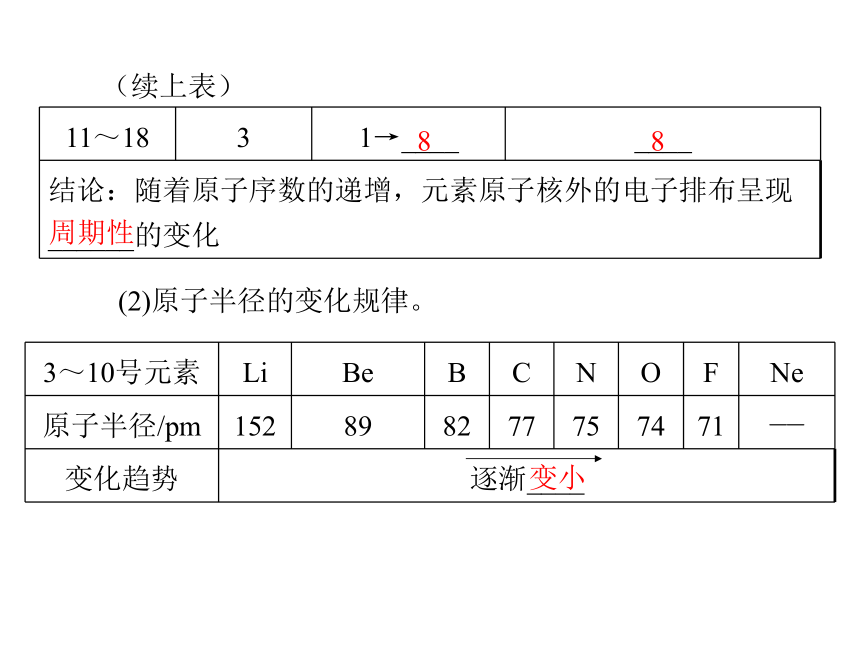
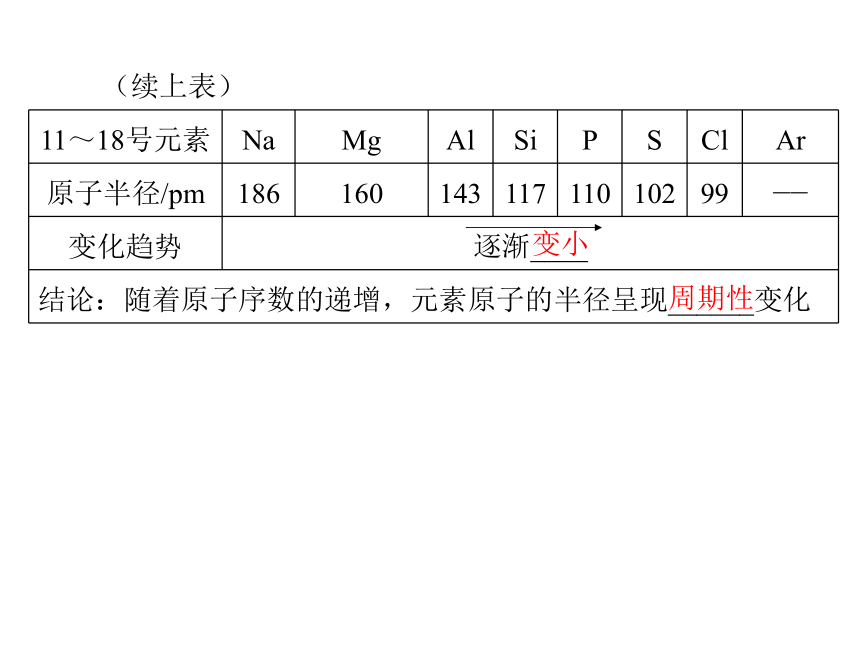
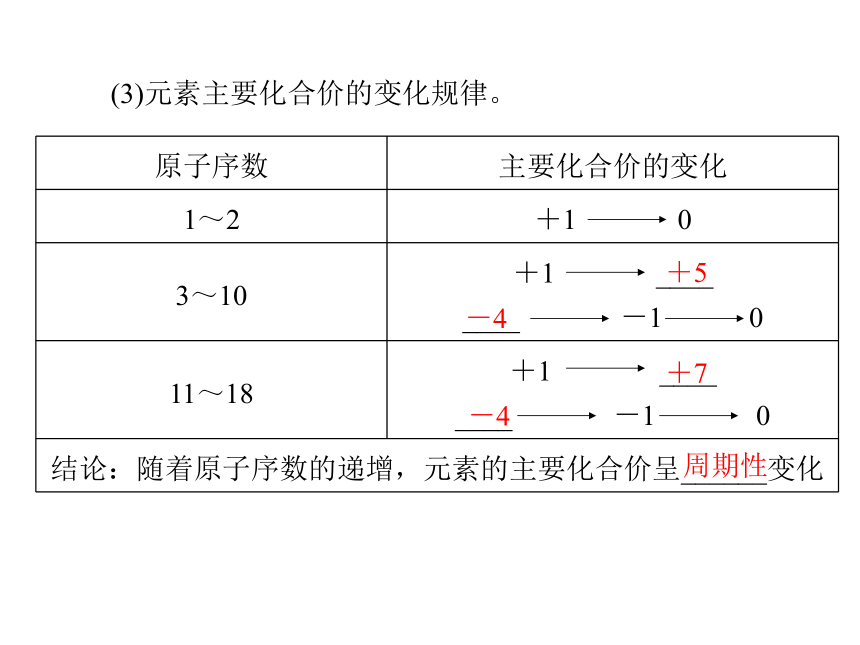
(1)原子结构的变化规律。2288(续上表)(2)原子半径的变化规律。88周期性变小(续上表)变小周期性(3)元素主要化合价的变化规律。+5-4+7-4周期性___H2O__H2O2.探究第三周期元素性质的递变规律
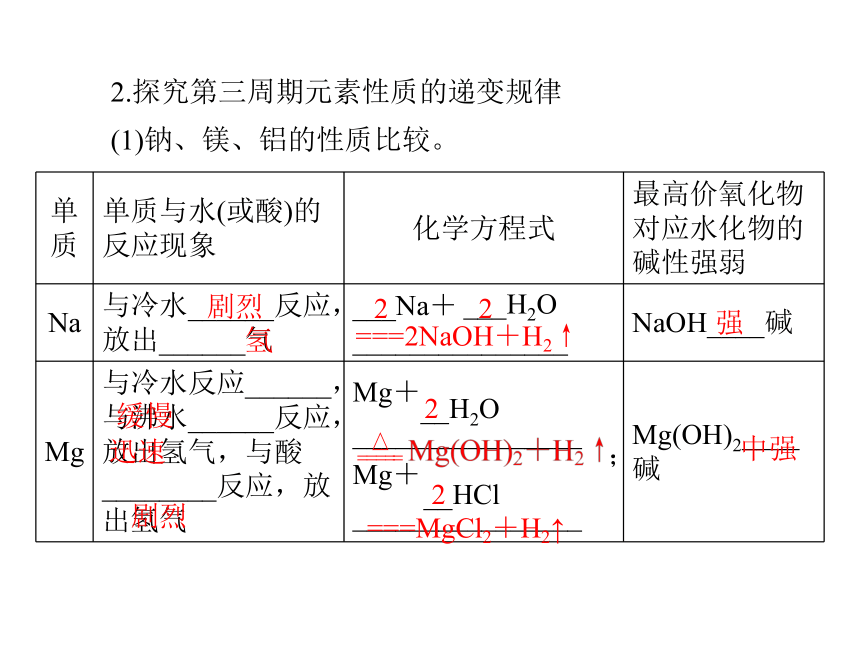
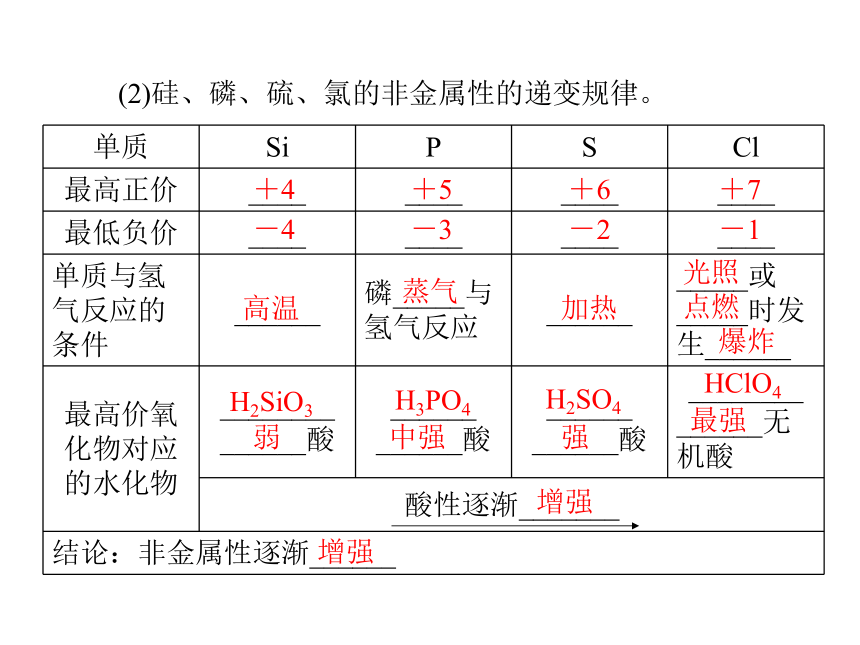
(1)钠、镁、铝的性质比较。剧烈氢22===2NaOH+H2↑强迅速缓慢剧烈2;===MgCl2+H2↑__HCl2中强(续上表)迅速2__HCl6===2AlCl3+3H2↑两性氢氧化物Na>Mg>Al容易强(2)硅、磷、硫、氯的非金属性的递变规律。+4 +5 +6 +7-4 -3 -2 -1高温蒸气加热光照
点燃
爆炸H2SiO3H3PO4弱中强H2SO4强HClO4最强增强增强综上所述,我们可以从11~18号元素性质的变化中得出如下结论:金属性逐渐______,非金属性逐渐______。
3.元素周期律
(1)内容:元素的性质随着原子序数的递增而呈______________的规律。
(2)实质:元素性质的周期性变化是元素____________________________的必然结果。也就是说,由于元素______________________,引起了元素性质上的周期性变化,这体现了结构决定性质的规律。增强减弱周期性变化原子核外电子排布周期性变化
原子结构的周期性变化应用思考:1.随着原子序数的递增,C、N、O、F的最高正化合价也递增吗?
2.请结合原子结构解释同周期元素随着原子序数的递增,元素性质的递变性。提示:不是,因为F无正价,氧无最高正化合价。
提示:因同周期元素原子的电子层数相同,但核电荷数依次增大,对最外层电子吸引能力依次增强,失电子能力依次减弱,得电子能力依次增强,故金属性依次减弱,非金属性依次增强。综合拓展一、周期表中元素性质的变化规律(续上表)特别关注:元素的性质与元素原子的核外电子排布的关系:
元素原子的核外电子排布决定着元素的主要性质。
(1)一般来说,当最外层电子数少于4个时,易失去电子,表现出金属性;当最外层电子数多于4个时,易得到电子,表现出非金属性。
(2)当最外层为8个电子(氦为2个电子)时,原子处于稳定结构,化学性质稳定。二、微粒半径大小的规律
比较微粒半径大小时,首先要确定微粒间的相同点,即微粒间的电子层数、核电荷数、核外电子排布是否相同,然后再利用规律进行比较。(续上表)(续上表)特别关注:粒子半径大小比较是高考的热点,通常题目中进行粒子大小比较时用以上“六同”比较即可,但有时用以上方法不能直接解决时,可借助参照物,例如:比较r(K+)与r(Mg2+)可选r(Na+)为参照物,可知:r(K+)>r(Na+)>r(Mg2+)。尝试应用1.下列关于元素周期律和元素周期表的说法中,正确?的是( )?
A.目前发现的所有元素占据了周期表里的全部位置,不可能再有新的元素被发现?
B.元素的性质随着原子序数的增加而呈周期性变化?
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化B2.(双选题)不能说明钠的金属性比镁强的事实是( )
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠与冷水反应剧烈,镁与冷水不易反应
D.钠的熔点比镁低AD3.下列有关元素性质递变的叙述中,不正确的是( )
A.Na、Mg、Al最外层电子数依次增多
B.P、S、Cl最高正化合价依次升高
C.C、N、O原子半径依次增大
D.N、O、F最外层电子数依次增多C一、元素周期律 下列说法中,正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4弱解析:答案:C变式应用1.(2012年吉林长春检测)下列各组化合物的性质比较中,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S解析:同一主族元素的最高价氧化物对应的水化物的酸性随原子序数的增大而逐渐减弱,酸性:HClO4>HBrO4>HIO4,A项正确。同一周期元素的最高价氧化物对应的水化物的碱性随原子序数的增大而逐渐减弱,碱性:NaOH>Mg(OH)2>Al(OH)3,B项正确。同一周期元素形成的气态氢化物的稳定性随原子序数的增大而逐渐增强,稳定性:HCl>H2S>PH3,C项错误。同一周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱;所以非金属性:F>O>S,D项正确。
答案:C 二、微粒半径大小的比较 下列微粒半径大小比较正确的是( )
A.Na+B.S2->Cl->Na+>Al3+
C.NaD.CsCl->Na+>Al3+,B项正确;Na、Mg、Al、S的原子半径依次减小,C项错误;Na、K、Rb、Cs最外层电子数相同,电子层数依次增多,半径依次增大,D项错误。
答案:B名师点睛:在中学要求的范畴内可以按“三看”规律来比较微粒半径的大小:
(1)一看“电子层数”:在电子层数不同时,电子层越多,半径越大。
(2)二看“核电荷数”:在电子层数相同时,核电荷数越大,半径越小。
(3)三看“电子数”:在电子层和核电荷数相同时,电子数越多,半径越大。变式应用2.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是____________,离子半径由大到小的顺序是____________,原子序数由大到小的顺序是____________。 解析:根据An+、B(n+1)+、Cn-、D(n+1)-四种离子具有相同的电子层结构及离子所带的电荷数可确定出A、B、C、D在周期表中的位置关系:故原子序数由大到小的顺序为B>A>C>D;原子半径A>B>D′>C′,又因原子半径D′>D,C′>C,且D>C,故原子半径A>B>D>C;根据具有相同的电子层结构的微粒,质子数越大,半径越小的规律可知,离子半径D(n+1)->Cn->An+>B(n+1)+。
答案:A>B>D>C D(n+1)->Cn->An+>B(n+1)+
B>A>C>D水平测试1.元素的以下性质,随着原子序数递增不呈现周期性变化的是( )
A.化合价
B.原子半径
C.元素的金属性和非金属性
D.相对原子质量D2.下列各组气态氢化物稳定性按由强到弱的顺序排列的是( )
A.SiH4、PH3、H2S、HCl
B.HF、HCl、HBr、HI
C.PH3、H2S、HCl、HF
D.NH3、PH3、AsH3、HF解析:同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,则气态氢化物稳定性逐渐增强,所以A中气态氢化物稳定性是由弱到强;同主族从上至下,元素的金属性逐渐增强,非金属性逐渐减弱,则气态氢化物稳定性也逐渐减弱,故B正确;同理C、D错误。
答案:B3.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是HZ>H2Y>XH3,下列说法中正确的是( )
A.原子序数:X>Y>Z
B.非金属性:X<Y<Z
C.原子半径:X<Y<Z
D.离子还原性:X3-<Y2-<Z-B4.(双选题)已知X、Y、Z三种元素的原子核外具有相同的电子层数,其最高价氧化物对应的水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( )
A.阴离子的还原性按X、Y、Z的顺序减弱
B.单质的氧化性按X、Y、Z的顺序减弱
C.原子半径按X、Y、Z的顺序减小
D.气态氢化物的稳定性按X、Y、Z的顺序减弱解析:符合条件的有氯、硫、磷,由酸性强弱可知非金属性强弱为Z>Y>X,因为电子层数相同,故原子半径由大到小的顺序为X>Y>Z;单质的氧化性按X、Y、Z顺序增强;阴离子还原性按X、Y、Z顺序减弱;气态氢化物的稳定性按X、Y、Z顺序增强。
答案:AC5.下列叙述错误的是 ( )
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4A6.用1~18号元素及其形成化合物的化学式填空。
(1)原子半径最小的元素是 ____________。
(2)除稀有气体外,原子半径最大的元素是___________________________________________________,
它的原子结构示意图是____________。
(3)与水反应最剧烈的金属是____________。
(4)最高价氧化物对应水化物碱性最强的是___________________________________________________。(5)最高价氧化物对应水化物为两性氢氧化物的是__________________________________________________。
(6)气态氢化物的水溶液呈碱性的元素是__________________________________________________。
(7)最稳定的气态氢化物是 __________________________________________________。
(8)金属性最强的元素是____________,非金属性最强的元素是____________。
(9)酸性最强的最高价氧化物对应的水化物是__________________________________________________。解析:本题是全方位考查对前18号元素的性质及原子结构的掌握程度,并熟练运用元素周期律对相关内容进行推断。答案:(1)H (2)Na (3)Na
(4)NaOH (5)Al(OH)3 (6)N (7)HF
(8)Na F (9)HClO4能力提升7.短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
A.Z一定是活泼的金属
B.Y的最高化合价为+7价
C.Z的最高价氧化物的水化物是强酸
D.1 mol Y单质与足量水反应时,有4 mol 电子发生转移解析:根据三种短周期元素的位置可推断出,X为氦、Y为氟、Z为硫。
答案:C8.(2011年湖南娄底联考)已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B、E同主族。下列推断正确的是( )
A.A、B、E一定不在同一周期
B.D为第二周期元素
C.A、D不可能在同一主族
D.B、D可能在同一周期解析:B、E同主族,B、E分别在第二、三周期,据原子半径D>E知,D、E在第三周期,D在E的左侧;根据A、B、C、D、E核电荷数依次增大和半径关系知,C与B同周期且在B的右侧;由r(B)>r(C)>r(A)可推知A是氢元素,A、D可能在同一主族。
答案:A 9.下表是元素周期表的一部分,回答下列有关问题:(1)写出下列元素符号:①____________,⑥__________________________________________________,
⑦____________,?____________。(2)在这些元素中,最活泼的金属元素是____________(填元素符号,下同),最活泼的非金属元素是__________________________________________________,
最不活泼的元素是____________。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是____________,碱性最强的是____________,呈两性的氢氧化物是____________,写出三者之间相互反应的化学方程式__________________________________________________。(4)在这些元素中(稀有气体除外),原子半径最小的是____________,原子半径最大的是____________。
(5)在③与④中,化学性质较活泼的是____________,怎样用化学实验证明?__________________________________________________。
在⑧与?中,化学性质较活泼的是____________,怎样用化学实验证明?__________________________________________________。解析:解答本题关键要掌握:①1~20号元素的名称及符号;②元素周期表的结构;③能根据元素周期表中元素性质递变规律进行分析、判断。
答案:(1)N Si S Ca (2)K F Ar
(3)HClO4 KOH Al(OH)3 3HClO4+Al(OH)3===Al(ClO4)3+3H2O,HClO4+KOH===KClO4+H2O,KOH+Al(OH)3===KAlO2+2H2O
(4)F K(5)Na 可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱Mg(OH)2 Cl 可用氯气通入溴化钠溶液中的实验证明:溶液呈棕红色,发生的反应为Cl2+2NaBr===2NaCl+Br210.A、B、C三种元素处于同一周期,B的质子数比A多2,C原子的电子总数比B原子的多4,已知1 mol B的单质与足量的盐酸反应失去电子数为1.806×1024个,且B离子与氖具有相同的电子层结构。
(1)写出元素符号:A______,B______,C______。
(2)写出离子方程式:A的最高价氧化物与C的气态氢化物的水溶液反应:________________________;B的最高价氧化物与A的最高价氧化物的水化物反应:__________________________________________________。 (3)A离子的氧化性比B离子的氧化性________,原因是________________________________________________________________________。解析:由1 mol B与足量的盐酸反应失去1.806×1024个电子,可推知其化合价为+3价,且离子与Ne具有相同的电子层结构,可推知为Al。
答案:(1)Na Al Cl
(2)Na2O+2H+===2Na++H2O
Al2O3+2OH-===2AlO+H2O
(3)弱 Al3+得电子能力比Na+强感谢您的使用,退出请按ESC键本小节结束
第2课时 元素周期律物质结构 元素周期律第2课时 元素周期律 1865年,英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一种元素算起,每到第八种元素就和第一种元素的性质相近,很像音乐上的八度音循环,他干脆把元素的这种周期性叫做了标示元素关系的“八音律”表。但是,条件限制了他作进一步的探索,因为当时相对原子质量的测定值有错误,而且他“八音律”,并画出也没有考虑到还有尚未发现的元素,只是机械地按相对原子质量大小将元素排列起来,所以他没能揭示出元素之间的内在规律。纽兰兹已经下意识地摸到了“真理女神”的裙角,差点就揭示元素周期律了,一个伟大的发现与他擦肩而过!
那么,在现行元素周期表中一百多种元素之间的内在规律是什么呢?1.了解元素原子结构的周期性变化。
2.了解元素性质的周期性变化。
3.理解元素周期律的内容及实质。
4.形成结构决定性质的科学思想。元素周期律1.元素的原子核外电子排布、原子半径、元素化合价的变化规律
(1)原子结构的变化规律。2288(续上表)(2)原子半径的变化规律。88周期性变小(续上表)变小周期性(3)元素主要化合价的变化规律。+5-4+7-4周期性___H2O__H2O2.探究第三周期元素性质的递变规律
(1)钠、镁、铝的性质比较。剧烈氢22===2NaOH+H2↑强迅速缓慢剧烈2;===MgCl2+H2↑__HCl2中强(续上表)迅速2__HCl6===2AlCl3+3H2↑两性氢氧化物Na>Mg>Al容易强(2)硅、磷、硫、氯的非金属性的递变规律。+4 +5 +6 +7-4 -3 -2 -1高温蒸气加热光照
点燃
爆炸H2SiO3H3PO4弱中强H2SO4强HClO4最强增强增强综上所述,我们可以从11~18号元素性质的变化中得出如下结论:金属性逐渐______,非金属性逐渐______。
3.元素周期律
(1)内容:元素的性质随着原子序数的递增而呈______________的规律。
(2)实质:元素性质的周期性变化是元素____________________________的必然结果。也就是说,由于元素______________________,引起了元素性质上的周期性变化,这体现了结构决定性质的规律。增强减弱周期性变化原子核外电子排布周期性变化
原子结构的周期性变化应用思考:1.随着原子序数的递增,C、N、O、F的最高正化合价也递增吗?
2.请结合原子结构解释同周期元素随着原子序数的递增,元素性质的递变性。提示:不是,因为F无正价,氧无最高正化合价。
提示:因同周期元素原子的电子层数相同,但核电荷数依次增大,对最外层电子吸引能力依次增强,失电子能力依次减弱,得电子能力依次增强,故金属性依次减弱,非金属性依次增强。综合拓展一、周期表中元素性质的变化规律(续上表)特别关注:元素的性质与元素原子的核外电子排布的关系:
元素原子的核外电子排布决定着元素的主要性质。
(1)一般来说,当最外层电子数少于4个时,易失去电子,表现出金属性;当最外层电子数多于4个时,易得到电子,表现出非金属性。
(2)当最外层为8个电子(氦为2个电子)时,原子处于稳定结构,化学性质稳定。二、微粒半径大小的规律
比较微粒半径大小时,首先要确定微粒间的相同点,即微粒间的电子层数、核电荷数、核外电子排布是否相同,然后再利用规律进行比较。(续上表)(续上表)特别关注:粒子半径大小比较是高考的热点,通常题目中进行粒子大小比较时用以上“六同”比较即可,但有时用以上方法不能直接解决时,可借助参照物,例如:比较r(K+)与r(Mg2+)可选r(Na+)为参照物,可知:r(K+)>r(Na+)>r(Mg2+)。尝试应用1.下列关于元素周期律和元素周期表的说法中,正确?的是( )?
A.目前发现的所有元素占据了周期表里的全部位置,不可能再有新的元素被发现?
B.元素的性质随着原子序数的增加而呈周期性变化?
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化B2.(双选题)不能说明钠的金属性比镁强的事实是( )
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠与冷水反应剧烈,镁与冷水不易反应
D.钠的熔点比镁低AD3.下列有关元素性质递变的叙述中,不正确的是( )
A.Na、Mg、Al最外层电子数依次增多
B.P、S、Cl最高正化合价依次升高
C.C、N、O原子半径依次增大
D.N、O、F最外层电子数依次增多C一、元素周期律 下列说法中,正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4弱解析:答案:C变式应用1.(2012年吉林长春检测)下列各组化合物的性质比较中,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S解析:同一主族元素的最高价氧化物对应的水化物的酸性随原子序数的增大而逐渐减弱,酸性:HClO4>HBrO4>HIO4,A项正确。同一周期元素的最高价氧化物对应的水化物的碱性随原子序数的增大而逐渐减弱,碱性:NaOH>Mg(OH)2>Al(OH)3,B项正确。同一周期元素形成的气态氢化物的稳定性随原子序数的增大而逐渐增强,稳定性:HCl>H2S>PH3,C项错误。同一周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族从上到下,元素的金属性逐渐增强,非金属性逐渐减弱;所以非金属性:F>O>S,D项正确。
答案:C 二、微粒半径大小的比较 下列微粒半径大小比较正确的是( )
A.Na+
C.Na
答案:B名师点睛:在中学要求的范畴内可以按“三看”规律来比较微粒半径的大小:
(1)一看“电子层数”:在电子层数不同时,电子层越多,半径越大。
(2)二看“核电荷数”:在电子层数相同时,核电荷数越大,半径越小。
(3)三看“电子数”:在电子层和核电荷数相同时,电子数越多,半径越大。变式应用2.已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是____________,离子半径由大到小的顺序是____________,原子序数由大到小的顺序是____________。 解析:根据An+、B(n+1)+、Cn-、D(n+1)-四种离子具有相同的电子层结构及离子所带的电荷数可确定出A、B、C、D在周期表中的位置关系:故原子序数由大到小的顺序为B>A>C>D;原子半径A>B>D′>C′,又因原子半径D′>D,C′>C,且D>C,故原子半径A>B>D>C;根据具有相同的电子层结构的微粒,质子数越大,半径越小的规律可知,离子半径D(n+1)->Cn->An+>B(n+1)+。
答案:A>B>D>C D(n+1)->Cn->An+>B(n+1)+
B>A>C>D水平测试1.元素的以下性质,随着原子序数递增不呈现周期性变化的是( )
A.化合价
B.原子半径
C.元素的金属性和非金属性
D.相对原子质量D2.下列各组气态氢化物稳定性按由强到弱的顺序排列的是( )
A.SiH4、PH3、H2S、HCl
B.HF、HCl、HBr、HI
C.PH3、H2S、HCl、HF
D.NH3、PH3、AsH3、HF解析:同周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强,则气态氢化物稳定性逐渐增强,所以A中气态氢化物稳定性是由弱到强;同主族从上至下,元素的金属性逐渐增强,非金属性逐渐减弱,则气态氢化物稳定性也逐渐减弱,故B正确;同理C、D错误。
答案:B3.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是HZ>H2Y>XH3,下列说法中正确的是( )
A.原子序数:X>Y>Z
B.非金属性:X<Y<Z
C.原子半径:X<Y<Z
D.离子还原性:X3-<Y2-<Z-B4.(双选题)已知X、Y、Z三种元素的原子核外具有相同的电子层数,其最高价氧化物对应的水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( )
A.阴离子的还原性按X、Y、Z的顺序减弱
B.单质的氧化性按X、Y、Z的顺序减弱
C.原子半径按X、Y、Z的顺序减小
D.气态氢化物的稳定性按X、Y、Z的顺序减弱解析:符合条件的有氯、硫、磷,由酸性强弱可知非金属性强弱为Z>Y>X,因为电子层数相同,故原子半径由大到小的顺序为X>Y>Z;单质的氧化性按X、Y、Z顺序增强;阴离子还原性按X、Y、Z顺序减弱;气态氢化物的稳定性按X、Y、Z顺序增强。
答案:AC5.下列叙述错误的是 ( )
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4A6.用1~18号元素及其形成化合物的化学式填空。
(1)原子半径最小的元素是 ____________。
(2)除稀有气体外,原子半径最大的元素是___________________________________________________,
它的原子结构示意图是____________。
(3)与水反应最剧烈的金属是____________。
(4)最高价氧化物对应水化物碱性最强的是___________________________________________________。(5)最高价氧化物对应水化物为两性氢氧化物的是__________________________________________________。
(6)气态氢化物的水溶液呈碱性的元素是__________________________________________________。
(7)最稳定的气态氢化物是 __________________________________________________。
(8)金属性最强的元素是____________,非金属性最强的元素是____________。
(9)酸性最强的最高价氧化物对应的水化物是__________________________________________________。解析:本题是全方位考查对前18号元素的性质及原子结构的掌握程度,并熟练运用元素周期律对相关内容进行推断。答案:(1)H (2)Na (3)Na
(4)NaOH (5)Al(OH)3 (6)N (7)HF
(8)Na F (9)HClO4能力提升7.短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
A.Z一定是活泼的金属
B.Y的最高化合价为+7价
C.Z的最高价氧化物的水化物是强酸
D.1 mol Y单质与足量水反应时,有4 mol 电子发生转移解析:根据三种短周期元素的位置可推断出,X为氦、Y为氟、Z为硫。
答案:C8.(2011年湖南娄底联考)已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B、E同主族。下列推断正确的是( )
A.A、B、E一定不在同一周期
B.D为第二周期元素
C.A、D不可能在同一主族
D.B、D可能在同一周期解析:B、E同主族,B、E分别在第二、三周期,据原子半径D>E知,D、E在第三周期,D在E的左侧;根据A、B、C、D、E核电荷数依次增大和半径关系知,C与B同周期且在B的右侧;由r(B)>r(C)>r(A)可推知A是氢元素,A、D可能在同一主族。
答案:A 9.下表是元素周期表的一部分,回答下列有关问题:(1)写出下列元素符号:①____________,⑥__________________________________________________,
⑦____________,?____________。(2)在这些元素中,最活泼的金属元素是____________(填元素符号,下同),最活泼的非金属元素是__________________________________________________,
最不活泼的元素是____________。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是____________,碱性最强的是____________,呈两性的氢氧化物是____________,写出三者之间相互反应的化学方程式__________________________________________________。(4)在这些元素中(稀有气体除外),原子半径最小的是____________,原子半径最大的是____________。
(5)在③与④中,化学性质较活泼的是____________,怎样用化学实验证明?__________________________________________________。
在⑧与?中,化学性质较活泼的是____________,怎样用化学实验证明?__________________________________________________。解析:解答本题关键要掌握:①1~20号元素的名称及符号;②元素周期表的结构;③能根据元素周期表中元素性质递变规律进行分析、判断。
答案:(1)N Si S Ca (2)K F Ar
(3)HClO4 KOH Al(OH)3 3HClO4+Al(OH)3===Al(ClO4)3+3H2O,HClO4+KOH===KClO4+H2O,KOH+Al(OH)3===KAlO2+2H2O
(4)F K(5)Na 可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱;Mg跟沸水才反应,放出氢气,并生成中强碱Mg(OH)2 Cl 可用氯气通入溴化钠溶液中的实验证明:溶液呈棕红色,发生的反应为Cl2+2NaBr===2NaCl+Br210.A、B、C三种元素处于同一周期,B的质子数比A多2,C原子的电子总数比B原子的多4,已知1 mol B的单质与足量的盐酸反应失去电子数为1.806×1024个,且B离子与氖具有相同的电子层结构。
(1)写出元素符号:A______,B______,C______。
(2)写出离子方程式:A的最高价氧化物与C的气态氢化物的水溶液反应:________________________;B的最高价氧化物与A的最高价氧化物的水化物反应:__________________________________________________。 (3)A离子的氧化性比B离子的氧化性________,原因是________________________________________________________________________。解析:由1 mol B与足量的盐酸反应失去1.806×1024个电子,可推知其化合价为+3价,且离子与Ne具有相同的电子层结构,可推知为Al。
答案:(1)Na Al Cl
(2)Na2O+2H+===2Na++H2O
Al2O3+2OH-===2AlO+H2O
(3)弱 Al3+得电子能力比Na+强感谢您的使用,退出请按ESC键本小节结束
