【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第二节 第3课时 元素周期表和元素周期律的应用(60张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第二节 第3课时 元素周期表和元素周期律的应用(60张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 710.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:04:49 | ||
图片预览











文档简介
课件60张PPT。第二节 元素周期律
第3课时 元素周期表和元素周期律的应用物质结构 元素周期律第3课时 元素周期表和元素周期律的应用国际化学和物理学权威机构2011年6月8日宣布,门捷列夫化学元素周期表新添两种元素,位次分别为114和116。这两种元素尽管“生命”周期在现实世界中只能以秒计,科学地位却得以永恒。
与座次靠前的碳、金、锡等元素不同,元素114和元素116在现实世界中瞬间即逝。元素114的衰变期为几秒钟,元素116的衰变期更短,只有几分之一秒。两种新元素均非自然存在,由实验室“合成”。美国和俄罗斯科学家团队在实验室借助钙离子高速撞击钚原子或锔原子得到元素114和元素116,年代分别为2004年和2006年。
美国利弗莫尔劳伦斯国家实验所化学家肯·穆迪是发现两种新元素的团队成员之一。
穆迪接受美联社记者专访时笑谈,他上中学时,元素周期表包含104种元素。当时,一些化学家断言,元素周期表已经完成编制,不会再添加新元素。“发现新元素,永远只是基础科学的一部分,还带点儿趣味”他说。他说,如今,当他面对一群中学生时,他会告诉对方:“事实是,周期表可以变化,可以扩充。”1.了解元素周期表的简单分区。
2.认识周期表是元素周期律的具体表现形式。
3.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。元素周期表和元素周期律的应用1.元素周期表与元素周期律的关系
(1)元素周期表是元素周期律的__________形式。
(2)可以根据元素在周期表中的位置推测其原子____和____,也可以根据原子结构推测元素在周期表中的______。具体体现结构性质位置2.元素周期表中金属与非金属的分区
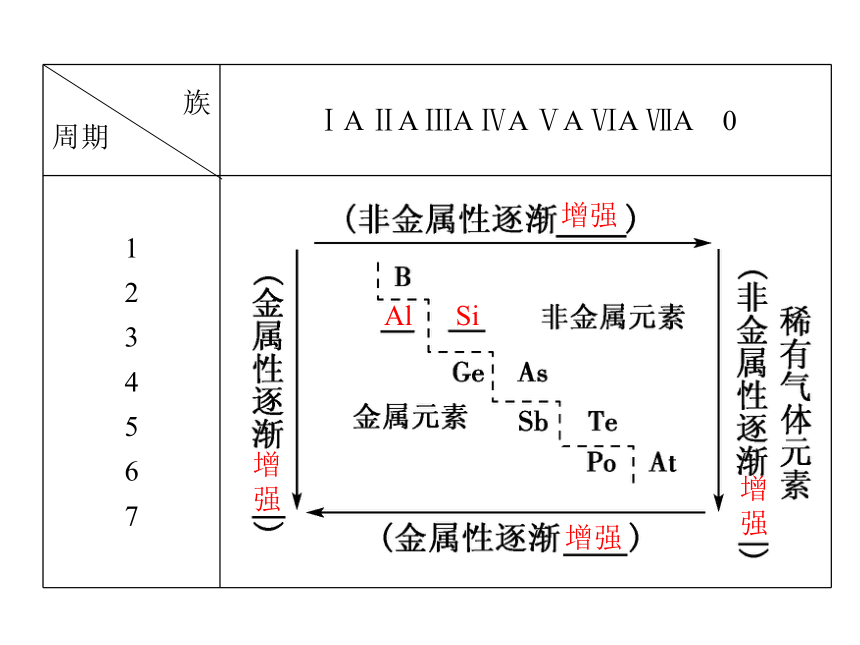
金属元素和非金属元素在周期表中有相对明确的分区现象。在元素周期表中从第ⅢA族的______元素(B)开始,到第ⅦA族的砹元素(____)画一条折线(如下图所示),折线左侧是________元素,右侧是______元素。硼At金属 非金属增强增
强增
强增强Al Si3.元素的化合价与元素在周期表中位置之间的关系
(1)主族元素。
最高正化合价=______=______________(价电子数)。
(2)非金属元素。
①最高正价=原子所能失去或偏移的_____________。
②最低负价=使它达到______稳定结构所需得到的电子数。
③最高正价+|最低负价|=______。族序数 最外层电子数最外层电子数电子84.元素周期表和元素周期律的应用
(1)根据元素在周期表中的位置推测其__________和______。
(2)根据元素的______推测它在周期表中的位置。
(3)指导新元素的发现及预测它们的________________。原子结构性质性质原子结构和性质(4)指导其他与化学相关的科学技术。
①在周期表中__________________,可以找到半导体材料。
②在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
③在元素周期表的__________,寻找制取农药的元素。右上角金属与非金属分界处过渡元素应用思考:金属只有还原性,非金属只有氧化性对吗?提示:金属没有负化合价,在反应中化合价只能升高,所以只有还原性,但非金属化合价可以升高,也可以降低,因此既有氧化性,又有还原性。综合拓展一、元素“位”、“构”、“性”之间的关系特别关注:应用结构、性质、位置的关系,可以由结构推断性质,由性质逆推结构,由结构推出其在元素周期表中的位置,真正理解结构决定性质的规律。需要注意的是很多规律方法只适用于主族元素,不适用副族元素,解题时注意不要随意将其适用范围扩大化。二、原子结构与元素在周期表中的位置关系
1.核外电子层数=周期数。
2.主族元素的最外层电子数=价电子数=主族序数=最高正化合价。
3.质子数=原子序数=原子核外电子数=核电荷数。
4.最低负化合价绝对值=8-主族序数(ⅣA~ⅦA)。5.原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物对应水化物的碱性越强,其离子的氧化性越弱。
6.原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成的最高价氧化物对应水化物的酸性越强,其离子的还原性越弱。 三、元素周期表中的“三角规律”和“对角线规律”A、B、C、D四种元素在周期表中的相对位置如右图,则有:对角线规律:A、D性质相似。在周期表中,Li—Mg,Be—Al,B—Si处于对角线位置,性质相似。如Be、Al是两性元素,Al2O3、BeO是两性氧化物,Be(OH)2、Al(OH)3都能与强碱(NaOH、KOH等)反应。尝试应用1.(2011年南京检测)19世纪中叶,门捷列夫总结出了如下表所示的元素化学性质的变化规律。请回答:(1)门捷列夫的突出贡献是( )
A.提出了原子学说 B.提出分子学说
C.发现元素周期律 D.发现能量守恒定律C(2)该表变化表明( )
A.物质的性质总是在不断变化的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变D(3)(双选题)据报道,美国科学家制得一种新原子 X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
A.这种原子的中子数为167
B.它位于元素周期表中第六周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合AC2.(双选题)核电荷数为1~18的元素中,下列说法正确的是( )?
A.最外层只有1个电子的元素一定是金属元素?
B.最外层有2个电子的元素不一定是金属元素?
C.原子核外各层电子数相等的元素一定是金属元素?
D.最外层电子数为7的原子,最高正价为+7价BC3.关于元素周期表和元素周期律的应用有如下叙述:①元素周期表是学习化学知识的一种重要工具;②利用元素周期表可以预测新元素的原子结构和性质;③利用元素周期表可以指导寻找某些特殊的材料。其中正确的是( )?
A.①②③ B.只有②③?
C.只有①③ D.只有①?A一、元素周期表中“位”、“构”、“性”之间的关系 有X、Y两种元素,原子序数小于等于20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法中正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m解析:答案:A名师点睛:应用“位置、结构、性质”三者的关系解答问题时要注意掌握以下几个方面:
(1)掌握四个关系式:电子层数=周期序数;最外层电子数=主族序数;主族元素的最高正化合价=族序数;主族元素的最低负化合价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律:各周期元素的种类数(分别为2、8、8、18、18、32、26);稀有气体元素的原子序数(分别为2、10、18、36、54、86)和所在周期(分别在一到六周期);同族上下相邻元素原子序数的关系(相差2、8、18、32等情况);同周期第ⅡA族与第ⅢA族元素原子序数的差值(有1、11、25等情况)。变式应用1.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同解析:第三周期的Al元素,既有金属性,又有非金属性,故A错误;H+最外层无电子,Li+最外层2个电子,因此并非所有的短周期元素原子形成离子后,最外层都达到8电子稳定结构,故C错;同主族元素的原子,化学性质有相似性,但并不完全相同。
答案:B 二、元素推断 A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号。
A________,C________,D________。(2)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式________________________________________________________________________;
A、E两元素最高价氧化物对应的水化物相互反应的化学方程式________________________________________________________________________。
(3)比较C、D最高价氧化物对应水化物的酸性________________________。解析:A、B、E三种元素最高价氧化物对应的水化物为酸或碱,两两皆能反应,因此必有一种是两性物质Al(OH)3,另外两种为强酸、强碱,由于五种元素均为短周期元素,故强碱是NaOH。又A、B、E三原子最外层电子数之和为11,且原子序数依次增大,可推出E原子最外层有7个电子,短周期元素中只有Cl符合要求,两两反应的三种物质是NaOH、Al(OH)3、HClO4。C、D原子序数小于17,大于13,由题意推出C、D分别为Si和P,非金属性Si<P,因此酸性H2SiO3<H3PO4。答案:(1)Na Si P
(2)Al(OH)3+NaOH===NaAlO2+2H2O
NaOH+HClO4===NaClO4+H2O
(3)H3PO4>H2SiO3变式应用2.六种短周期元素A、B、C、D、E、F,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小,B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D的单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E的单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答下列问题:(1)元素名称。
A________,B________,C________,D________。
(2)E在元素周期表中的位置:___________________________________________________。
(3)F的离子结构示意图:
________________________________________。氢 碳 氧 钠第三周期、第ⅥA族(4)C、D按原子个数比1:1组成的一种化合物与水发生反应的化学方程式为___________________________________________________。
(5)能说明E的非金属性比F的非金属性________(填“强”或“弱”)的事实是______________________________________________ (举一例)。2Na2O2+2H2O===4NaOH+O2↑氯气能从硫化钠溶液中置换出硫(合理答案均可)弱水平测试1.对于相同周期主族元素来说,下列叙述正确的是( )
①最高正化合价都是依次升高(由+1→+7)
②原子半径依次减小
③元素的还原性依次减弱,氧化性依次增强
A.①② B.②③ C.①③ D.①②③解析:氟非金属性最强,没有正化合价。
答案:B2.(2011年广州检测)某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素
B.R一定是第ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2RD3.某短周期元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
A.在周期表中处于第三周期ⅦA族
B.处于第二周期ⅤA族
C.氢化物没有PH3、H2S稳定
D.常见的价态只有-3、+2、+3、+5价解析:气态氢化物与该元素最高价氧化物的水化物反应生成盐的元素X为N元素,位于元素周期表中的第二周期第ⅤA族,所以A错,B正确;选项C,NH3、PH3、H2S的稳定性比较为NH3>PH3,PH3<H2S,所以C错;选项D,N元素常见的价态有-3,0,+1,+2,+3,+4,+5价,所以D错。
答案:B4.下列结论正确的是( )
①电子层数:S2->Cl->Br->F-
②氢化物稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>S>Se
A.只有② B.①③⑤ C.②④⑥ D.只有⑥C5.下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小解析:同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,而不同周期两族元素金属性的比较要结合同族元素的递变规律进行,如果忽略了是否是同周期元素,易错选A。错选C是忽略了“最高价氧化物”与“氧化物”的区别,而错用递变规律造成的。错选D是把原子半径的递变规律误认为是离子半径的递变规律。
答案:B 6.下表是周期表中的一部分,根据A~N在周期表中的位置,按要求回答下列问题:(1)表中元素,只有负价而无正价的元素是________,氧化性最强的单质是________,还原性最强的单质是________ (用相关的元素符号或分子式表示) 。FF2 Na(2)最高价的氧化物的水化物碱性最强的是________,酸性最强的是________,呈两性的是________。(本小题均填物质的名称)
(3)A、B、C、D、F、H、I形成的单质中,熔点最高的物质的化学式为________。
(4)在B、C、D、F、G、H中,原子半径从大到小的顺序为______________________(用元素符号表示)。氢氧化钠高氯酸 氢氧化铝CNa>Mg>Al>C>N>F能力提升7.下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高正化合价为+3 ②第ⅦA族元素是同周期中非金属性最强的元素 ③第二周期第ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期第ⅡA族
A.①② B.①③ C.②④ D.③④解析:①原子序数为15的元素是磷,其最高正化合价为+5价,错误;②在周期表中,同一周期从左至右元素非金属性逐渐增强,卤素是同周期中非金属性最强的元素,碱金属元素是同周期中金属性最强的元素,正确;③第二周期ⅣA族元素是碳,碳原子有多种同位素:12C、13C、14C,只有12C中质子数和中子数相等,且都等于6,错误;④原子序数为12的元素是镁,它位于第三周期第ⅡA族,正确。
答案:C8.已知:A、B两元素的阴离子具有相同的电子层结构;A元素的阴离子半径大于B元素的阴离子半径;C和B两元素的原子核外电子层数相同;C元素原子的原子半径大于A元素原子的原子半径。A、B、C三种元素的原子序数的关系是( )
A.A>B>C B.B>A>C
C.C>A>B D.A>C>B解析:A、B两元素的阴离子具有相同的电子层结构,因此是同周期元素,半径大则核电荷数少,则有原子序数A<B。B、C原子电子层相同,因此,A、B、C同周期,原子半径大则原子序数小,则原子序数C<A。
答案:B 9.(2011年烟台检测)现有部分短周期元素的性质或原子结构如下表:(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____________。(2)元素Y与氢元素形成一种离子YH ,写出某溶液中含该微粒的检验方法________________________________________________________________________。
(3)元素Z在周期表中的位置是____________,元素Z与元素T相比,非金属性较强的是____________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应 10.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):(续上表)请帮助该同学整理并完成实验报告
(1)实验目的:__________________________________。(2)实验用品:_________________________________。(3)实验内容。(4)实验结论:__________________________________________________。解析:根据所给出的实验内容不难看出,该学生是想以第三周期为例,设计实验验证同一周期主族元素性质的递变规律。分析过程如下,先分析每个实验可得出的结论:①、③做的是镁、钠分别和水反应的实验,比较两者和水反应的难易程度及两者最高价氧化物对应水化物碱性的强弱;②Cl2能从H2S中置换出硫;④、⑤可分别得出镁、铝和盐酸置换反应的难易;⑥氢氧化铝是一种两性氢氧化物。把上述分析结果连成一个整体来看,可发现这6个实验都是研究第三周期的单质和化合物的性质,从中可比较出钠、镁、铝三种元素金属性强弱和氯、硫两种元素的非金属性强弱,所以这一套实验的目的是“验证第三周期元素从左到右金属性递减、非金属性递增的规律”。
(2)回忆每个实验过程可知,这些实验要用到的仪器有:试管、酒精灯、砂纸、镊子、小刀、胶头滴管等。
(3)根据元素周期表第三周期的排列顺序,可确定实验操作顺序和相关实验现象。
(4)该小题具有一定的开放性,如金属性Na>Mg>Al;非金属性:S<Cl都对,但答题时最好与该实验的目的相对应:同一周期,从左往右金属性逐渐减弱,非金属性逐渐增强。
答案:(1)验证第三周期元素从左至右金属性递减、非金属性递增的规律
(2)试管、酒精灯、砂纸、镊子、小刀、胶头滴管等 (3)(4)同一周期,从左至右金属性逐渐减弱,非金属性逐渐增强感谢您的使用,退出请按ESC键本小节结束
第3课时 元素周期表和元素周期律的应用物质结构 元素周期律第3课时 元素周期表和元素周期律的应用国际化学和物理学权威机构2011年6月8日宣布,门捷列夫化学元素周期表新添两种元素,位次分别为114和116。这两种元素尽管“生命”周期在现实世界中只能以秒计,科学地位却得以永恒。
与座次靠前的碳、金、锡等元素不同,元素114和元素116在现实世界中瞬间即逝。元素114的衰变期为几秒钟,元素116的衰变期更短,只有几分之一秒。两种新元素均非自然存在,由实验室“合成”。美国和俄罗斯科学家团队在实验室借助钙离子高速撞击钚原子或锔原子得到元素114和元素116,年代分别为2004年和2006年。
美国利弗莫尔劳伦斯国家实验所化学家肯·穆迪是发现两种新元素的团队成员之一。
穆迪接受美联社记者专访时笑谈,他上中学时,元素周期表包含104种元素。当时,一些化学家断言,元素周期表已经完成编制,不会再添加新元素。“发现新元素,永远只是基础科学的一部分,还带点儿趣味”他说。他说,如今,当他面对一群中学生时,他会告诉对方:“事实是,周期表可以变化,可以扩充。”1.了解元素周期表的简单分区。
2.认识周期表是元素周期律的具体表现形式。
3.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。元素周期表和元素周期律的应用1.元素周期表与元素周期律的关系
(1)元素周期表是元素周期律的__________形式。
(2)可以根据元素在周期表中的位置推测其原子____和____,也可以根据原子结构推测元素在周期表中的______。具体体现结构性质位置2.元素周期表中金属与非金属的分区
金属元素和非金属元素在周期表中有相对明确的分区现象。在元素周期表中从第ⅢA族的______元素(B)开始,到第ⅦA族的砹元素(____)画一条折线(如下图所示),折线左侧是________元素,右侧是______元素。硼At金属 非金属增强增
强增
强增强Al Si3.元素的化合价与元素在周期表中位置之间的关系
(1)主族元素。
最高正化合价=______=______________(价电子数)。
(2)非金属元素。
①最高正价=原子所能失去或偏移的_____________。
②最低负价=使它达到______稳定结构所需得到的电子数。
③最高正价+|最低负价|=______。族序数 最外层电子数最外层电子数电子84.元素周期表和元素周期律的应用
(1)根据元素在周期表中的位置推测其__________和______。
(2)根据元素的______推测它在周期表中的位置。
(3)指导新元素的发现及预测它们的________________。原子结构性质性质原子结构和性质(4)指导其他与化学相关的科学技术。
①在周期表中__________________,可以找到半导体材料。
②在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
③在元素周期表的__________,寻找制取农药的元素。右上角金属与非金属分界处过渡元素应用思考:金属只有还原性,非金属只有氧化性对吗?提示:金属没有负化合价,在反应中化合价只能升高,所以只有还原性,但非金属化合价可以升高,也可以降低,因此既有氧化性,又有还原性。综合拓展一、元素“位”、“构”、“性”之间的关系特别关注:应用结构、性质、位置的关系,可以由结构推断性质,由性质逆推结构,由结构推出其在元素周期表中的位置,真正理解结构决定性质的规律。需要注意的是很多规律方法只适用于主族元素,不适用副族元素,解题时注意不要随意将其适用范围扩大化。二、原子结构与元素在周期表中的位置关系
1.核外电子层数=周期数。
2.主族元素的最外层电子数=价电子数=主族序数=最高正化合价。
3.质子数=原子序数=原子核外电子数=核电荷数。
4.最低负化合价绝对值=8-主族序数(ⅣA~ⅦA)。5.原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物对应水化物的碱性越强,其离子的氧化性越弱。
6.原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成的最高价氧化物对应水化物的酸性越强,其离子的还原性越弱。 三、元素周期表中的“三角规律”和“对角线规律”A、B、C、D四种元素在周期表中的相对位置如右图,则有:对角线规律:A、D性质相似。在周期表中,Li—Mg,Be—Al,B—Si处于对角线位置,性质相似。如Be、Al是两性元素,Al2O3、BeO是两性氧化物,Be(OH)2、Al(OH)3都能与强碱(NaOH、KOH等)反应。尝试应用1.(2011年南京检测)19世纪中叶,门捷列夫总结出了如下表所示的元素化学性质的变化规律。请回答:(1)门捷列夫的突出贡献是( )
A.提出了原子学说 B.提出分子学说
C.发现元素周期律 D.发现能量守恒定律C(2)该表变化表明( )
A.物质的性质总是在不断变化的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变D(3)(双选题)据报道,美国科学家制得一种新原子 X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是( )
A.这种原子的中子数为167
B.它位于元素周期表中第六周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合AC2.(双选题)核电荷数为1~18的元素中,下列说法正确的是( )?
A.最外层只有1个电子的元素一定是金属元素?
B.最外层有2个电子的元素不一定是金属元素?
C.原子核外各层电子数相等的元素一定是金属元素?
D.最外层电子数为7的原子,最高正价为+7价BC3.关于元素周期表和元素周期律的应用有如下叙述:①元素周期表是学习化学知识的一种重要工具;②利用元素周期表可以预测新元素的原子结构和性质;③利用元素周期表可以指导寻找某些特殊的材料。其中正确的是( )?
A.①②③ B.只有②③?
C.只有①③ D.只有①?A一、元素周期表中“位”、“构”、“性”之间的关系 有X、Y两种元素,原子序数小于等于20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法中正确的是( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m解析:答案:A名师点睛:应用“位置、结构、性质”三者的关系解答问题时要注意掌握以下几个方面:
(1)掌握四个关系式:电子层数=周期序数;最外层电子数=主族序数;主族元素的最高正化合价=族序数;主族元素的最低负化合价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律:各周期元素的种类数(分别为2、8、8、18、18、32、26);稀有气体元素的原子序数(分别为2、10、18、36、54、86)和所在周期(分别在一到六周期);同族上下相邻元素原子序数的关系(相差2、8、18、32等情况);同周期第ⅡA族与第ⅢA族元素原子序数的差值(有1、11、25等情况)。变式应用1.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同解析:第三周期的Al元素,既有金属性,又有非金属性,故A错误;H+最外层无电子,Li+最外层2个电子,因此并非所有的短周期元素原子形成离子后,最外层都达到8电子稳定结构,故C错;同主族元素的原子,化学性质有相似性,但并不完全相同。
答案:B 二、元素推断 A、B、C、D、E为原子序数依次增大的短周期元素。已知A、B、E三原子最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水;C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。请回答下列问题:
(1)写出下列元素符号。
A________,C________,D________。(2)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式________________________________________________________________________;
A、E两元素最高价氧化物对应的水化物相互反应的化学方程式________________________________________________________________________。
(3)比较C、D最高价氧化物对应水化物的酸性________________________。解析:A、B、E三种元素最高价氧化物对应的水化物为酸或碱,两两皆能反应,因此必有一种是两性物质Al(OH)3,另外两种为强酸、强碱,由于五种元素均为短周期元素,故强碱是NaOH。又A、B、E三原子最外层电子数之和为11,且原子序数依次增大,可推出E原子最外层有7个电子,短周期元素中只有Cl符合要求,两两反应的三种物质是NaOH、Al(OH)3、HClO4。C、D原子序数小于17,大于13,由题意推出C、D分别为Si和P,非金属性Si<P,因此酸性H2SiO3<H3PO4。答案:(1)Na Si P
(2)Al(OH)3+NaOH===NaAlO2+2H2O
NaOH+HClO4===NaClO4+H2O
(3)H3PO4>H2SiO3变式应用2.六种短周期元素A、B、C、D、E、F,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小,B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D的单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E的单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答下列问题:(1)元素名称。
A________,B________,C________,D________。
(2)E在元素周期表中的位置:___________________________________________________。
(3)F的离子结构示意图:
________________________________________。氢 碳 氧 钠第三周期、第ⅥA族(4)C、D按原子个数比1:1组成的一种化合物与水发生反应的化学方程式为___________________________________________________。
(5)能说明E的非金属性比F的非金属性________(填“强”或“弱”)的事实是______________________________________________ (举一例)。2Na2O2+2H2O===4NaOH+O2↑氯气能从硫化钠溶液中置换出硫(合理答案均可)弱水平测试1.对于相同周期主族元素来说,下列叙述正确的是( )
①最高正化合价都是依次升高(由+1→+7)
②原子半径依次减小
③元素的还原性依次减弱,氧化性依次增强
A.①② B.②③ C.①③ D.①②③解析:氟非金属性最强,没有正化合价。
答案:B2.(2011年广州检测)某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )
A.R一定是第四周期元素
B.R一定是第ⅣA族元素
C.R的气态氢化物比同周期其他元素气态氢化物稳定
D.R气态氢化物化学式为H2RD3.某短周期元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
A.在周期表中处于第三周期ⅦA族
B.处于第二周期ⅤA族
C.氢化物没有PH3、H2S稳定
D.常见的价态只有-3、+2、+3、+5价解析:气态氢化物与该元素最高价氧化物的水化物反应生成盐的元素X为N元素,位于元素周期表中的第二周期第ⅤA族,所以A错,B正确;选项C,NH3、PH3、H2S的稳定性比较为NH3>PH3,PH3<H2S,所以C错;选项D,N元素常见的价态有-3,0,+1,+2,+3,+4,+5价,所以D错。
答案:B4.下列结论正确的是( )
①电子层数:S2->Cl->Br->F-
②氢化物稳定性:HF>HCl>H2S>H2Te
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥非金属性:F>Cl>S>Se
A.只有② B.①③⑤ C.②④⑥ D.只有⑥C5.下列说法正确的是( )
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小解析:同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,而不同周期两族元素金属性的比较要结合同族元素的递变规律进行,如果忽略了是否是同周期元素,易错选A。错选C是忽略了“最高价氧化物”与“氧化物”的区别,而错用递变规律造成的。错选D是把原子半径的递变规律误认为是离子半径的递变规律。
答案:B 6.下表是周期表中的一部分,根据A~N在周期表中的位置,按要求回答下列问题:(1)表中元素,只有负价而无正价的元素是________,氧化性最强的单质是________,还原性最强的单质是________ (用相关的元素符号或分子式表示) 。FF2 Na(2)最高价的氧化物的水化物碱性最强的是________,酸性最强的是________,呈两性的是________。(本小题均填物质的名称)
(3)A、B、C、D、F、H、I形成的单质中,熔点最高的物质的化学式为________。
(4)在B、C、D、F、G、H中,原子半径从大到小的顺序为______________________(用元素符号表示)。氢氧化钠高氯酸 氢氧化铝CNa>Mg>Al>C>N>F能力提升7.下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高正化合价为+3 ②第ⅦA族元素是同周期中非金属性最强的元素 ③第二周期第ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期第ⅡA族
A.①② B.①③ C.②④ D.③④解析:①原子序数为15的元素是磷,其最高正化合价为+5价,错误;②在周期表中,同一周期从左至右元素非金属性逐渐增强,卤素是同周期中非金属性最强的元素,碱金属元素是同周期中金属性最强的元素,正确;③第二周期ⅣA族元素是碳,碳原子有多种同位素:12C、13C、14C,只有12C中质子数和中子数相等,且都等于6,错误;④原子序数为12的元素是镁,它位于第三周期第ⅡA族,正确。
答案:C8.已知:A、B两元素的阴离子具有相同的电子层结构;A元素的阴离子半径大于B元素的阴离子半径;C和B两元素的原子核外电子层数相同;C元素原子的原子半径大于A元素原子的原子半径。A、B、C三种元素的原子序数的关系是( )
A.A>B>C B.B>A>C
C.C>A>B D.A>C>B解析:A、B两元素的阴离子具有相同的电子层结构,因此是同周期元素,半径大则核电荷数少,则有原子序数A<B。B、C原子电子层相同,因此,A、B、C同周期,原子半径大则原子序数小,则原子序数C<A。
答案:B 9.(2011年烟台检测)现有部分短周期元素的性质或原子结构如下表:(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____________。(2)元素Y与氢元素形成一种离子YH ,写出某溶液中含该微粒的检验方法________________________________________________________________________。
(3)元素Z在周期表中的位置是____________,元素Z与元素T相比,非金属性较强的是____________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与NaOH溶液反应 10.某同学做元素周期律性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表(记录现象时随手记在纸片上,不对应,需整理):(续上表)请帮助该同学整理并完成实验报告
(1)实验目的:__________________________________。(2)实验用品:_________________________________。(3)实验内容。(4)实验结论:__________________________________________________。解析:根据所给出的实验内容不难看出,该学生是想以第三周期为例,设计实验验证同一周期主族元素性质的递变规律。分析过程如下,先分析每个实验可得出的结论:①、③做的是镁、钠分别和水反应的实验,比较两者和水反应的难易程度及两者最高价氧化物对应水化物碱性的强弱;②Cl2能从H2S中置换出硫;④、⑤可分别得出镁、铝和盐酸置换反应的难易;⑥氢氧化铝是一种两性氢氧化物。把上述分析结果连成一个整体来看,可发现这6个实验都是研究第三周期的单质和化合物的性质,从中可比较出钠、镁、铝三种元素金属性强弱和氯、硫两种元素的非金属性强弱,所以这一套实验的目的是“验证第三周期元素从左到右金属性递减、非金属性递增的规律”。
(2)回忆每个实验过程可知,这些实验要用到的仪器有:试管、酒精灯、砂纸、镊子、小刀、胶头滴管等。
(3)根据元素周期表第三周期的排列顺序,可确定实验操作顺序和相关实验现象。
(4)该小题具有一定的开放性,如金属性Na>Mg>Al;非金属性:S<Cl都对,但答题时最好与该实验的目的相对应:同一周期,从左往右金属性逐渐减弱,非金属性逐渐增强。
答案:(1)验证第三周期元素从左至右金属性递减、非金属性递增的规律
(2)试管、酒精灯、砂纸、镊子、小刀、胶头滴管等 (3)(4)同一周期,从左至右金属性逐渐减弱,非金属性逐渐增强感谢您的使用,退出请按ESC键本小节结束
