【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第三节 第1课时 离子键(46张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第三节 第1课时 离子键(46张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 788.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:05:23 | ||
图片预览










文档简介
课件46张PPT。第三节 化 学 键
第1课时 离 子 键物质结构 元素周期律第1课时 离 子 键美、德两国科学家成功合成出具有独特化学特性的氢铝化合物,这一研究成果有助于人们开发出推力更强大的固体火箭燃料,也有望应用在氢动力汽车和其他能源方面。这种氢铝化合物具有相当稳定的化学特性,其稳定的特性是保证该化合物今后可能用作火箭固体燃料的关键。在未来的“氢经济”社会中,驱动汽车和电网的电能可能将产生于全球最丰富的元素——氢。1.了解离子键的概念。
2.了解离子化合物的概念。离子键的形成1.Na在Cl2中的燃烧剧烈燃烧 黄色 白烟2.NaCl的形成过程
(1)Na原子______个电子达到______稳定结构,成为______;Cl原子______个电子达到______稳定结构,形成______。带相反电荷的__________,通过静电作用结合在一起,形成______。
(2)电子式。
在元素符号周围用“·”或“×”表示原子或离子的最外层电子的式子叫做电子式。
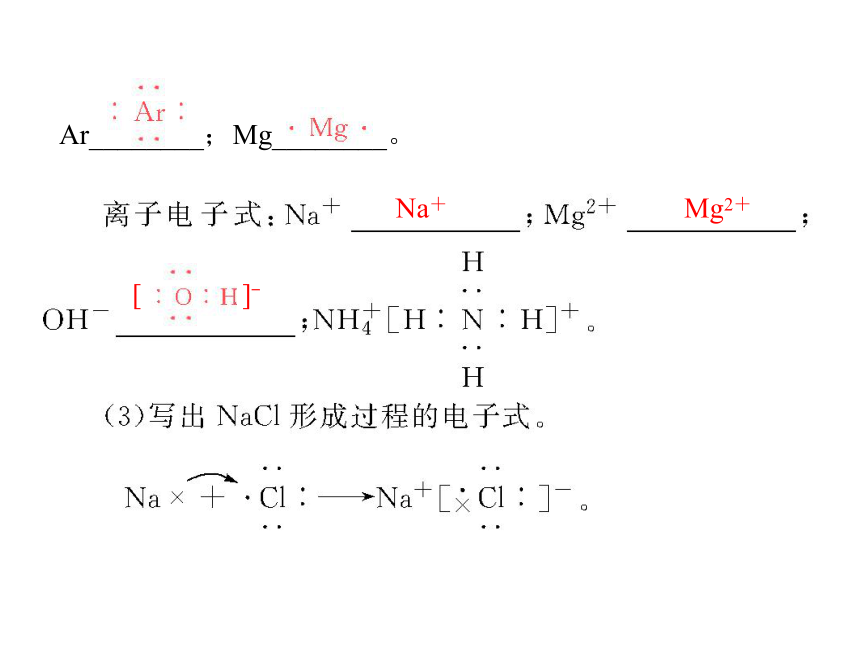
原子电子式:H ________;Cl________;S________;NaCl失去1 8e-Na+ 得到1 8e-Cl- Na+和Cl-Ar________;Mg________。Na+ Mg2+3.离子键
_____________________________称为离子键。
成键微粒:____________;相互作用:__________。带相反电荷的离子间的相互作用阴、阳离子 静电作用应用思考:1.离子键是阴、阳离子间的“吸引”作用,对吗?2.离子键的形成条件是什么?提示:不对,阴、阳离子之间的静电作用既有阴、阳离子之间的静电吸引,也有原子核与原子核、核外电子与核外电子的静电排斥。离子化合物1.定义:由______构成的化合物叫做离子化合物。
2.构成粒子:______________。
3.粒子间的相互作用:______。
4.种类
(1)强碱,如NaOH、Ba(OH)2、KOH等。
(2)金属氧化物,如Na2O、K2O、MgO、Al2O3等。
(3)绝大多数盐,如NaCl、K2SO4、CaCO3、Mg(NO3)2等。离子键阴离子和阳离子离子键 5.用电子式表示离子化合物的形成过程知识拓展一、离子键
离子键成键原因:①原子相互得失电子形成稳定的阴、阳离子;②离子间引力与斥力处于平衡状态。
2.成键实质:静电作用。静电作用包含阴、阳离子的静电吸引作用以及原子核与原子核、电子与电子之间的排斥作用。当两种相反的作用达到平衡时,就形成了离子键。离子化合物是引力和斥力两种相反作用的对立统一物。3.离子键的判断方法?
(1)第ⅠA、ⅡA族的金属元素的单质与第ⅥA、ⅦA族的非金属元素的单质发生反应时,一般通过离子键形成离子化合物。?
(2)金属阳离子与某些原子团(如NO-3、CO2-3、SO2-4、OH- 等)之间,通过离子键形成离子化合物。?
(3)铵根离子与酸根离子之间形成离子键,构成离子化合物。?
(4)活泼金属的氧化物、过氧化物(如Na2O2)中存在离子键。二、离子键的三个“一定”和两个“不一定”
1.三个“一定”
(1)离子化合物中一定含有离子键。
(2)含有离子键的物质一定是离子化合物。
(3)离子化合物中一定含有阴离子和阳离子。
2.两个“不一定”
(1)离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
(2)含有金属元素的化合物不一定是离子化合物,如AlCl3。 三、电子式的书写(续上表)(续上表)尝试应用1.下列最易形成阴离子的元素是( )
A.Cl B.F C.Na D.K解析:Cl、F易得电子形成阴离子。F的非金属性强于Cl,更易形成阴离子,Na、K易失电子形成阳离子。
答案:B2.下列物质中含离子键的是( )
A.Cl2 B.CO2 C.NaCl D.CH4解析:一般来说,金属元素与非金属元素形成离子键,但部分物质如AlCl3、BeCl2除外。
答案:C3.下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢
C.硫酸 D.醋酸A一、离子键和离子化合物 下列叙述中不正确的是( )
A.活泼金属与活泼非金属化合时,能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阳离子半径比相应的原子半径小,而阴离子半径比相应的原子半径大解析:活泼金属容易失电子,形成阳离子,活泼非金属容易得电子,形成阴离子,离子键是阴、阳离子之间的静电作用形成的,A对。静电作用包括静电引力和斥力,B错。原子成键时失电子,带正电荷,得电子,带负电荷,离子所带电荷的数目与得失电子数一致,C正确。
答案:B名师点睛:阳离子可以是单核,也可以是多核;金属原子、非金属原子都能形成阳离子;主族元素形成的阳离子,电子层结构与稀有气体相同,副族元素形成的阳离子,电子层结构多数与稀有气体不同;阳离子不一定都具有稳定结构。1.下列有关阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子 ③阳离子的电子排布一定与稀有气体元素原子相同 ④阳离子的价态不会大于其原子的最外层电子数 ⑤阳离子都是稳定结构,不会再失去电子
A.①④ B.②④
C.①②③ D.①②③④⑤变式应用D 二、电子式的书写下列离子化合物的电子式不正确的是( )解析:简单阳离子的电子式和离子符号相同(原子团除外),简单阴离子的电子式是在元素符号周围有8个电子(氢负离子有2个电子),然后用中括号括上,右上角标明所带负电荷数。阴、阳离子构成的电子式中,正电荷总数等于负电荷总数,且相同的离子不得合并。A选项中钙原子失去两个电子形成离子时,电子式和离子符号都是Ca2+,氯原子获得1个电子,成为带1个单位负电荷的离子,其电子式为[? ]-,在氯化钙中有两个氯离子,1个钙离子,但是两个阴离子不能写在一起,故A选项正确;硫化钠的电子式也正确,排除B选项;氟化钾的电子式也符合电子式的书写规则,排除C选项;氧化钠是离子化合物,阴离子没有用中括号括上,也没有标出所带负电荷数,氧化钠电子式的正确书写是:Na+[ ]2-Na+,D选项错误。故正确答案为D。
答案:D
名师点睛:电子式书写的几种常见错误:①漏写孤对电子;②原子(离子)结合顺序写错;③错误使用方括号;④误将电荷数标成化合价;⑤复杂阳离子与单核阳离子混淆不清。2.判断下列用电子式表示的化合物的形成过程正确与否,正确的在后面括号中填“√”,错误的在后面括号中填“×”。变式应用××√水平测试1.下列叙述错误的是( )
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素原子的最外层只有一个电子,它跟卤素结合时不一定形成离子键
D.非金属原子间也可能形成离子键解析:相互作用包括相互吸引和相互排斥两个方面,故A错;B项说法是正确的,金属元素和非金属元素化合时,有可能形成共价键,如AlCl3和BeCl2就是两种共价化合物;C项说法是正确的,如H原子的最外层只有1个电子,它与Cl原子通过共价键结合成HCl分子;D项说法是正确的,如NH 是由非金属元素形成的阳离子,铵盐为离子化合物。
答案:A 2.(双选题)下列哪一组元素的原子间反应容易形成离子键( )A.a和b B.a和f
C.d和g D.b和g解析:原子间得失电子能力差别越大,发生反应时越易形成阴、阳离子,就越易形成离子键,所以活泼金属和活泼非金属的原子间反应容易形成离子键。
答案:BD3.下列离子化合物中,离子、电子结构都与氩的电子层结构相同的是( )
A.MgCl2 B.CaBr2
C.K2S D.Na2O解析:氩的原子结构示意图为 ,有三个电子层,只有C符合题意。
答案:C4.(双选题)下列物质结构中有离子键的是( )
A.干冰 B.NH4Cl
C.Na2O2 D.HI5.已知氮化钠是离子化合物,下列叙述不正确的是( )
A.Na3N是氮化钠的分子式
B.Na+与N3-的电子层结构都与氖原子的结构相同解析:离子化合物中不存在分子,也就不存在所谓的分子式,Na3N是氮化钠的化学式。
答案:A6.A+和B2-都与Ar原子具有相同的电子层结构,则A的元素符号为____________,B元素的原子结构示意图为____________,它们形成的化合物的电子式为________。能力提升7.Na、Mg、S、Cl四种元素的原子彼此间以离子键结合的化合物有( )
A.1种 B.2种 C.3种 D.4种解析:Na2S、NaCl、MgS、MgCl2都是离子化合物,故答案为D。
答案:D8.(双选题)A、B两元素的原子序数分别为11和8,二者化合生成离子化合物Z。则下列说法中错误的是( )
A.A一定形成+1价阳离子
B.B一定形成-2价单核阴离子
C.Z一定能与水反应
D.Z一定是A2B型化合物解析:A、B分别为Na和O,能形成Na2O和Na2O2两种离子化合物。
答案:BD9.A、B、C 3种短周期元素,原子序数依次增大,3种元素原子序数之和为35,A、C同主族,B+核外有10个电子,则:
(1)A、B、C 3种元素分别是__________、____________、____________(填元素名称)。
(2)A、B、C 三种元素两两之间能形成多种化合物,其中属于离子化合物的化学式分别为____________、____________、____________。(3)用电子式表示B和C形成离子化合物的过程: ______________________________________________________________________________________________________。10.A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系:D>E>B>C>A。
②A、D同主族,B、C、E是三个连续的主族元素,且最外层电子数依次增加。
③C是地壳中含量最多的元素,D与C可形成原子个数比为1:1或2:1的化合物。请填空以下空白:
(1)化合物D2C2的电子式为________。用电子式表示D2C的形成过程________________________________________。
(2)单质A和单质B在一定条件下发生反应的化学方程式为________________________________________________。
(3)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为__________________________________________________。感谢您的使用,退出请按ESC键本小节结束
第1课时 离 子 键物质结构 元素周期律第1课时 离 子 键美、德两国科学家成功合成出具有独特化学特性的氢铝化合物,这一研究成果有助于人们开发出推力更强大的固体火箭燃料,也有望应用在氢动力汽车和其他能源方面。这种氢铝化合物具有相当稳定的化学特性,其稳定的特性是保证该化合物今后可能用作火箭固体燃料的关键。在未来的“氢经济”社会中,驱动汽车和电网的电能可能将产生于全球最丰富的元素——氢。1.了解离子键的概念。
2.了解离子化合物的概念。离子键的形成1.Na在Cl2中的燃烧剧烈燃烧 黄色 白烟2.NaCl的形成过程
(1)Na原子______个电子达到______稳定结构,成为______;Cl原子______个电子达到______稳定结构,形成______。带相反电荷的__________,通过静电作用结合在一起,形成______。
(2)电子式。
在元素符号周围用“·”或“×”表示原子或离子的最外层电子的式子叫做电子式。
原子电子式:H ________;Cl________;S________;NaCl失去1 8e-Na+ 得到1 8e-Cl- Na+和Cl-Ar________;Mg________。Na+ Mg2+3.离子键
_____________________________称为离子键。
成键微粒:____________;相互作用:__________。带相反电荷的离子间的相互作用阴、阳离子 静电作用应用思考:1.离子键是阴、阳离子间的“吸引”作用,对吗?2.离子键的形成条件是什么?提示:不对,阴、阳离子之间的静电作用既有阴、阳离子之间的静电吸引,也有原子核与原子核、核外电子与核外电子的静电排斥。离子化合物1.定义:由______构成的化合物叫做离子化合物。
2.构成粒子:______________。
3.粒子间的相互作用:______。
4.种类
(1)强碱,如NaOH、Ba(OH)2、KOH等。
(2)金属氧化物,如Na2O、K2O、MgO、Al2O3等。
(3)绝大多数盐,如NaCl、K2SO4、CaCO3、Mg(NO3)2等。离子键阴离子和阳离子离子键 5.用电子式表示离子化合物的形成过程知识拓展一、离子键
离子键成键原因:①原子相互得失电子形成稳定的阴、阳离子;②离子间引力与斥力处于平衡状态。
2.成键实质:静电作用。静电作用包含阴、阳离子的静电吸引作用以及原子核与原子核、电子与电子之间的排斥作用。当两种相反的作用达到平衡时,就形成了离子键。离子化合物是引力和斥力两种相反作用的对立统一物。3.离子键的判断方法?
(1)第ⅠA、ⅡA族的金属元素的单质与第ⅥA、ⅦA族的非金属元素的单质发生反应时,一般通过离子键形成离子化合物。?
(2)金属阳离子与某些原子团(如NO-3、CO2-3、SO2-4、OH- 等)之间,通过离子键形成离子化合物。?
(3)铵根离子与酸根离子之间形成离子键,构成离子化合物。?
(4)活泼金属的氧化物、过氧化物(如Na2O2)中存在离子键。二、离子键的三个“一定”和两个“不一定”
1.三个“一定”
(1)离子化合物中一定含有离子键。
(2)含有离子键的物质一定是离子化合物。
(3)离子化合物中一定含有阴离子和阳离子。
2.两个“不一定”
(1)离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。
(2)含有金属元素的化合物不一定是离子化合物,如AlCl3。 三、电子式的书写(续上表)(续上表)尝试应用1.下列最易形成阴离子的元素是( )
A.Cl B.F C.Na D.K解析:Cl、F易得电子形成阴离子。F的非金属性强于Cl,更易形成阴离子,Na、K易失电子形成阳离子。
答案:B2.下列物质中含离子键的是( )
A.Cl2 B.CO2 C.NaCl D.CH4解析:一般来说,金属元素与非金属元素形成离子键,但部分物质如AlCl3、BeCl2除外。
答案:C3.下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢
C.硫酸 D.醋酸A一、离子键和离子化合物 下列叙述中不正确的是( )
A.活泼金属与活泼非金属化合时,能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阳离子半径比相应的原子半径小,而阴离子半径比相应的原子半径大解析:活泼金属容易失电子,形成阳离子,活泼非金属容易得电子,形成阴离子,离子键是阴、阳离子之间的静电作用形成的,A对。静电作用包括静电引力和斥力,B错。原子成键时失电子,带正电荷,得电子,带负电荷,离子所带电荷的数目与得失电子数一致,C正确。
答案:B名师点睛:阳离子可以是单核,也可以是多核;金属原子、非金属原子都能形成阳离子;主族元素形成的阳离子,电子层结构与稀有气体相同,副族元素形成的阳离子,电子层结构多数与稀有气体不同;阳离子不一定都具有稳定结构。1.下列有关阳离子的说法中错误的是( )
①阳离子都是由一个金属原子失去电子而形成的 ②非金属原子不能形成阳离子 ③阳离子的电子排布一定与稀有气体元素原子相同 ④阳离子的价态不会大于其原子的最外层电子数 ⑤阳离子都是稳定结构,不会再失去电子
A.①④ B.②④
C.①②③ D.①②③④⑤变式应用D 二、电子式的书写下列离子化合物的电子式不正确的是( )解析:简单阳离子的电子式和离子符号相同(原子团除外),简单阴离子的电子式是在元素符号周围有8个电子(氢负离子有2个电子),然后用中括号括上,右上角标明所带负电荷数。阴、阳离子构成的电子式中,正电荷总数等于负电荷总数,且相同的离子不得合并。A选项中钙原子失去两个电子形成离子时,电子式和离子符号都是Ca2+,氯原子获得1个电子,成为带1个单位负电荷的离子,其电子式为[? ]-,在氯化钙中有两个氯离子,1个钙离子,但是两个阴离子不能写在一起,故A选项正确;硫化钠的电子式也正确,排除B选项;氟化钾的电子式也符合电子式的书写规则,排除C选项;氧化钠是离子化合物,阴离子没有用中括号括上,也没有标出所带负电荷数,氧化钠电子式的正确书写是:Na+[ ]2-Na+,D选项错误。故正确答案为D。
答案:D
名师点睛:电子式书写的几种常见错误:①漏写孤对电子;②原子(离子)结合顺序写错;③错误使用方括号;④误将电荷数标成化合价;⑤复杂阳离子与单核阳离子混淆不清。2.判断下列用电子式表示的化合物的形成过程正确与否,正确的在后面括号中填“√”,错误的在后面括号中填“×”。变式应用××√水平测试1.下列叙述错误的是( )
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素原子的最外层只有一个电子,它跟卤素结合时不一定形成离子键
D.非金属原子间也可能形成离子键解析:相互作用包括相互吸引和相互排斥两个方面,故A错;B项说法是正确的,金属元素和非金属元素化合时,有可能形成共价键,如AlCl3和BeCl2就是两种共价化合物;C项说法是正确的,如H原子的最外层只有1个电子,它与Cl原子通过共价键结合成HCl分子;D项说法是正确的,如NH 是由非金属元素形成的阳离子,铵盐为离子化合物。
答案:A 2.(双选题)下列哪一组元素的原子间反应容易形成离子键( )A.a和b B.a和f
C.d和g D.b和g解析:原子间得失电子能力差别越大,发生反应时越易形成阴、阳离子,就越易形成离子键,所以活泼金属和活泼非金属的原子间反应容易形成离子键。
答案:BD3.下列离子化合物中,离子、电子结构都与氩的电子层结构相同的是( )
A.MgCl2 B.CaBr2
C.K2S D.Na2O解析:氩的原子结构示意图为 ,有三个电子层,只有C符合题意。
答案:C4.(双选题)下列物质结构中有离子键的是( )
A.干冰 B.NH4Cl
C.Na2O2 D.HI5.已知氮化钠是离子化合物,下列叙述不正确的是( )
A.Na3N是氮化钠的分子式
B.Na+与N3-的电子层结构都与氖原子的结构相同解析:离子化合物中不存在分子,也就不存在所谓的分子式,Na3N是氮化钠的化学式。
答案:A6.A+和B2-都与Ar原子具有相同的电子层结构,则A的元素符号为____________,B元素的原子结构示意图为____________,它们形成的化合物的电子式为________。能力提升7.Na、Mg、S、Cl四种元素的原子彼此间以离子键结合的化合物有( )
A.1种 B.2种 C.3种 D.4种解析:Na2S、NaCl、MgS、MgCl2都是离子化合物,故答案为D。
答案:D8.(双选题)A、B两元素的原子序数分别为11和8,二者化合生成离子化合物Z。则下列说法中错误的是( )
A.A一定形成+1价阳离子
B.B一定形成-2价单核阴离子
C.Z一定能与水反应
D.Z一定是A2B型化合物解析:A、B分别为Na和O,能形成Na2O和Na2O2两种离子化合物。
答案:BD9.A、B、C 3种短周期元素,原子序数依次增大,3种元素原子序数之和为35,A、C同主族,B+核外有10个电子,则:
(1)A、B、C 3种元素分别是__________、____________、____________(填元素名称)。
(2)A、B、C 三种元素两两之间能形成多种化合物,其中属于离子化合物的化学式分别为____________、____________、____________。(3)用电子式表示B和C形成离子化合物的过程: ______________________________________________________________________________________________________。10.A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系:D>E>B>C>A。
②A、D同主族,B、C、E是三个连续的主族元素,且最外层电子数依次增加。
③C是地壳中含量最多的元素,D与C可形成原子个数比为1:1或2:1的化合物。请填空以下空白:
(1)化合物D2C2的电子式为________。用电子式表示D2C的形成过程________________________________________。
(2)单质A和单质B在一定条件下发生反应的化学方程式为________________________________________________。
(3)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为__________________________________________________。感谢您的使用,退出请按ESC键本小节结束
