【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第三节 第2课时 共价键(74张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第一章第三节 第2课时 共价键(74张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 662.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:06:07 | ||
图片预览








文档简介
课件74张PPT。第三节 化 学 键
第2课时 共 价 键物质结构 元素周期律第2课时 共 价 键1.同学们都知道:在通常情况下,将水加热到100 ℃时,水便会沸腾,而要使水分解成氢气和氧气,却需要将水加热至1 000 ℃这样的高温时,才会有部分水分解。这是为什么呢?
2.同学们根据初中所学的知识就已知道:白炽灯发光是物理变化而不是化学变化。区别化学变化和物理变化的依据是:看有没有新物质生成。那么,同学们是否知道化学变化的本质是什么呢?1.了解共价键、共价化合物的概念。
2.了解化学键的概念。
3.认识化学反应的实质。 共价键1.Cl2的形成
(1)两个氯原子的最外层都有____个电子,要达到8电子稳定结构,都需获得____个电子,因此氯原子间难以发生电子______,如果两个氯原子各提供____个电子,形成____________,两个氯原子就都形成8电子稳定结构。共用电子对71得失1(2)写出Cl2形成的过程。
___________________________________。
结构式:在化学上,常用“____”表示一对电子,所得的式子叫结构式。Cl2的结构式______,H2的结构式______。
2.共价键
(1)定义:原子间通过__________所形成的________。
(2)成键粒子:________。Cl—Cl H—H—共用电子对 相互作用原子(3)成键元素:一般是同种或不同种________元素。
(4)存在。
①非金属元素的多原子单质,如__________________。
②共价化合物,如__________________________________________________。
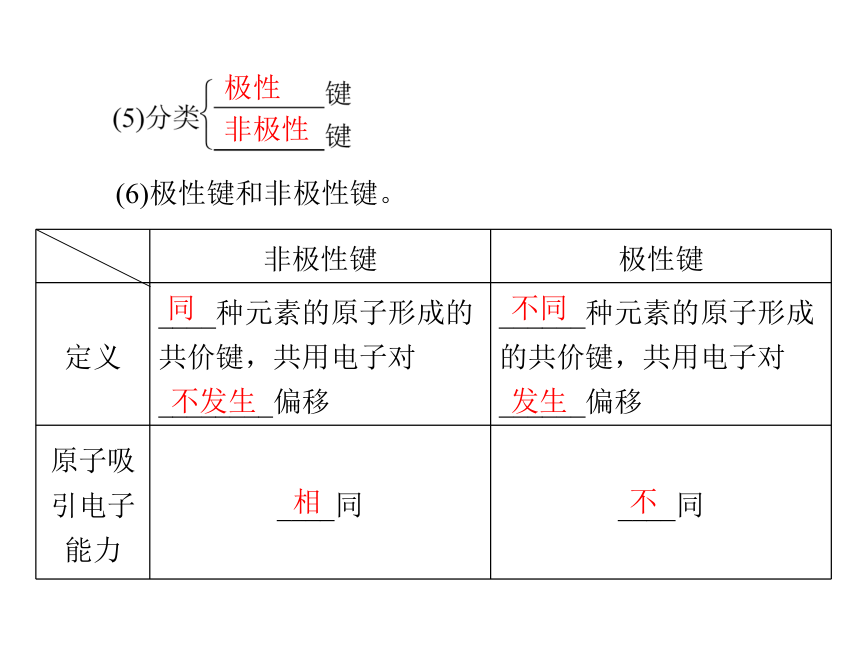
③某些离子化合物,如__________________________________________________。非金属H2、O2、O3、N2HCl、H2O、CO2、H2SO4NaOH、NH4Cl、Na2O2(6)极性键和非极性键。极性
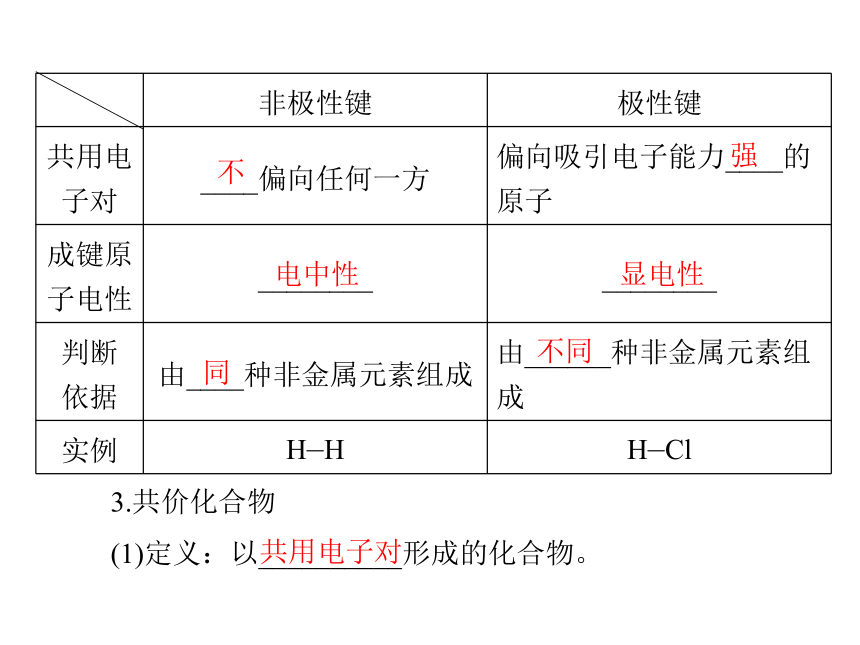
非极性同不发生不同发生相不不强电中性 显电性同不同3.共价化合物
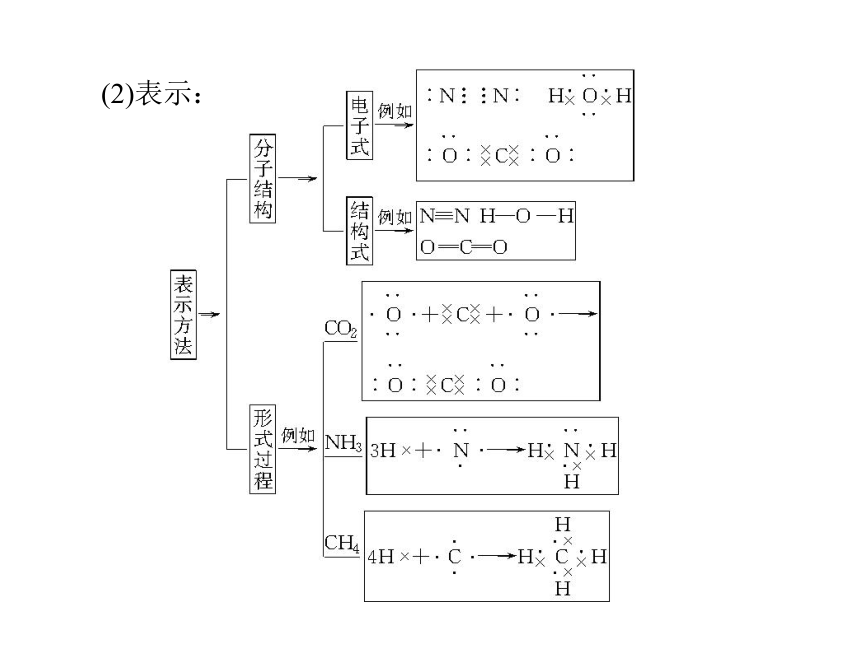
(1)定义:以__________形成的化合物。共用电子对(2)表示:应用思考:1.只有共价化合物中才含有共价键吗?
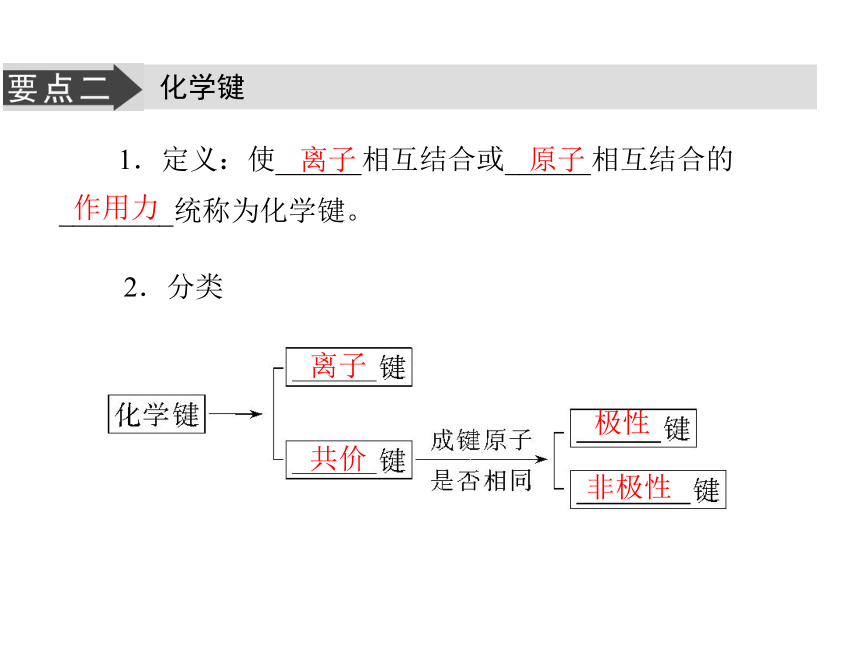
2.如何判断某共价键是极性键还是非极性键?提示:不是。共价化合物中一定含有共价键,单质和离子化合物中也可能含有共价键,如H2、O2、Cl2、NH4Cl、NaOH等均含有共价键。 提示:可根据成键元素的种类来判断。若成键元素相同,如X—X型,则为非极性键;若成键元素不同,如X—Y型,则为极性键。 化学键1.定义:使______相互结合或______相互结合的________统称为化学键。2.分类离子 原子作用力离子共价极性非极性3.化学反应的本质
物质发生化学反应的本质是______________与_____________的过程。旧化学键断裂新化学键形成 应用思考:3.所有的物质中都含有化学键吗?提示:不是。稀有气体的分子都是单原子分子,分子中不存在化学键。综合拓展一、共价键与化合物的关系
1.含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等。
2.含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O—H共价键,Na2O2中含有O—O共价键,NH4Cl中含有N—H共价键,但它们都是离子化合物。
3.共价化合物中一定只含有共价键。
4.共价化合物中一定不含离子键。 二、离子化合物与共价化合物的比较(续上表)三、离子键与共价键(续上表)四、物质的变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程3.共价化合物的溶解或熔化过程
(1)溶解过程。(2)熔化过程。4.单质的熔化或溶解过程特别关注:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新键的生成,故不是化学变化。五、分子间作用力、氢键
1.分子间作用力
(1)概念:分子间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
(2)主要特征。
①广泛存在于分子之间。
②只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。③分子间作用力的能量远远小于化学键。
④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。
2.氢键
(1)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。
(2)分子间形成的氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗较多能量。(3)分子间形成氢键对物质的水溶性有影响,如NH3极易溶于水,主要是氨分子与水分子之间易形成氢键。
(4)通常N、O、F这三种元素的氢化物易形成氢键。常见易形成氢键的化合物有H2O、HF、NH3、CH3OH等。(5)氢键用“X…H”表示。如水分子间的氢键:由于氢键的存在,液态水或固态水常用(H2O)n表示。 3.化学键、分子间作用力和氢键的比较(续上表)尝试应用1.下列属于共价化合物的是( )
A.Cl2 B.HCl C.NH4Cl D.NaOHB2.(双选题)下列物质中含有极性共价键的是( )
A.单质溴 B.氯化钙
C.二氧化硫 D.氢氧化钙解析:二氧化硫中S—O键属于极性共价键,氢氧化钙中H—O键属于极性共价键。
答案:CD3.(2013·江门检测)下列物质中,既有离子键又有共价键的是( )
A.CaCl2 B.KOH C.H2O D.HF B一、共价键与共价化合物 下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键解析:NaOH、NH4Cl中都含有共价键,但二者都是离子化合物;Cl2、H2等由共价键形成,但都是单质;AlCl3中Al—Cl键为共价键。
答案:B
名师点睛:完全由非金属元素组成的化合物中一定存在共价键,但不一定是共价化合物,如NH4Cl、NH4NO3、(NH4)2SO4等是离子化合物。变式应用1.(2013·福建宁德检测)下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3 解析:A项中,NaCl中只含有离子键,HCl、H2O中只含有共价键,NaOH中既有离子键又有共价键;B项中,Cl2、HCl、SO2分子中只有共价键,而Na2S中只有离子键;D项中,Na2O2中既有离子键又有共价键,H2O2、H2O、O3分子中只有共价键。
答案:C二、化学键、分子间作用力和氢键 (2013·江苏南京模拟)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C、B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的 。请回答下列问题:
(1)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:____________,其化合物中所含化学键的类型有________。 (2)A2B与A2D的沸点:A2B________(填“高于”或“低于”)A2D,其原因是________________________________________________________________________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:________________________________________________________________________。变式应用2.下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱解析:A项与水分子中H—O的稳定性有关,与氢键无关;氢键是分子间的作用力,而非分子内的作用力,分子热稳定性主要由分子内化学键的强度决定,故D项错误;C项中几种分子之间都不能形成氢键。
答案:B 三、物质变化过程中化学键的变化 下列过程有化学键被破坏同时又有化学键形成的是( )
A.碘升华 B.冰融化
C.浓盐酸挥发 D.NH4Cl受热分解解析:碘升华只破坏分子间作用力,A项错误;冰融化只破坏分子间作用力和氢键,B项错误;浓盐酸挥发只破坏分子间作用力,C项错误;NH4Cl受热分解是化学反应,既有旧化学键的断裂又有新化学键的形成,D项正确。
答案:D名师点睛:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如金刚石受热熔化、NaCl溶于水等,只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。3.(双选题)根据化学反应的实质是旧键断裂、新键形成这一事实,下列变化不属于化学反应的是( )
A.氯气通入品红溶液中,品红溶液褪色
B. NaOH溶于水
C.NaCl熔化
D.P2O5吸水变式应用BC 四、8电子稳定结构 下列各分子中,所有原子最外层都满足8电子稳定结构的是( )
A.H2O B.BCl3 C.CCl4 D.PCl5解析:先分析各原子的成键情况,再根据各原子的最外层电子数与形成的共价键数共同判断。A项中的氢原子达到2电子稳定结构;B项中的硼原子最外层有3个电子,与3个氯原子形成化合物,硼不会达到8电子稳定结构;C项中的碳原子和氯原子均达到8电子稳定结构;D项中的磷原子最外层有5个电子,与5个氯原子形成化合物,磷原子不会达到8电子稳定结构。
答案:C名师点睛:判断分子中所有原子是否都满足最外层为8电子结构的简便方法:(1)看分子中有无H、Li、Be、B和稀有气体原子,若有,则一定不能都满足最外层为8电子结构。
(2)计算各原子的“最外层电子数+|化合价|”是否等于8,若为8,则该原子的最外层满足8电子结构,否则不满足。
(3)计算原子最外层电子数+共用电子对数是否等于8。4.下列各分子中,所有原子都达到8电子稳定结构的是( )
A.CS2 B.CH3OH C.BF3 D.BeCl2变式应用解析:CS2的结构式为S===C===S,碳和硫原子最外层都达到8电子稳定结构,A项正确;CH3OH中氢原子最外层达到2电子稳定结构;BF3中硼原子最外层不能满足8电子稳定结构;BeCl2中铍原子最外层不能满足8电子稳定结构。
答案:A水平测试1.关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由不同元素组成的多原子分子里,一定只存在极性键解析:离子化合物中一定含离子键,还可含有共价键(如NaOH),共价化合物中一定不含有离子键,一定有共价键,A错、B对;H2O2的电子式为H H,其分子中既有极性键,也有非极性键,故C、D均错。
答案:B2.下列说法正确的是( )
A.NaCl固体中含有共价键
B.CO2分子中含有离子键C3.下列过程中,共价键被破坏的是( )
A.溴挥发 B.氯气被木炭吸附
C.食盐溶于水 D.硫酸溶于水D4.下列物质中都是既含有离子键又含有共价键的一组是( )
A.NaOH、H2O、NH4Cl
B.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaCl
D.Na2SO4、HCl、MgCl2解析:只含有离子键的是:MgO、CaBr2、NaCl、MgCl2,排除C、D项;只含有共价键的是:H2O、HCl,排除A、D项;既含有离子键又含有共价键的是:NaOH、NH4Cl、KOH、Na2O2、(NH4)2S、Na2SO4。
答案:B 5.下列电子式书写正确的是( )子,正确的写法是 。
答案:D6.根据要求回答下列问题:(用序号回答)
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是________。
(2)含有共价键的离子化合物是________。
(3)含有共价键的共价化合物是________。
(4)常温时为固体,当其熔化时,不破坏化学键的是______。
(5)熔融状态和固态时,都能导电的是________。⑩①③⑤⑥②④⑦⑧能力提升7.下列说法一定正确的是( )
A.水溶液能导电的一定是离子化合物
B.熔融态能导电的一定是离子化合物
C.固态能导电的一定是金属单质
D.固态不能导电但熔融态能导电的一定是离子化合物D8.下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤MgCl2溶于水 ⑥NaCl熔化
A.全部 B.②③④⑤⑥
C.④⑤⑥ D.⑤⑥C9.根据下列要求回答相关问题:
(1)下列物质沸点递变顺序正确的是( )
A.SnH4>GeH4>SiH4>CH4
B.SbH3>AsH3>PH3>NH3
C.HI>HBr>HCl>HF
D.H2Te>H2Se>H2S>H2O(2)冰→水→水蒸气→氢气的过程中,依次克服作用力类型是( )
A.氢键、范德华力、离子键
B.氢键、氢键、极性键
C.范德华力、氢键、非极性键
D.范德华力、非极性键、极性键(3)下列说法正确的是( )
A.氨、氯化氢与水分子都能形成氢键,故它们极易溶于水
B.由于氢键存在,卤化氢中HF最稳定
C.冰的密度小于水的密度,是由于水分子间存在氢键
D.NH3、H2O、HF相对分子质量依次增大,沸点依次升高(4)比较NH3、PH3、AsH3的沸点高低:________________________________________________________________________;
简述理由:________________________________________________________________________________________________________________________________________________。解析:(1)碳族元素的氢化物分子间只存在范德华力,不存在氢键,其结构和组成相似,相对分子质量越大,沸点越高,A项正确;氨分子间存在氢键,沸点升高,其他三种氢化物只存在分子间作用力,组成和结构相似,相对分子质量越大,沸点越高,沸点高低顺序为NH3>SbH3>AsH3>PH3,B项错误;HF分子间存在氢键,沸点:HF>HI>HBr>HCl,C项错误;D项,H2O分子间存在氢键,沸点:H2O>H2Te>H2Se>H2S,D项错误。(2)冰和水分子间都存在氢键,水分子内存在极性共价键,B项正确。(3)氯化氢与水分子间不存在氢键,A项错误;氢键影响物质的物理性质,稳定性指热分解难易,是物质的化学性质,H—F键在卤化氢中最强,故HF最稳定,B项错误;冰中水分子间存在氢键比水中少,使水分子之间空隙较大,密度较小,C项正确;水、氨、氟化氢分子间都存在氢键,其强度不同,水的沸点最高,氨的沸点最低,D项错误。(4)从氢键和范德华力大小角度分析第ⅤA族氢化物沸点高低,如氨分子间存在氢键,沸点升高。
答案:(1)A (2)B (3)C(4)NH3>AsH3>PH3 氨分子间存在氢键,沸点最高;砷化氢(AsH3)和磷化氢(PH3)分子间只存在范德华力,且它们组成和结构相似,砷化氢的相对分子质量较大,分子间作用力较强,沸点较高10.过氧化氢(H2O2)的水溶液俗称双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂;过氧化钠(Na2O2)可用于制备工业上的漂白剂、特殊环境里的供氧剂、实验室里的制氧剂。过氧原子团“O2”由2个氧原子共用1对电子组成。
(1)分别写出H2O2、Na2O2的电子式:________________________________________________________________________、____________。(2)①H2O、H2O2中化学键的不同点是________________________________________________________________________________________________________________________________________________;
②Na2O、Na2O2中化学键的不同点是______________________________________________________________________________________________;
③H2O2、Na2O2的化合物类型是(共价化合物、离子化合物)________________________________________________________________________。(3)分别写出H2O2、Na2O2作供氧剂的化学反应方程式:________________________________________________________________________________________________________________________________________________。
(4)H2O2与Na2O2相比,化学键更稳定的是________(写物质的名称),主要根据是________________________________________________________________________________________________________________________________________________。 解析:H2O2与Na2O2中都含有过氧原子团“O2”。题中告知“O2”由2个O共用1对电子组成,又知H的化合价为+1,则H与O之间共用1对电子,这样就可以写出H2O2的电子式。比较H2O2与Na2O2,Na的化合价也是+1,但Na与O之间的化学键应是离子键而不是共价键,则Na2O2是由“O2”与Na组成的。联想H2O、Na2O的电子式,比较H2O与H2O2、Na2O与Na2O2的电子式,可顺利完成有关问题。写出了H2O2、Na2O2作供氧剂的化学反应方程式,能联想到相关的化学反应现象。这样的现象是H2O2、Na2O2中化学键的稳定性的反 (4)过氧化氢 Na2O2在常温下跟水快速反应生成O2,H2O2的水溶液在催化剂作用下才能较快地反应生成O2感谢您的使用,退出请按ESC键本小节结束
第2课时 共 价 键物质结构 元素周期律第2课时 共 价 键1.同学们都知道:在通常情况下,将水加热到100 ℃时,水便会沸腾,而要使水分解成氢气和氧气,却需要将水加热至1 000 ℃这样的高温时,才会有部分水分解。这是为什么呢?
2.同学们根据初中所学的知识就已知道:白炽灯发光是物理变化而不是化学变化。区别化学变化和物理变化的依据是:看有没有新物质生成。那么,同学们是否知道化学变化的本质是什么呢?1.了解共价键、共价化合物的概念。
2.了解化学键的概念。
3.认识化学反应的实质。 共价键1.Cl2的形成
(1)两个氯原子的最外层都有____个电子,要达到8电子稳定结构,都需获得____个电子,因此氯原子间难以发生电子______,如果两个氯原子各提供____个电子,形成____________,两个氯原子就都形成8电子稳定结构。共用电子对71得失1(2)写出Cl2形成的过程。
___________________________________。
结构式:在化学上,常用“____”表示一对电子,所得的式子叫结构式。Cl2的结构式______,H2的结构式______。
2.共价键
(1)定义:原子间通过__________所形成的________。
(2)成键粒子:________。Cl—Cl H—H—共用电子对 相互作用原子(3)成键元素:一般是同种或不同种________元素。
(4)存在。
①非金属元素的多原子单质,如__________________。
②共价化合物,如__________________________________________________。
③某些离子化合物,如__________________________________________________。非金属H2、O2、O3、N2HCl、H2O、CO2、H2SO4NaOH、NH4Cl、Na2O2(6)极性键和非极性键。极性
非极性同不发生不同发生相不不强电中性 显电性同不同3.共价化合物
(1)定义:以__________形成的化合物。共用电子对(2)表示:应用思考:1.只有共价化合物中才含有共价键吗?
2.如何判断某共价键是极性键还是非极性键?提示:不是。共价化合物中一定含有共价键,单质和离子化合物中也可能含有共价键,如H2、O2、Cl2、NH4Cl、NaOH等均含有共价键。 提示:可根据成键元素的种类来判断。若成键元素相同,如X—X型,则为非极性键;若成键元素不同,如X—Y型,则为极性键。 化学键1.定义:使______相互结合或______相互结合的________统称为化学键。2.分类离子 原子作用力离子共价极性非极性3.化学反应的本质
物质发生化学反应的本质是______________与_____________的过程。旧化学键断裂新化学键形成 应用思考:3.所有的物质中都含有化学键吗?提示:不是。稀有气体的分子都是单原子分子,分子中不存在化学键。综合拓展一、共价键与化合物的关系
1.含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等。
2.含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O—H共价键,Na2O2中含有O—O共价键,NH4Cl中含有N—H共价键,但它们都是离子化合物。
3.共价化合物中一定只含有共价键。
4.共价化合物中一定不含离子键。 二、离子化合物与共价化合物的比较(续上表)三、离子键与共价键(续上表)四、物质的变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程3.共价化合物的溶解或熔化过程
(1)溶解过程。(2)熔化过程。4.单质的熔化或溶解过程特别关注:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新键的生成,故不是化学变化。五、分子间作用力、氢键
1.分子间作用力
(1)概念:分子间存在一种把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力。
(2)主要特征。
①广泛存在于分子之间。
②只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。③分子间作用力的能量远远小于化学键。
④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。
2.氢键
(1)氢键不是化学键,通常把氢键看作是一种较强的分子间作用力。氢键比化学键弱,比分子间作用力强。
(2)分子间形成的氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体汽化时必须破坏分子间的氢键,消耗较多能量。(3)分子间形成氢键对物质的水溶性有影响,如NH3极易溶于水,主要是氨分子与水分子之间易形成氢键。
(4)通常N、O、F这三种元素的氢化物易形成氢键。常见易形成氢键的化合物有H2O、HF、NH3、CH3OH等。(5)氢键用“X…H”表示。如水分子间的氢键:由于氢键的存在,液态水或固态水常用(H2O)n表示。 3.化学键、分子间作用力和氢键的比较(续上表)尝试应用1.下列属于共价化合物的是( )
A.Cl2 B.HCl C.NH4Cl D.NaOHB2.(双选题)下列物质中含有极性共价键的是( )
A.单质溴 B.氯化钙
C.二氧化硫 D.氢氧化钙解析:二氧化硫中S—O键属于极性共价键,氢氧化钙中H—O键属于极性共价键。
答案:CD3.(2013·江门检测)下列物质中,既有离子键又有共价键的是( )
A.CaCl2 B.KOH C.H2O D.HF B一、共价键与共价化合物 下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键解析:NaOH、NH4Cl中都含有共价键,但二者都是离子化合物;Cl2、H2等由共价键形成,但都是单质;AlCl3中Al—Cl键为共价键。
答案:B
名师点睛:完全由非金属元素组成的化合物中一定存在共价键,但不一定是共价化合物,如NH4Cl、NH4NO3、(NH4)2SO4等是离子化合物。变式应用1.(2013·福建宁德检测)下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3 解析:A项中,NaCl中只含有离子键,HCl、H2O中只含有共价键,NaOH中既有离子键又有共价键;B项中,Cl2、HCl、SO2分子中只有共价键,而Na2S中只有离子键;D项中,Na2O2中既有离子键又有共价键,H2O2、H2O、O3分子中只有共价键。
答案:C二、化学键、分子间作用力和氢键 (2013·江苏南京模拟)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C、B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的 。请回答下列问题:
(1)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:____________,其化合物中所含化学键的类型有________。 (2)A2B与A2D的沸点:A2B________(填“高于”或“低于”)A2D,其原因是________________________________________________________________________。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式:________________________________________________________________________。变式应用2.下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀
C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱解析:A项与水分子中H—O的稳定性有关,与氢键无关;氢键是分子间的作用力,而非分子内的作用力,分子热稳定性主要由分子内化学键的强度决定,故D项错误;C项中几种分子之间都不能形成氢键。
答案:B 三、物质变化过程中化学键的变化 下列过程有化学键被破坏同时又有化学键形成的是( )
A.碘升华 B.冰融化
C.浓盐酸挥发 D.NH4Cl受热分解解析:碘升华只破坏分子间作用力,A项错误;冰融化只破坏分子间作用力和氢键,B项错误;浓盐酸挥发只破坏分子间作用力,C项错误;NH4Cl受热分解是化学反应,既有旧化学键的断裂又有新化学键的形成,D项正确。
答案:D名师点睛:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如金刚石受热熔化、NaCl溶于水等,只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。3.(双选题)根据化学反应的实质是旧键断裂、新键形成这一事实,下列变化不属于化学反应的是( )
A.氯气通入品红溶液中,品红溶液褪色
B. NaOH溶于水
C.NaCl熔化
D.P2O5吸水变式应用BC 四、8电子稳定结构 下列各分子中,所有原子最外层都满足8电子稳定结构的是( )
A.H2O B.BCl3 C.CCl4 D.PCl5解析:先分析各原子的成键情况,再根据各原子的最外层电子数与形成的共价键数共同判断。A项中的氢原子达到2电子稳定结构;B项中的硼原子最外层有3个电子,与3个氯原子形成化合物,硼不会达到8电子稳定结构;C项中的碳原子和氯原子均达到8电子稳定结构;D项中的磷原子最外层有5个电子,与5个氯原子形成化合物,磷原子不会达到8电子稳定结构。
答案:C名师点睛:判断分子中所有原子是否都满足最外层为8电子结构的简便方法:(1)看分子中有无H、Li、Be、B和稀有气体原子,若有,则一定不能都满足最外层为8电子结构。
(2)计算各原子的“最外层电子数+|化合价|”是否等于8,若为8,则该原子的最外层满足8电子结构,否则不满足。
(3)计算原子最外层电子数+共用电子对数是否等于8。4.下列各分子中,所有原子都达到8电子稳定结构的是( )
A.CS2 B.CH3OH C.BF3 D.BeCl2变式应用解析:CS2的结构式为S===C===S,碳和硫原子最外层都达到8电子稳定结构,A项正确;CH3OH中氢原子最外层达到2电子稳定结构;BF3中硼原子最外层不能满足8电子稳定结构;BeCl2中铍原子最外层不能满足8电子稳定结构。
答案:A水平测试1.关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由不同元素组成的多原子分子里,一定只存在极性键解析:离子化合物中一定含离子键,还可含有共价键(如NaOH),共价化合物中一定不含有离子键,一定有共价键,A错、B对;H2O2的电子式为H H,其分子中既有极性键,也有非极性键,故C、D均错。
答案:B2.下列说法正确的是( )
A.NaCl固体中含有共价键
B.CO2分子中含有离子键C3.下列过程中,共价键被破坏的是( )
A.溴挥发 B.氯气被木炭吸附
C.食盐溶于水 D.硫酸溶于水D4.下列物质中都是既含有离子键又含有共价键的一组是( )
A.NaOH、H2O、NH4Cl
B.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaCl
D.Na2SO4、HCl、MgCl2解析:只含有离子键的是:MgO、CaBr2、NaCl、MgCl2,排除C、D项;只含有共价键的是:H2O、HCl,排除A、D项;既含有离子键又含有共价键的是:NaOH、NH4Cl、KOH、Na2O2、(NH4)2S、Na2SO4。
答案:B 5.下列电子式书写正确的是( )子,正确的写法是 。
答案:D6.根据要求回答下列问题:(用序号回答)
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是________。
(2)含有共价键的离子化合物是________。
(3)含有共价键的共价化合物是________。
(4)常温时为固体,当其熔化时,不破坏化学键的是______。
(5)熔融状态和固态时,都能导电的是________。⑩①③⑤⑥②④⑦⑧能力提升7.下列说法一定正确的是( )
A.水溶液能导电的一定是离子化合物
B.熔融态能导电的一定是离子化合物
C.固态能导电的一定是金属单质
D.固态不能导电但熔融态能导电的一定是离子化合物D8.下列过程中化学键被破坏的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤MgCl2溶于水 ⑥NaCl熔化
A.全部 B.②③④⑤⑥
C.④⑤⑥ D.⑤⑥C9.根据下列要求回答相关问题:
(1)下列物质沸点递变顺序正确的是( )
A.SnH4>GeH4>SiH4>CH4
B.SbH3>AsH3>PH3>NH3
C.HI>HBr>HCl>HF
D.H2Te>H2Se>H2S>H2O(2)冰→水→水蒸气→氢气的过程中,依次克服作用力类型是( )
A.氢键、范德华力、离子键
B.氢键、氢键、极性键
C.范德华力、氢键、非极性键
D.范德华力、非极性键、极性键(3)下列说法正确的是( )
A.氨、氯化氢与水分子都能形成氢键,故它们极易溶于水
B.由于氢键存在,卤化氢中HF最稳定
C.冰的密度小于水的密度,是由于水分子间存在氢键
D.NH3、H2O、HF相对分子质量依次增大,沸点依次升高(4)比较NH3、PH3、AsH3的沸点高低:________________________________________________________________________;
简述理由:________________________________________________________________________________________________________________________________________________。解析:(1)碳族元素的氢化物分子间只存在范德华力,不存在氢键,其结构和组成相似,相对分子质量越大,沸点越高,A项正确;氨分子间存在氢键,沸点升高,其他三种氢化物只存在分子间作用力,组成和结构相似,相对分子质量越大,沸点越高,沸点高低顺序为NH3>SbH3>AsH3>PH3,B项错误;HF分子间存在氢键,沸点:HF>HI>HBr>HCl,C项错误;D项,H2O分子间存在氢键,沸点:H2O>H2Te>H2Se>H2S,D项错误。(2)冰和水分子间都存在氢键,水分子内存在极性共价键,B项正确。(3)氯化氢与水分子间不存在氢键,A项错误;氢键影响物质的物理性质,稳定性指热分解难易,是物质的化学性质,H—F键在卤化氢中最强,故HF最稳定,B项错误;冰中水分子间存在氢键比水中少,使水分子之间空隙较大,密度较小,C项正确;水、氨、氟化氢分子间都存在氢键,其强度不同,水的沸点最高,氨的沸点最低,D项错误。(4)从氢键和范德华力大小角度分析第ⅤA族氢化物沸点高低,如氨分子间存在氢键,沸点升高。
答案:(1)A (2)B (3)C(4)NH3>AsH3>PH3 氨分子间存在氢键,沸点最高;砷化氢(AsH3)和磷化氢(PH3)分子间只存在范德华力,且它们组成和结构相似,砷化氢的相对分子质量较大,分子间作用力较强,沸点较高10.过氧化氢(H2O2)的水溶液俗称双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂;过氧化钠(Na2O2)可用于制备工业上的漂白剂、特殊环境里的供氧剂、实验室里的制氧剂。过氧原子团“O2”由2个氧原子共用1对电子组成。
(1)分别写出H2O2、Na2O2的电子式:________________________________________________________________________、____________。(2)①H2O、H2O2中化学键的不同点是________________________________________________________________________________________________________________________________________________;
②Na2O、Na2O2中化学键的不同点是______________________________________________________________________________________________;
③H2O2、Na2O2的化合物类型是(共价化合物、离子化合物)________________________________________________________________________。(3)分别写出H2O2、Na2O2作供氧剂的化学反应方程式:________________________________________________________________________________________________________________________________________________。
(4)H2O2与Na2O2相比,化学键更稳定的是________(写物质的名称),主要根据是________________________________________________________________________________________________________________________________________________。 解析:H2O2与Na2O2中都含有过氧原子团“O2”。题中告知“O2”由2个O共用1对电子组成,又知H的化合价为+1,则H与O之间共用1对电子,这样就可以写出H2O2的电子式。比较H2O2与Na2O2,Na的化合价也是+1,但Na与O之间的化学键应是离子键而不是共价键,则Na2O2是由“O2”与Na组成的。联想H2O、Na2O的电子式,比较H2O与H2O2、Na2O与Na2O2的电子式,可顺利完成有关问题。写出了H2O2、Na2O2作供氧剂的化学反应方程式,能联想到相关的化学反应现象。这样的现象是H2O2、Na2O2中化学键的稳定性的反 (4)过氧化氢 Na2O2在常温下跟水快速反应生成O2,H2O2的水溶液在催化剂作用下才能较快地反应生成O2感谢您的使用,退出请按ESC键本小节结束
