【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第二节 第1课时 原电池(53张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第二节 第1课时 原电池(53张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 934.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:06:44 | ||
图片预览










文档简介
课件53张PPT。第二节 化学能与电能
第1课时 原 电 池化学反应与能量第1课时 原 电 池格林太太是一位美丽、乐观的中年妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的,另一颗是不锈钢的。令人百思不解的是自从镶上不锈钢假牙后,格林太太经常头痛、夜间失眠、心情烦躁……医生绞尽了脑汁,格林太太的病情仍未好转。后来一位年轻的化学家来看望格林太太,并为格林太太揭开了病因。原来是两颗金属的假牙与唾液中的电解质形成了原电池,产生了微小的电流,使得格林太太头痛。
原电池是如何形成的?它需要什么条件?1.了解化学能与电能的转化关系。
2.初步了解化学电池的工作原理及应用。
3.会书写简单的电极反应式。化学能转化为电能1.一次能源和二次能源
(1)一次能源。
直接从________取得的能源,包括风力、______、潮汐、______、原煤、______、天然气、天然铀矿等。
(2)二次能源。
________经过加工、转换得到的能源,如电力、蒸汽等。自然界 流水地热 石油一次能源2.化学能与电能的相互转化
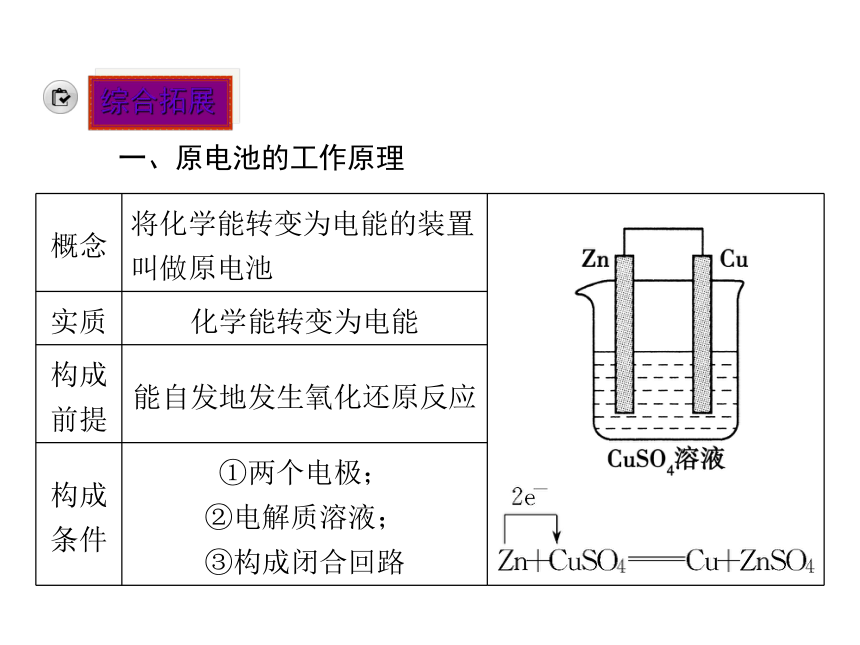
(1)燃煤发电的能量转换过程。(2)原电池。化学能 热能 机械能 电能(续上表)产生气泡 逐渐发生偏转溶液中H+在铜片上得电子生成氢原子,氢原子再结合成氢分子从铜片上逸出Zn易失电子,被氧化成Zn2+进入溶液中①定义:把__________转化为______的装置。
②构成条件:具有________________的两个电极;具有____________;电极间构成_________。
③反应本质:化学电池的反应本质是__________反应。化学能 电能活泼性不同电解质溶液 闭合回路氧化还原(3)电极方程式。
表示正、负极发生反应的方程式。如上述实验中负极方程式为:______________________;正极方程式为:________________。
(4)电极。
负极:______电子、发生______反应的电极。
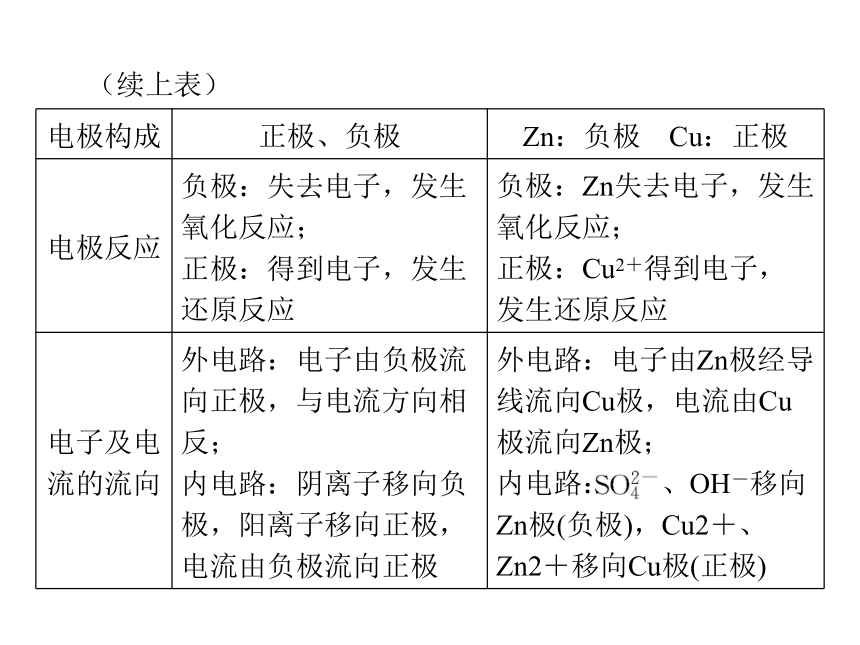
正极:______电子、发生______反应的电极。得 还原Zn-2e-===Zn2+2H++2e-===H2↑失 氧化应用思考:原电池是如何构成闭合回路的?(请从电子流向和离子移动方向分析) 提示:在外电路,电子从负极流出经导线流向正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动。综合拓展一、原电池的工作原理(续上表)(续上表)特别关注:正极或负极本身都不一定发生反应。有的电池中只有负极本身反应而正极不反应;有的电池中正、负极本身都反应;有的电池中正、负极本身都不反应。二、正、负极的判断方法
1.根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向来判断
在外电路(导线)上,电流由正极流向负极,电子流动方向是由负极流向正极。3.根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
4.根据现象判断
溶解的一极为负极,增重或有气泡放出的一极为正极。
特别关注:在判断原电池正、负极时,不要只根据金属活泼性的相对强弱,还要考虑电解质溶液。(1)Mg—Al和稀HCl构成原电池中,Mg作负极,Al作正极;而若把稀HCl换为NaOH溶液,Al作负极,Mg作正极。
(2)Al—Cu和NaOH溶液构成的原电池中,Al作负极;而若把NaOH溶液换为浓HNO3,Cu作负极。三、原电池原理的应用
1.比较金属活泼性
作负极的金属活泼性强,作正极的金属活泼性弱。
2.改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。3.保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀。在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
4.原电池的设计
以Zn+CuSO4===ZnSO4+Cu为例说明。特别关注:在设计原电池时,若给出的是离子反应方程式,如:Fe+Cu2+===Cu+Fe2+,此时电解质不确定为具体的物质,只要是可溶性铜盐即可,如CuCl2、CuSO4等。尝试应用1.根据Zn+2H+===Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
A.镁 B.石墨 C.铝 D.铅解析:特别注意题干中要求选择金属材料,故先否定选项B,而A、C选项金属均比Zn活泼,故选D。
答案:D2.有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中,只有金属能作负极
C.原电池工作时,阳离子向正极方向移动
D.原电池工作时,阳离子向负极方向移动解析:A项电子在外电路由负极流向正极,B项氢氧燃料电池等选用导电碳棒作两极材料也可以。
答案:C3.关于如右图所示装置的叙述中,正确的是( )
A.铜是正极,铜片附近有气泡产生
B.铜片质量逐渐减少
C.锌是负极,锌片上有气泡产生
D.氢离子在锌片表面被还原A一、原电池的构成某活动小组设计原电池装置,你认为设计合理的是( )解析:由原电池的构成条件可知,A项中的两个电极相同,不能形成原电池;C项中没有形成闭合回路,不能形成原电池;D项中酒精为非电解质,也不能形成原电池;Fe能与CuSO4溶液反应,选B项。
答案:B
名师点睛:构成原电池的基本条件:
(1)有两个金属活动性不同的电极(金属与金属或金属与导电的非金属)。
(2)有电解质溶液。
(3)构成闭合回路。
(4)有自发的氧化还原反应发生。变式应用1.理论上不能设计成原电池的化学反应是( )
A.CH4+2O2===CO2+2H2O
B.HNO3+NaOH===NaNO3+H2O
C.2H2+O2===2H2O
D.2FeCl3+Fe===3FeCl2B二、原电池的工作原理 如右下图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极
②H+向负极移动
③电子是由Zn经外电路流向Cu
④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生的H2为0.5 mol
⑥正极的电极反应式为Zn-2e-===Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④ 名师点睛:原电池的工作原理可用顺口溜帮助掌握:原电池分为两极;负极氧化正还原;电子由负流向正;离子阳正阴向负。变式应用2.下列装置中,导线中的电子由左边一极流向右边一极的是( )解析:C中Zn作负极,C作正极,D中Fe作负极,C作正极。其中D中发生的电极反应为:负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-。
答案:C1. 下列有关燃煤发电的一系列能量转换的过程,正确的是 ( )?
A.化学能→热能→机械能→电能?
B.热能→化学能→机械能→电能?
C.机械能→化学能→热能→电能?
D.热能→机械能→化学能→电能?水平测试C 2.某原电池的总反应的离子方程式是:Zn+Cu2+=== Zn2++Cu,此反应的原电池的正确组成是( )解析:原电池的负极发生氧化反应,其金属的还原性比正极较强,所以排除B选项,由原电池的总反应的离子方程式知电解质溶液应有Cu2+,故只有C项符合题意。
答案:C3.下列叙述中正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.在原电池中,电子流出的一极是负极,该电极得电子,被还原
C.原电池中发生氧化反应的电极是负极
D.原电池放电时,电流的方向是从负极到正极C4.在如右图所示的水果电池中,外电路上的电流从X电极流向Y电极。若X为铁,则Y可能是( )A.锌 B.石墨 C.银 D.铜解析:电流的方向与电子的移动方向相反,由已知条件知电子由Y电极移向X电极,因此Y电极的金属活动性强于铁,故Y电极只能为选项中的锌。
答案:A 5.在装有水的容器中,用棉线悬挂一个在水中保持水平的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处,如右下图所示,再向水中加入少量CuSO4溶液,经过一段时间后看到的现象是( )A.铁端将附着铜增重下沉
B.铜端将附着铜增重下沉
C.铁端粗细不变而上升
D.铜端粗细不变而下沉解析:当向水中加入CuSO4溶液后,Fe、Cu与CuSO4溶液构成了原电池。因为Fe比Cu活泼,则Fe作原电池的负极,发生反应:Fe-2e-===Fe2+,铁棒变细,而Cu作原电池的正极,发生反应:Cu2++2e-===Cu,铜端有 Cu单质析出附着在铜棒上,因此铜棒变粗,质量增大,所以铜端下沉,铁端上升。
答案:B 6.由A、B、C、D四种金属按下表中装置进行实验。根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 _________________________________________________。
(2)装置乙中正极的电极反应式是 _________________________________________________。
(3)装置丙中溶液的pH ____________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_________________________________________________。解析:据图Ⅰ知活泼性:A>B,A作负极,电极反应为A-2e-===A2+;据图Ⅱ知活泼性:B>C,正极反应为Cu2++2e-===Cu;据图Ⅲ知活泼性:D>A,正极反应为2H++2e-===H2↑,故c(H+)减小,pH增大。据Ⅰ、Ⅱ、Ⅲ知活泼性:D>A>B>C。
答案:(1)A-2e-===A2+ (2)Cu2++2e-===Cu
(3)变大 (4)D>A>B>C能力提升7.有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池。若A与B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
A.A>B>C>D B.A>C>D>B
C.C>A>D>B D.B>D>C>A解析:由组成的四个原电池可判断出A、B、C、D四种金属的活动性为①A>B,②C>D,③A>C,④D>B,因此有A>C>D>B,即B项正确。
答案:B8.(双选)(2013·四川成都模拟)下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质BD 9.分别按甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。请回答下列问题:(1)下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液中的H+浓度均减小
D.产生气泡的速率甲比乙慢(2)甲装置中的能量转化形式:____________能转化为__________能,乙装置中的能量转化形式:____________能转化为____________能。
(3)在甲装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是________________________________________________________________________________________________________________________________________________。(4)在甲装置中,若把稀硫酸换成硫酸铜溶液,请写出铜电极的电极反应________________________________________________________________________。解析:(1)甲为原电池,乙中Zn与稀硫酸接触反应;甲中H+在铜片上得电子被还原为H2,铜片为正极,且形成原电池后产生气泡的速率比乙快;随着两烧杯中H+不断被消耗,溶液中的c(H+)均减小。(2)甲形成原电池,是将化学能转化为电能,乙主要是将化学能转化为热能。(3)锌片上产生气体,可能是由于锌片不纯,锌与杂质形成原电池。(4)若将稀硫酸换成CuSO4溶液,则铜极上会析出Cu。
答案:(1)C (2)化学 电 化学 热 (3)锌片不纯,锌与杂质形成原电池 (4)Cu2++2e-===Cu10.铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片被腐蚀,当铜片上放出3.36 L(标准状况下)气体时,硫酸恰好全部作用完。试回答:
(1)写出正极、负极反应式。
(2)产生这些气体消耗了多少克锌?
(3)有多少个电子通过了导线?
(4)原稀硫酸的物质的量浓度是多少?解析:电极反应式分别为:负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。
正极上产生H2 3.36 L,即0.15 mol时,
转移电子数为0.15 mol×2×6.02×1023 mol-1=1.806×1023。
消耗锌的质量为0.15 mol×65 g/mol=9.75 g。
消耗H+的物质的量为0.15 mol×2=0.3 mol,答案:(1)正极:2H++2e-===H2↑ 负极:Zn-2e-===Zn2+ (2)9.75 g (3)1.806×1023
(4)0.75 mol/L感谢您的使用,退出请按ESC键本小节结束
第1课时 原 电 池化学反应与能量第1课时 原 电 池格林太太是一位美丽、乐观的中年妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的,另一颗是不锈钢的。令人百思不解的是自从镶上不锈钢假牙后,格林太太经常头痛、夜间失眠、心情烦躁……医生绞尽了脑汁,格林太太的病情仍未好转。后来一位年轻的化学家来看望格林太太,并为格林太太揭开了病因。原来是两颗金属的假牙与唾液中的电解质形成了原电池,产生了微小的电流,使得格林太太头痛。
原电池是如何形成的?它需要什么条件?1.了解化学能与电能的转化关系。
2.初步了解化学电池的工作原理及应用。
3.会书写简单的电极反应式。化学能转化为电能1.一次能源和二次能源
(1)一次能源。
直接从________取得的能源,包括风力、______、潮汐、______、原煤、______、天然气、天然铀矿等。
(2)二次能源。
________经过加工、转换得到的能源,如电力、蒸汽等。自然界 流水地热 石油一次能源2.化学能与电能的相互转化
(1)燃煤发电的能量转换过程。(2)原电池。化学能 热能 机械能 电能(续上表)产生气泡 逐渐发生偏转溶液中H+在铜片上得电子生成氢原子,氢原子再结合成氢分子从铜片上逸出Zn易失电子,被氧化成Zn2+进入溶液中①定义:把__________转化为______的装置。
②构成条件:具有________________的两个电极;具有____________;电极间构成_________。
③反应本质:化学电池的反应本质是__________反应。化学能 电能活泼性不同电解质溶液 闭合回路氧化还原(3)电极方程式。
表示正、负极发生反应的方程式。如上述实验中负极方程式为:______________________;正极方程式为:________________。
(4)电极。
负极:______电子、发生______反应的电极。
正极:______电子、发生______反应的电极。得 还原Zn-2e-===Zn2+2H++2e-===H2↑失 氧化应用思考:原电池是如何构成闭合回路的?(请从电子流向和离子移动方向分析) 提示:在外电路,电子从负极流出经导线流向正极,在电解质溶液中,阳离子向正极移动,阴离子向负极移动。综合拓展一、原电池的工作原理(续上表)(续上表)特别关注:正极或负极本身都不一定发生反应。有的电池中只有负极本身反应而正极不反应;有的电池中正、负极本身都反应;有的电池中正、负极本身都不反应。二、正、负极的判断方法
1.根据电极材料判断
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
2.根据电流方向或电子流动方向来判断
在外电路(导线)上,电流由正极流向负极,电子流动方向是由负极流向正极。3.根据反应类型判断
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
4.根据现象判断
溶解的一极为负极,增重或有气泡放出的一极为正极。
特别关注:在判断原电池正、负极时,不要只根据金属活泼性的相对强弱,还要考虑电解质溶液。(1)Mg—Al和稀HCl构成原电池中,Mg作负极,Al作正极;而若把稀HCl换为NaOH溶液,Al作负极,Mg作正极。
(2)Al—Cu和NaOH溶液构成的原电池中,Al作负极;而若把NaOH溶液换为浓HNO3,Cu作负极。三、原电池原理的应用
1.比较金属活泼性
作负极的金属活泼性强,作正极的金属活泼性弱。
2.改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。3.保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀。在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
4.原电池的设计
以Zn+CuSO4===ZnSO4+Cu为例说明。特别关注:在设计原电池时,若给出的是离子反应方程式,如:Fe+Cu2+===Cu+Fe2+,此时电解质不确定为具体的物质,只要是可溶性铜盐即可,如CuCl2、CuSO4等。尝试应用1.根据Zn+2H+===Zn2++H2↑的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
A.镁 B.石墨 C.铝 D.铅解析:特别注意题干中要求选择金属材料,故先否定选项B,而A、C选项金属均比Zn活泼,故选D。
答案:D2.有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极
B.在原电池中,只有金属能作负极
C.原电池工作时,阳离子向正极方向移动
D.原电池工作时,阳离子向负极方向移动解析:A项电子在外电路由负极流向正极,B项氢氧燃料电池等选用导电碳棒作两极材料也可以。
答案:C3.关于如右图所示装置的叙述中,正确的是( )
A.铜是正极,铜片附近有气泡产生
B.铜片质量逐渐减少
C.锌是负极,锌片上有气泡产生
D.氢离子在锌片表面被还原A一、原电池的构成某活动小组设计原电池装置,你认为设计合理的是( )解析:由原电池的构成条件可知,A项中的两个电极相同,不能形成原电池;C项中没有形成闭合回路,不能形成原电池;D项中酒精为非电解质,也不能形成原电池;Fe能与CuSO4溶液反应,选B项。
答案:B
名师点睛:构成原电池的基本条件:
(1)有两个金属活动性不同的电极(金属与金属或金属与导电的非金属)。
(2)有电解质溶液。
(3)构成闭合回路。
(4)有自发的氧化还原反应发生。变式应用1.理论上不能设计成原电池的化学反应是( )
A.CH4+2O2===CO2+2H2O
B.HNO3+NaOH===NaNO3+H2O
C.2H2+O2===2H2O
D.2FeCl3+Fe===3FeCl2B二、原电池的工作原理 如右下图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
①Zn为正极,Cu为负极
②H+向负极移动
③电子是由Zn经外电路流向Cu
④Cu极上有H2产生⑤若有1 mol电子流过导线,则产生的H2为0.5 mol
⑥正极的电极反应式为Zn-2e-===Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④ 名师点睛:原电池的工作原理可用顺口溜帮助掌握:原电池分为两极;负极氧化正还原;电子由负流向正;离子阳正阴向负。变式应用2.下列装置中,导线中的电子由左边一极流向右边一极的是( )解析:C中Zn作负极,C作正极,D中Fe作负极,C作正极。其中D中发生的电极反应为:负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-。
答案:C1. 下列有关燃煤发电的一系列能量转换的过程,正确的是 ( )?
A.化学能→热能→机械能→电能?
B.热能→化学能→机械能→电能?
C.机械能→化学能→热能→电能?
D.热能→机械能→化学能→电能?水平测试C 2.某原电池的总反应的离子方程式是:Zn+Cu2+=== Zn2++Cu,此反应的原电池的正确组成是( )解析:原电池的负极发生氧化反应,其金属的还原性比正极较强,所以排除B选项,由原电池的总反应的离子方程式知电解质溶液应有Cu2+,故只有C项符合题意。
答案:C3.下列叙述中正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.在原电池中,电子流出的一极是负极,该电极得电子,被还原
C.原电池中发生氧化反应的电极是负极
D.原电池放电时,电流的方向是从负极到正极C4.在如右图所示的水果电池中,外电路上的电流从X电极流向Y电极。若X为铁,则Y可能是( )A.锌 B.石墨 C.银 D.铜解析:电流的方向与电子的移动方向相反,由已知条件知电子由Y电极移向X电极,因此Y电极的金属活动性强于铁,故Y电极只能为选项中的锌。
答案:A 5.在装有水的容器中,用棉线悬挂一个在水中保持水平的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处,如右下图所示,再向水中加入少量CuSO4溶液,经过一段时间后看到的现象是( )A.铁端将附着铜增重下沉
B.铜端将附着铜增重下沉
C.铁端粗细不变而上升
D.铜端粗细不变而下沉解析:当向水中加入CuSO4溶液后,Fe、Cu与CuSO4溶液构成了原电池。因为Fe比Cu活泼,则Fe作原电池的负极,发生反应:Fe-2e-===Fe2+,铁棒变细,而Cu作原电池的正极,发生反应:Cu2++2e-===Cu,铜端有 Cu单质析出附着在铜棒上,因此铜棒变粗,质量增大,所以铜端下沉,铁端上升。
答案:B 6.由A、B、C、D四种金属按下表中装置进行实验。根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 _________________________________________________。
(2)装置乙中正极的电极反应式是 _________________________________________________。
(3)装置丙中溶液的pH ____________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_________________________________________________。解析:据图Ⅰ知活泼性:A>B,A作负极,电极反应为A-2e-===A2+;据图Ⅱ知活泼性:B>C,正极反应为Cu2++2e-===Cu;据图Ⅲ知活泼性:D>A,正极反应为2H++2e-===H2↑,故c(H+)减小,pH增大。据Ⅰ、Ⅱ、Ⅲ知活泼性:D>A>B>C。
答案:(1)A-2e-===A2+ (2)Cu2++2e-===Cu
(3)变大 (4)D>A>B>C能力提升7.有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池。若A与B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
A.A>B>C>D B.A>C>D>B
C.C>A>D>B D.B>D>C>A解析:由组成的四个原电池可判断出A、B、C、D四种金属的活动性为①A>B,②C>D,③A>C,④D>B,因此有A>C>D>B,即B项正确。
答案:B8.(双选)(2013·四川成都模拟)下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe===3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质BD 9.分别按甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,甲中A为电流表。请回答下列问题:(1)下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液中的H+浓度均减小
D.产生气泡的速率甲比乙慢(2)甲装置中的能量转化形式:____________能转化为__________能,乙装置中的能量转化形式:____________能转化为____________能。
(3)在甲装置中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,原因可能是________________________________________________________________________________________________________________________________________________。(4)在甲装置中,若把稀硫酸换成硫酸铜溶液,请写出铜电极的电极反应________________________________________________________________________。解析:(1)甲为原电池,乙中Zn与稀硫酸接触反应;甲中H+在铜片上得电子被还原为H2,铜片为正极,且形成原电池后产生气泡的速率比乙快;随着两烧杯中H+不断被消耗,溶液中的c(H+)均减小。(2)甲形成原电池,是将化学能转化为电能,乙主要是将化学能转化为热能。(3)锌片上产生气体,可能是由于锌片不纯,锌与杂质形成原电池。(4)若将稀硫酸换成CuSO4溶液,则铜极上会析出Cu。
答案:(1)C (2)化学 电 化学 热 (3)锌片不纯,锌与杂质形成原电池 (4)Cu2++2e-===Cu10.铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片被腐蚀,当铜片上放出3.36 L(标准状况下)气体时,硫酸恰好全部作用完。试回答:
(1)写出正极、负极反应式。
(2)产生这些气体消耗了多少克锌?
(3)有多少个电子通过了导线?
(4)原稀硫酸的物质的量浓度是多少?解析:电极反应式分别为:负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。
正极上产生H2 3.36 L,即0.15 mol时,
转移电子数为0.15 mol×2×6.02×1023 mol-1=1.806×1023。
消耗锌的质量为0.15 mol×65 g/mol=9.75 g。
消耗H+的物质的量为0.15 mol×2=0.3 mol,答案:(1)正极:2H++2e-===H2↑ 负极:Zn-2e-===Zn2+ (2)9.75 g (3)1.806×1023
(4)0.75 mol/L感谢您的使用,退出请按ESC键本小节结束
