【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第二节 第2课时 化学电源(46张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第二节 第2课时 化学电源(46张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 687.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:08:08 | ||
图片预览










文档简介
课件52张PPT。第二节 化学能与电能
第2课时 化 学 电 源化学反应与能量第2课时 化 学 电 源锂离子电池的阴极材料为锂金属氧化物,具有高效率、高能量密度的特点,并具有放电电压稳定、工作温度范围宽、自放电率低、储存寿命长、无记忆效应及无公害等优点。但目前锂离子电池在大尺寸制造方面存在一定问题,过充控制的特殊封装要求高,价格昂贵,所以尚不能普遍应用。目前世界上运行的最大锂离子储能系统是A123公司投资建设的,装机容量为2兆瓦。
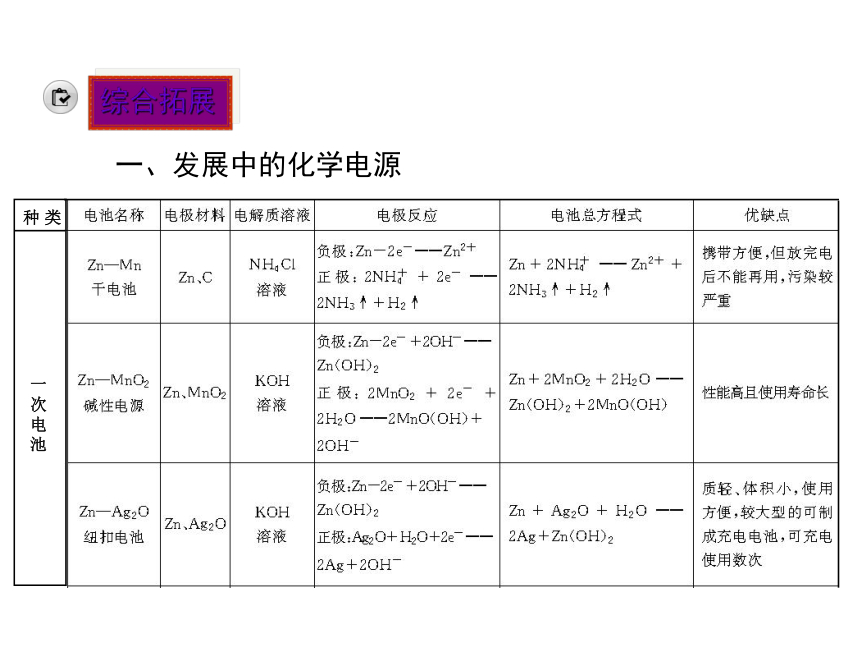
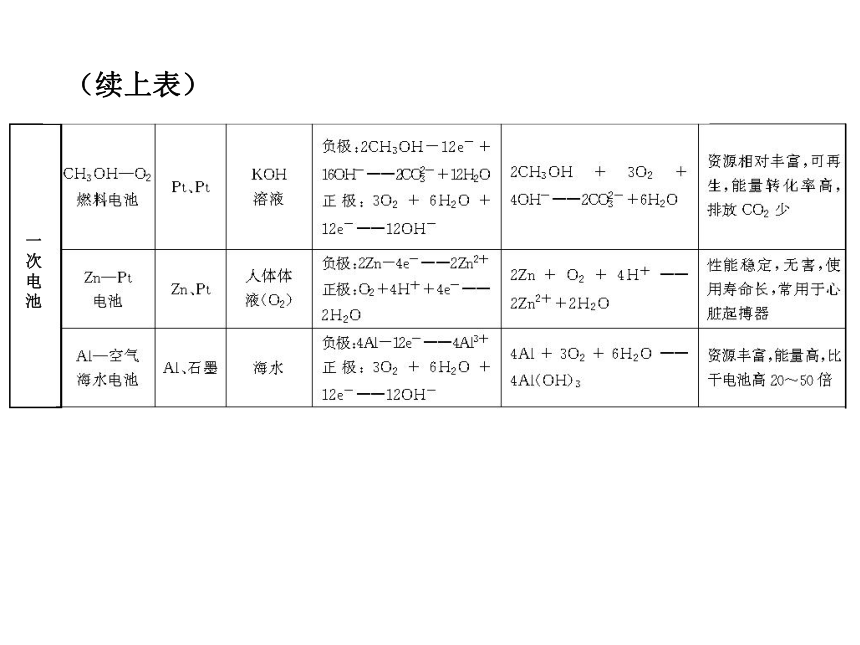
化学电池有哪些种类,他们又有什么区别呢?了解新型电池的重要性。发展中的化学电源1.干电池
干电池是一种________电池,最早使用的是________,其负极是______。为防止漏电,改良后的碱性锌锰电池将电池内的电解质__________换成湿的______。一次性 锌锰电池锌NH4Cl KOH2.充电电池
充电电池又称______电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(1)铅蓄电池。
负极材料为____,正极材料为______,电解质为______。二次Pb PbO2H2SO4(2)镍镉电池。
正极材料为________,负极材料为___,电解质为____。
(3)锂离子电池。
新一代可充电的绿色电池,低功耗电器的主流电源。NiO(OH) Cd KOH3.燃料电池
(1)原理。
利用原电池的工作原理将______和______反应所放出的化学能直接转化为电能。
(2)与其他电池的区别。
反应物不储存在__________而是由外设装备提供燃料和氧化剂。燃料 氧化剂电池内部应用思考:在锂电池中,负极为Li,那么电解质能是水溶液形式吗?提示:因为锂是活泼金属且能与水发生反应,故电解质不能是水溶液,通常为非水溶剂。综合拓展一、发展中的化学电源尝试应用1.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极解析:电池分为一次电池、二次电池和新型电池(燃料电池)。手机上用的锂离子电池可以反复充放电,属于二次电池,A选项正确。锌比铜活泼,因此构成原电池时,锌失电子作负极,电子沿外电路流向正极铜,所以B选项错误。
答案:B2.对化学电源的叙述正确的是( )
A.化学电源比火力发电对化学能的利用率高
B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C.化学电源均是安全、无污染的
D.化学电源即为可充电电池解析:化学电池对化学能有较高的利用率,但不是用电的主要渠道,化学电池对环境的污染也日益严重,化学电池分一次性、可充电两大类。
答案:A3.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞
C.石墨 D.二氧化锰解析:电池中的汞为重金属,有毒,泄漏会引发大面积水体污染和土壤污染。
答案:B 一、电极反应式的书写 (1)已知某燃料电池的总反应为2H2+O2 2H2O,则通入负极的应是________,电极方程式为__________________________,通入正极的应是________,电极方程式为________________________________________________________________________。(2)若把KOH溶液改为稀H2SO4作电解质,则电极方程式,正极:________________,负极:________________________________________________________________________。
(3)若把H2改为CH4,用KOH溶液作电解质,则电极方程式,负极:________________,正极:________________________________________________________________________。 解析:根据总反应可知,H2在反应中被氧化,应从负极通入,又因为电解质是KOH溶液,不可能生成H+,故负极反应为2H2+4OH--4e-===4H2O,正极反应为O2+2H2O+4e-===4OH-;若把KOH溶液改为稀H2SO4作电解质,溶液中不可能生成OH-,故负极反应为2H2-4e-===4H+,正极反应为O2+4H++4e-===2H2O;若把H2改为CH4,用KOH溶液作电解质,CH4被氧化,因在KOH溶液中不可能产生CO2,故生成 。 答案:(1)H2 2H2-4e-+4OH-===4H2O O2 O2+2H2O+4e-===4OH-
(2)O2+4H++4e-===2H2O 2H2-4e-===4H+
(3)CH4-8e-+10OH-=== +7H2O 2O2+4H2O+8e-===8OH-
名师点睛:解答燃料电池习题的一般步骤:
①根据化学方程式分析化合价的升高和降低,找出被氧化的物质和被还原的物质。②根据原电池负极发生氧化反应,正极发生还原反应,找出对应的负极反应物和正极反应物。
③根据化合价升高和降低分析失电子数目和得电子数目,写出电极反应。
④验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确。变式应用1.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-===Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极解析:电解质溶液显碱性或中性,该燃料电池的正极发生反应为:O2+2H2O+4e-===4OH-,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-===AlO +2H2O,B错;该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-===4AlO +2H2O,溶液pH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错。
答案:A二、发展中的化学电源 (2011年新余四中、临川二中高一联考)电子表和电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为一定浓度的KOH溶液,放电时锌极上的电极反应式为:Zn+2OH--2e-===Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-===2Ag+2OH-,总的电池反应式为:Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是( )
A.溶液中OH-向正极移动,K+、H+向负极移动B.锌发生还原反应,氧化银发生氧化反应
C.锌是负极,氧化银是正极
D.随着电极反应的不断进行,电解质溶液的碱性减弱解析:由锌极上的电极反应式可知锌的化合价升高,发生氧化反应,为负极,故B项错误,C项正确;根据电极反应式我们还可以知道,负极消耗OH-,正极产生OH-,所以OH-是向负极移动,故A项错误;随着电极反应的不断进行,电解质溶液中的水不断被消耗,KOH溶液逐渐变浓,故溶液的碱性增强,D项错误。
答案:C名师点睛:有关新型电池的考查题目在电化学试题中占有很大比例。考查角度一般有如下几点:①正、负极的判断;②正、负极反应式及电池方程式;③电解质溶液的pH变化;④电解质溶液恢复原状的措施。
在解答电解质溶液恢复原状的措施时一定要从原电池的原理入手:①负极:化合价升高,失电子,被氧化;②正极:化合价降低,得电子,被还原;③电子及电流流向;④电解质溶液复原时,要准确分析从溶液中出来了哪些原子及原子的物质的量。变式应用2.镍镉电池是一种可充电电池,其反应的化学方程式为:Cd(OH)2+Ni(OH)2 Cd+2NiO(OH)+2H2O。由此可知,该电池的负极材料是( )
A.Cd B.NiO(OH)
C.Cd(OH)2 D.Ni(OH)2解析:在判断原电池的负极材料时应看放电过程,且负极发生的是氧化反应,化合价升高,所以镍镉电池的负极材料为Cd。
答案:A水平测试1.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液解析:理论上讲,任何一个氧化还原反应都可以设计成一个原电池。从原电池总反应离子方程式上看,2Fe3++Fe===3Fe2+,Fe失去电子,作负极。因此正极为活动性比铁弱的金属或非金属(如碳棒、铂),故C项不符合此要求。Fe3+在正极上得电子,因此电解质溶液中必含Fe3+。A、B、D符合以上两个条件。
答案:C2.铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时反应为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极被氧化
B. 只向PbO2极移动C.电解液浓度不断减小
D.溶液的pH不断减小解析:放电时,Pb失电子被氧化,反应消耗H2SO4,且生成水,c(H+)下降,pH增大。
答案:C3.下列关于原电池的说法中错误的是( )
A.原电池是一种将化学能直接转化为电能的装置
B.原电池中,正极发生氧化反应
C.充电电池在充电时,将电能转化为化学能贮存在电池中
D.在燃料电池的负极上发生反应的通常是可燃性气体解析:原电池的正极上发生的是还原反应,而负极上发生的是氧化反应。
答案:B4.废旧电池处理不当不仅会造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是( )
A.把锌皮取下洗净用于实验室制氢气
B.碳棒取出洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有NH4Cl等化学物质,将废旧电池中的黑色糊状物作化肥用解析:废旧电池中含有汞、锰、镉、铅、锌等,未经处理用作肥料会对环境造成严重污染,危害人体健康。
答案:D 5.(双选题)燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能。氢氧燃料电池的基本反应是:X极: O2(g)+H2O(l)+2e-===2OH-;
Y极:H2(g)+2OH--2e-===2H2O(l)。
下列说法正确的是( )
A.X是正极 B.Y是正极
C.Y极发生还原反应 D.Y极发生氧化反应解析:从电极反应式可看出,X极发生得电子的还原反应,是正极,Y极上发生失去电子的氧化反应,是负极。
答案:AD6.我国首创的以铝—空气—海水电池为能源的新型海水标志灯已研制成功。这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源不断产生电流。只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。试推测此种新型电池可能的基本结构及电极反应式:
(1)___是负极,电极反应式为___________________。
(2)________是正极,电极反应式为______________________________。铝 4Al-12e-===4Al3+碳或铁3O2+6H2O+12e-===12OH-能力提升7.镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)(s)+2H2O 2Ni(OH)2(s)+Cd(OH)2(s)(以强碱为电解质),以下说法中正确的是( )
A.以上反应是可逆反应
B.放电时,镉为正极
C.放电时,负极附近溶液的pH不变
D.放电时,镉发生氧化反应解析:放电时,镉为负极,镉变成镉离子,结合OH-,负极附近pH降低。
答案:D8.(双选题)锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式是Li+MnO2===LiMnO2。下列说法正确的是( )
A.Li是负极,电极反应为Li-e-===Li+
B.Li是正极,电极反应为Li+e-===Li-C.MnO2是负极,电极反应为MnO2+e-===MnO
D.锂电池是一种环保型电池AD9.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为______________________________________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=== +7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一电极上的电极反应式为_____________________________________________。CH4+2O2===CO2+2H2O负极2O2+4H2O+8e-===8OH-(3)随着电池不断放电,电解质溶液的碱性________(填“增大”、“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。大于减小 10.如下图所示,组成一种原电池。试回答下列问题(灯泡功率合适):(1)若电解质溶液为稀H2SO4时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的电极反应为:__________________;Al电极上发生的电极反应为:_________________。Mg-2e-===Mg2+亮2H++2e-===H2↑ (2)若电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则Al电极上发生的电极反应为:__________________________________;Mg电极上发生的电极反应为:__________________。亮6H++6e-===3H2↑感谢您的使用,退出请按ESC键本小节结束
第2课时 化 学 电 源化学反应与能量第2课时 化 学 电 源锂离子电池的阴极材料为锂金属氧化物,具有高效率、高能量密度的特点,并具有放电电压稳定、工作温度范围宽、自放电率低、储存寿命长、无记忆效应及无公害等优点。但目前锂离子电池在大尺寸制造方面存在一定问题,过充控制的特殊封装要求高,价格昂贵,所以尚不能普遍应用。目前世界上运行的最大锂离子储能系统是A123公司投资建设的,装机容量为2兆瓦。
化学电池有哪些种类,他们又有什么区别呢?了解新型电池的重要性。发展中的化学电源1.干电池
干电池是一种________电池,最早使用的是________,其负极是______。为防止漏电,改良后的碱性锌锰电池将电池内的电解质__________换成湿的______。一次性 锌锰电池锌NH4Cl KOH2.充电电池
充电电池又称______电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态。
(1)铅蓄电池。
负极材料为____,正极材料为______,电解质为______。二次Pb PbO2H2SO4(2)镍镉电池。
正极材料为________,负极材料为___,电解质为____。
(3)锂离子电池。
新一代可充电的绿色电池,低功耗电器的主流电源。NiO(OH) Cd KOH3.燃料电池
(1)原理。
利用原电池的工作原理将______和______反应所放出的化学能直接转化为电能。
(2)与其他电池的区别。
反应物不储存在__________而是由外设装备提供燃料和氧化剂。燃料 氧化剂电池内部应用思考:在锂电池中,负极为Li,那么电解质能是水溶液形式吗?提示:因为锂是活泼金属且能与水发生反应,故电解质不能是水溶液,通常为非水溶剂。综合拓展一、发展中的化学电源尝试应用1.下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极解析:电池分为一次电池、二次电池和新型电池(燃料电池)。手机上用的锂离子电池可以反复充放电,属于二次电池,A选项正确。锌比铜活泼,因此构成原电池时,锌失电子作负极,电子沿外电路流向正极铜,所以B选项错误。
答案:B2.对化学电源的叙述正确的是( )
A.化学电源比火力发电对化学能的利用率高
B.化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C.化学电源均是安全、无污染的
D.化学电源即为可充电电池解析:化学电池对化学能有较高的利用率,但不是用电的主要渠道,化学电池对环境的污染也日益严重,化学电池分一次性、可充电两大类。
答案:A3.废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌 B.汞
C.石墨 D.二氧化锰解析:电池中的汞为重金属,有毒,泄漏会引发大面积水体污染和土壤污染。
答案:B 一、电极反应式的书写 (1)已知某燃料电池的总反应为2H2+O2 2H2O,则通入负极的应是________,电极方程式为__________________________,通入正极的应是________,电极方程式为________________________________________________________________________。(2)若把KOH溶液改为稀H2SO4作电解质,则电极方程式,正极:________________,负极:________________________________________________________________________。
(3)若把H2改为CH4,用KOH溶液作电解质,则电极方程式,负极:________________,正极:________________________________________________________________________。 解析:根据总反应可知,H2在反应中被氧化,应从负极通入,又因为电解质是KOH溶液,不可能生成H+,故负极反应为2H2+4OH--4e-===4H2O,正极反应为O2+2H2O+4e-===4OH-;若把KOH溶液改为稀H2SO4作电解质,溶液中不可能生成OH-,故负极反应为2H2-4e-===4H+,正极反应为O2+4H++4e-===2H2O;若把H2改为CH4,用KOH溶液作电解质,CH4被氧化,因在KOH溶液中不可能产生CO2,故生成 。 答案:(1)H2 2H2-4e-+4OH-===4H2O O2 O2+2H2O+4e-===4OH-
(2)O2+4H++4e-===2H2O 2H2-4e-===4H+
(3)CH4-8e-+10OH-=== +7H2O 2O2+4H2O+8e-===8OH-
名师点睛:解答燃料电池习题的一般步骤:
①根据化学方程式分析化合价的升高和降低,找出被氧化的物质和被还原的物质。②根据原电池负极发生氧化反应,正极发生还原反应,找出对应的负极反应物和正极反应物。
③根据化合价升高和降低分析失电子数目和得电子数目,写出电极反应。
④验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确。变式应用1.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-===Al(OH)3↓C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极解析:电解质溶液显碱性或中性,该燃料电池的正极发生反应为:O2+2H2O+4e-===4OH-,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-===AlO +2H2O,B错;该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-===4AlO +2H2O,溶液pH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错。
答案:A二、发展中的化学电源 (2011年新余四中、临川二中高一联考)电子表和电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为一定浓度的KOH溶液,放电时锌极上的电极反应式为:Zn+2OH--2e-===Zn(OH)2;氧化银电极上的反应式为:Ag2O+H2O+2e-===2Ag+2OH-,总的电池反应式为:Ag2O+H2O+Zn===Zn(OH)2+2Ag。下列说法正确的是( )
A.溶液中OH-向正极移动,K+、H+向负极移动B.锌发生还原反应,氧化银发生氧化反应
C.锌是负极,氧化银是正极
D.随着电极反应的不断进行,电解质溶液的碱性减弱解析:由锌极上的电极反应式可知锌的化合价升高,发生氧化反应,为负极,故B项错误,C项正确;根据电极反应式我们还可以知道,负极消耗OH-,正极产生OH-,所以OH-是向负极移动,故A项错误;随着电极反应的不断进行,电解质溶液中的水不断被消耗,KOH溶液逐渐变浓,故溶液的碱性增强,D项错误。
答案:C名师点睛:有关新型电池的考查题目在电化学试题中占有很大比例。考查角度一般有如下几点:①正、负极的判断;②正、负极反应式及电池方程式;③电解质溶液的pH变化;④电解质溶液恢复原状的措施。
在解答电解质溶液恢复原状的措施时一定要从原电池的原理入手:①负极:化合价升高,失电子,被氧化;②正极:化合价降低,得电子,被还原;③电子及电流流向;④电解质溶液复原时,要准确分析从溶液中出来了哪些原子及原子的物质的量。变式应用2.镍镉电池是一种可充电电池,其反应的化学方程式为:Cd(OH)2+Ni(OH)2 Cd+2NiO(OH)+2H2O。由此可知,该电池的负极材料是( )
A.Cd B.NiO(OH)
C.Cd(OH)2 D.Ni(OH)2解析:在判断原电池的负极材料时应看放电过程,且负极发生的是氧化反应,化合价升高,所以镍镉电池的负极材料为Cd。
答案:A水平测试1.某原电池总反应的离子方程式为2Fe3++Fe===3Fe2+,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液
D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3溶液解析:理论上讲,任何一个氧化还原反应都可以设计成一个原电池。从原电池总反应离子方程式上看,2Fe3++Fe===3Fe2+,Fe失去电子,作负极。因此正极为活动性比铁弱的金属或非金属(如碳棒、铂),故C项不符合此要求。Fe3+在正极上得电子,因此电解质溶液中必含Fe3+。A、B、D符合以上两个条件。
答案:C2.铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时反应为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极被氧化
B. 只向PbO2极移动C.电解液浓度不断减小
D.溶液的pH不断减小解析:放电时,Pb失电子被氧化,反应消耗H2SO4,且生成水,c(H+)下降,pH增大。
答案:C3.下列关于原电池的说法中错误的是( )
A.原电池是一种将化学能直接转化为电能的装置
B.原电池中,正极发生氧化反应
C.充电电池在充电时,将电能转化为化学能贮存在电池中
D.在燃料电池的负极上发生反应的通常是可燃性气体解析:原电池的正极上发生的是还原反应,而负极上发生的是氧化反应。
答案:B4.废旧电池处理不当不仅会造成浪费,还会对环境造成严重污染,对人体健康也存在极大的危害。有同学想变废为宝,他的以下想法你认为不正确的是( )
A.把锌皮取下洗净用于实验室制氢气
B.碳棒取出洗净用作电极
C.把铜帽取下洗净回收利用
D.电池内部填有NH4Cl等化学物质,将废旧电池中的黑色糊状物作化肥用解析:废旧电池中含有汞、锰、镉、铅、锌等,未经处理用作肥料会对环境造成严重污染,危害人体健康。
答案:D 5.(双选题)燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能。氢氧燃料电池的基本反应是:X极: O2(g)+H2O(l)+2e-===2OH-;
Y极:H2(g)+2OH--2e-===2H2O(l)。
下列说法正确的是( )
A.X是正极 B.Y是正极
C.Y极发生还原反应 D.Y极发生氧化反应解析:从电极反应式可看出,X极发生得电子的还原反应,是正极,Y极上发生失去电子的氧化反应,是负极。
答案:AD6.我国首创的以铝—空气—海水电池为能源的新型海水标志灯已研制成功。这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源不断产生电流。只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍。试推测此种新型电池可能的基本结构及电极反应式:
(1)___是负极,电极反应式为___________________。
(2)________是正极,电极反应式为______________________________。铝 4Al-12e-===4Al3+碳或铁3O2+6H2O+12e-===12OH-能力提升7.镍镉电池在通讯、交通及日常生活中有着广泛的应用,其工作原理可以表示为:Cd+2NiO(OH)(s)+2H2O 2Ni(OH)2(s)+Cd(OH)2(s)(以强碱为电解质),以下说法中正确的是( )
A.以上反应是可逆反应
B.放电时,镉为正极
C.放电时,负极附近溶液的pH不变
D.放电时,镉发生氧化反应解析:放电时,镉为负极,镉变成镉离子,结合OH-,负极附近pH降低。
答案:D8.(双选题)锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应式是Li+MnO2===LiMnO2。下列说法正确的是( )
A.Li是负极,电极反应为Li-e-===Li+
B.Li是正极,电极反应为Li+e-===Li-C.MnO2是负极,电极反应为MnO2+e-===MnO
D.锂电池是一种环保型电池AD9.燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为______________________________________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=== +7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一电极上的电极反应式为_____________________________________________。CH4+2O2===CO2+2H2O负极2O2+4H2O+8e-===8OH-(3)随着电池不断放电,电解质溶液的碱性________(填“增大”、“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。大于减小 10.如下图所示,组成一种原电池。试回答下列问题(灯泡功率合适):(1)若电解质溶液为稀H2SO4时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则Mg电极上发生的电极反应为:__________________;Al电极上发生的电极反应为:_________________。Mg-2e-===Mg2+亮2H++2e-===H2↑ (2)若电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”)。若灯泡亮,则Al电极上发生的电极反应为:__________________________________;Mg电极上发生的电极反应为:__________________。亮6H++6e-===3H2↑感谢您的使用,退出请按ESC键本小节结束
