【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第三节 第1课时 化学反应的速率(56张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第三节 第1课时 化学反应的速率(56张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 714.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:08:33 | ||
图片预览









文档简介
课件56张PPT。第三节 化学反应的速率和限度
第1课时 化学反应的速率化学反应与能量第1课时 化学反应的速率有些化学反应如煤炭窑内的瓦斯爆炸,反应迅速,破坏能力强。而山东境内的沂源溶洞群风景区,号称“北国第一洞群”。其中“养神洞”以各路神仙由玉皇大帝率领云游四海在此歇息的传说而得名,全长800余米,为分支型洞穴,洞下有洞,洞中有洞,洞内有石林叠瀑、雄狮把门、唐僧取经、王母宫、水族宫等48处景观,这样的景观需要数十万年,甚至百万年才能形成。可见化学反应也有快慢之分。怎样表示化学反应速率?影响化学反应速率的因素有哪些?1.了解化学反应速率的含义及其表示方法。
2.了解影响化学反应速率的因素。
3.初步了解控制化学反应速率的方法。化学反应速率1.意义:表示化学反应_____________的物理量。
2.定义:单位时间内____________的减少量或____________的增加量。
3.表达式:____________________。
4.单位:mol/(L·min)或mol/(L·s)。生成物浓度进行快慢程度反应物浓度应用思考:1.对于反应A(g)+B(s)===2C(g)能否用B物质表示该反应的反应速率?为什么? 2.单位时间内,反应物消耗的物质的量越多,是不是反应速率越快?提示:不能,因为B物质为固体,其浓度为常数,故不能用固体表示反应速率。 提示:不一定。反应物物质的量消耗多,浓度变化不一定大。影响化学反应速率的条件1.外界条件对化学反应速率影响的实验探究
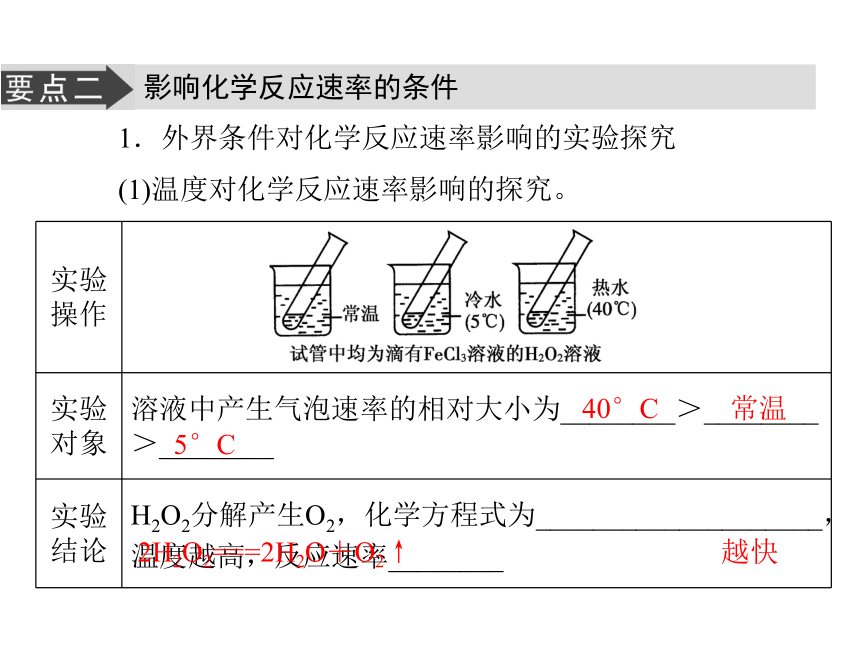
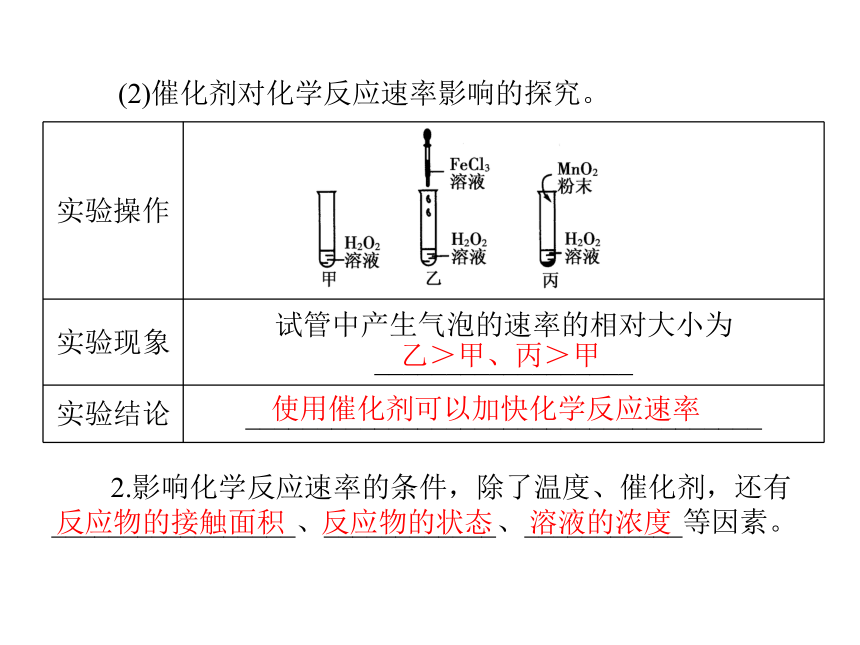
(1)温度对化学反应速率影响的探究。40°C 常温5°C2H2O2===2H2O+O2↑ 越快(2)催化剂对化学反应速率影响的探究。2.影响化学反应速率的条件,除了温度、催化剂,还有_________________、____________、___________等因素。乙>甲、丙>甲使用催化剂可以加快化学反应速率反应物的接触面积 反应物的状态 溶液的浓度应用思考:3.把形状、大小相同的锌粒分别投入到10 mL 1 mol/L的盐酸和20 mL 1 mol/L的盐酸中,哪个反应速率较快?提示:一样快,锌和盐酸反应速率的大小与锌粒的表面积大小和盐酸的浓度大小有关,而与锌粒的多少和盐酸量的多少无关。一、对化学反应速率的理解
1.化学反应速率反映了化学反应进行的快慢,只取正值,不取负值。
2.化学反应速率通常是指在某一段时间内的平均反应速率,而不是某一时刻的瞬时反应速率。
3.在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为不变的常数,因此不能选用固体或纯液体物质来表示化学反应速率。综合拓展4.同一化学反应,用不同的反应物或生成物的浓度的变化量来表示化学反应速率时,数值可能不同,但表示的意义相同。
5.各物质表示的化学反应速率之比等于该反应方程式中各物质的化学计量数之比,也等于各物质的浓度变化量之比。对反应aA+bB===cC+dD(A、B、C、D均不是固态或纯液态),有v(A):v(B):v(C):v(D)=a:b:c:d。特别关注:判断化学反应进行快慢的常用方法:
(1)同一化学反应,用不同物质的浓度变化表示的化学反应速率的数值可能不同。要比较反应速率的大小,可将用不同物质表示的反应速率换算为用同一物质表示的反应速率,再比较速率数值的大小,数值大的,反应速率就快,数值小的,反应速率就慢。
(2)对于相同条件下的不同反应,根据反应的活泼性比较化学反应的快慢。(3)对不同条件下的同一化学反应,根据外部条件对化学反应速率影响的规律比较化学反应速率的快慢。
(4)对相同条件下的同一化学反应,根据能否构成原电池判断化学反应的快慢。 二、影响化学反应速率的因素(续上表)尝试应用1.(双选题)下列有关化学反应速率的描述中,错误的是( )
A.是描述化学反应快慢的物理量
B.可用单位时间内反应物浓度的减少或生成物浓度的增加来表示
C.在同一化学反应中,各物质的速率可能不相同,因此用不同物质来表示的化学反应的速率也不同
D.化学反应速率可以用固体物质来表示解析:在同一化学反应中,用不同物质来表示的化学反应的速率可能不同,但是意义相同,故C项错误;固体反应时没有浓度的变化,不能用以表示化学反应速率。
答案:CD2.反应4A(s)+3B(g)===2C(g)+D(g),经2 min后B的浓度减少0.6 mol/L。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol/(L·min)
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2 min末的反应速率用B表示是0.3 mol/(L·min)
D.在这2 min内B和C的物质的量都是逐渐减少的解析:A为固体,一般不用固体表示反应速率,所以A项错误;同一反应中,用不同物质表示的速率与化学方程式中各物质的化学计量数成正比,故B项正确;反应速率为平均值,并非2 min末的速率,所以C项错误;B为反应物,而C为生成物,两者不可能同时减少,故D项错误。
答案:B3.把铝条放入盛有过量稀盐酸的试管中,不影响产生氢气速率的因素是( )
A.盐酸的浓度 B.铝条的接触面积
C.溶液的温度 D.加少量Na2SO4解析:加入Na2SO4,即加入Na+和 ,对化学反应2Al+6H+===2Al3++3H2↑没有影响。
答案:D一、化学反应速率的有关计算 已知某反应的各物质的量浓度数据如下:
aA(g)+bB(g)?? cC(g)
起始浓度/(mol·L-1) 3.0 1.0 0
2 s末浓度/(mol·L-1) 1.8 0.6 0.8(1)据此可推算出上述方程式中各物质的化学计量数之比是( )
A.9:3:4 B.3:1:2
C.2:1:3 D.3:2:1
(2)v(A)=________。解析:(1) aA(g)+bB(g) cC(g)
c(初)/(mol·L-1) 3.0 1.0 0
Δc/(mol·L-1) 1.2 0.4 0.8c(末)/(mol·L-1) 1.8 0.6 0.8
所以各物质的化学计量数之比为1.20.40.8=3:1:2,B项正确。答案:(1)B (2)0.6 mol·(L·s)-1
名师点睛:应用“三段法”进行有关化学反应速率的计算。(1)计算原理:化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比。
(2)计算模式:设A、B两物质的起始浓度分别为a mol·L-1、b mol·L-1,反应物A的转化浓度为mx mol·L-1,B的转化浓度为nx mol·L-1,则
mA(g)+nB(g) pC(g)+qD(g)起始浓度/(mol·L-1) a b 0 0
变化浓度/(mol·L-1) mx nx px qx
终态浓度/(mol·L-1) a-mx b-nx px qx变式应用1.氨气的分解反应在容积为2 L的密闭容器内进行。已知氨气的物质的量起始时为4 mol,5 s末为2.4 mol,则用氮气表示该反应的速率为( )
A.0.32 mol·(L·s)-1
B.0.16 mol·(L·s)-1
C.1.6 mol·(L·s)-1
D.0.08 mol·(L·s)-1D二、影响化学反应速率的因素 (双选题)下列措施对增大化学反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe 与硫酸反应制取H2时,选用浓硫酸
C.两支试管中分别加入相同浓度的过氧化氢溶液,其中一支试管中再加入二氧化锰制取氧气
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉解析:固体或纯液体的量对化学反应速率无影响,故A项错误;Fe遇浓硫酸会钝化,不产生氢气,B项错误;MnO2作催化剂能加快过氧化氢的分解(氧气的产生)速率,C项正确;将铝片改成铝粉能增大与氧气的接触面积,化学反应速率增大,D项正确。
答案:CD
名师点睛:影响化学反应速率的主要因素是反应物本身的性质,同时,也受外因的影响。中学阶段主要研究浓度、温度、压强等外因对化学反应速率的影响。变式应用2.(2011年山东临沂模拟)少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸④加CH3COONa固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10 mL 0.1 mol·L-1盐酸
A.①⑥⑦ B.③⑤⑦ C.③⑥⑦ D.⑤⑥⑦解析:该反应的本质是:Fe+2H+===Fe2++H2↑,所以要加快反应速率同时不改变H2的产量可以采取升高温度、增大H+浓度、增大接触面积、使用催化剂等措施。加入浓HNO3虽然增大了H+浓度,但Fe与HNO3反应不会产生H2,会使H2的量减少;Na+与Cl-不参与反应,故加NaCl固体对反应速率无影响。
答案:C水平测试1.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)解析:由化学反应速率的意义可知,同一反应在同一时刻用不同物质表示时,各物质的速率之比等于化学计量数之比,故C项正确。
答案:C2.在相同条件下,等质量(金属颗粒大小相当)的不同金属与足量1 mol/L盐酸反应时,反应速率最快的是( )
A.镁 B.铝 C.钠 D.铁解析:影响化学反应速率的内因是反应物本身的性质,钠是四种金属中最活泼的,它与盐酸的反应速率最快。
答案:C3.反应2SO2+O2 2SO3经过一段时间后,SO3的浓度增加了0.4 mol·L-1, 在这段时间内用O2表示的反应速率为 0.04 mol·L-1·s-1,则这段时间为 ( )
A.0.1 s B.2.5 s?
C.5 s D.10 s?C解析:A为固体,一般不用固体表示化学反应速率,因为固体的浓度一般视为常数,A项错误;在同一反应中,不同物质表示的化学反应速率的比值等于它们的化学计量数之比,B项正确;v(B)=0.3 mol·(L·min)-1为平均值并非2 min末的速率,C项错误;B为反应物,则C为生成物,两者不可能同时减小,D项错误。
答案:B4.常温下,分别将四块形状相同,质量均为7 g的铁块同时投入下列四种溶液中,铁块首先溶解完的是( )
A.250.0 mL 2 mol·L-1HCl溶液
B.150.0 mL 2 mol·L-1H2SO4溶液
C.500.0 mL 3 mol·L-1HCl溶液
D.20.0 mL 18 mol·L-1H2SO4溶液解析:浓硫酸使铁块钝化;A、B、C项中H+都过量,H+浓度越大,反应越快。
答案:B5.把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生反应:3X(g)+Y(g)??nZ(g)+2W(g)。在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示的平均速率为0.01 mol·L-1·min-1,则在上述反应中Z气体的化学计量数n的值为( )
A.1 B.2 C.3 D.4解析:经计算生成0.1 mol Z,根据同一反应中,物质的反应速率之比等于其化学计量数之比推知n=1。
答案:A6.在下列事实中,什么因素影响了化学反应的速率?
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:________________________________________________________________________。
(2)黄铁矿煅烧时要粉碎成细小的矿粒:________________________________________________________________________。(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2:________________________________________________________________________。
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:________________________________________________________________________。(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:________________________________________________________________________。
(6)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速率不同:________________________________________________________________________。(7)夏天的食品易变霉,冬天就不易发生该现象:________________________________________________________________________。
(8)葡萄糖在空气中燃烧时需要较高的温度,可是在人体里,在正常体温(37℃)时,就可以被氧化,这是因为________________________________________________________________________________________________________________________________________________。解析:本题考查的是影响化学反应速率的因素,用事实加以说明。
答案:(1)光 (2)反应物的接触面积 (3)在溶液中,水作溶剂,增大了反应物的接触面 (4)催化剂 (5)反应物本身的性质 (6)反应物的浓度 (7)反应温度 (8)在人体里的生物酶起到了催化作用,降低了葡萄糖发生氧化反应时所需要的能量能力提升7.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)??2NO2(g),若N2O4的浓度由0.1 mol/L 降到0.07 mol/L需要15 s,那么N2O4的浓度由0.07 mol/L 降到0.05 mol/L所需反应的时间( )
A.等于5 s B.等于10 s
C.大于10 s D.小于10 s解析:化学反应不是匀速反应,随着反应的不断进行,反应物不断消耗,化学反应速率会逐渐变小。前15 s N2O4的浓度变化了0.03 mol/L,平均每5 s变化0.01 mol/L,则按此速率计算c(N2O4)再减少0.02 mol/L需10 s,显然实际时间应多于10 s。
答案:C8.反应A+3B 2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·s-1
该反应进行的快慢顺序为____________。9.将4 mol A气体和2 mol B气体在2 L密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)??2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则:
(1)用物质A表示的反应速率为________________________________________________________________________。
(2)2 s时物质A的转化率是________________________________________________________________________。(3)2 s时物质B的浓度为________________________________________________________________________。
(4)反应过程中容器内气体的平均相对分子质量如何变化?____________(填“增大”、“减小”或“不变”,下同)。气体的密度如何变化?________。解析: 2A(g)+B(g)??2C(g)
c(初)/(mol·L-1) 2 1 0
Δc/(mol·L-1) 0.6 0.3 0.6
c(末)/(mol·L-1) 1.4 0.7 0.6回答下列问题:
(1)该实验的目的是__________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40°C下进行编号③对应浓度的实验,显色时间t2的范围为________。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断29.3 sA(4)通过分析比较上表数据,得到的结论是________________________________________________________________________________________________________。反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)感谢您的使用,退出请按ESC键本小节结束
第1课时 化学反应的速率化学反应与能量第1课时 化学反应的速率有些化学反应如煤炭窑内的瓦斯爆炸,反应迅速,破坏能力强。而山东境内的沂源溶洞群风景区,号称“北国第一洞群”。其中“养神洞”以各路神仙由玉皇大帝率领云游四海在此歇息的传说而得名,全长800余米,为分支型洞穴,洞下有洞,洞中有洞,洞内有石林叠瀑、雄狮把门、唐僧取经、王母宫、水族宫等48处景观,这样的景观需要数十万年,甚至百万年才能形成。可见化学反应也有快慢之分。怎样表示化学反应速率?影响化学反应速率的因素有哪些?1.了解化学反应速率的含义及其表示方法。
2.了解影响化学反应速率的因素。
3.初步了解控制化学反应速率的方法。化学反应速率1.意义:表示化学反应_____________的物理量。
2.定义:单位时间内____________的减少量或____________的增加量。
3.表达式:____________________。
4.单位:mol/(L·min)或mol/(L·s)。生成物浓度进行快慢程度反应物浓度应用思考:1.对于反应A(g)+B(s)===2C(g)能否用B物质表示该反应的反应速率?为什么? 2.单位时间内,反应物消耗的物质的量越多,是不是反应速率越快?提示:不能,因为B物质为固体,其浓度为常数,故不能用固体表示反应速率。 提示:不一定。反应物物质的量消耗多,浓度变化不一定大。影响化学反应速率的条件1.外界条件对化学反应速率影响的实验探究
(1)温度对化学反应速率影响的探究。40°C 常温5°C2H2O2===2H2O+O2↑ 越快(2)催化剂对化学反应速率影响的探究。2.影响化学反应速率的条件,除了温度、催化剂,还有_________________、____________、___________等因素。乙>甲、丙>甲使用催化剂可以加快化学反应速率反应物的接触面积 反应物的状态 溶液的浓度应用思考:3.把形状、大小相同的锌粒分别投入到10 mL 1 mol/L的盐酸和20 mL 1 mol/L的盐酸中,哪个反应速率较快?提示:一样快,锌和盐酸反应速率的大小与锌粒的表面积大小和盐酸的浓度大小有关,而与锌粒的多少和盐酸量的多少无关。一、对化学反应速率的理解
1.化学反应速率反映了化学反应进行的快慢,只取正值,不取负值。
2.化学反应速率通常是指在某一段时间内的平均反应速率,而不是某一时刻的瞬时反应速率。
3.在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为不变的常数,因此不能选用固体或纯液体物质来表示化学反应速率。综合拓展4.同一化学反应,用不同的反应物或生成物的浓度的变化量来表示化学反应速率时,数值可能不同,但表示的意义相同。
5.各物质表示的化学反应速率之比等于该反应方程式中各物质的化学计量数之比,也等于各物质的浓度变化量之比。对反应aA+bB===cC+dD(A、B、C、D均不是固态或纯液态),有v(A):v(B):v(C):v(D)=a:b:c:d。特别关注:判断化学反应进行快慢的常用方法:
(1)同一化学反应,用不同物质的浓度变化表示的化学反应速率的数值可能不同。要比较反应速率的大小,可将用不同物质表示的反应速率换算为用同一物质表示的反应速率,再比较速率数值的大小,数值大的,反应速率就快,数值小的,反应速率就慢。
(2)对于相同条件下的不同反应,根据反应的活泼性比较化学反应的快慢。(3)对不同条件下的同一化学反应,根据外部条件对化学反应速率影响的规律比较化学反应速率的快慢。
(4)对相同条件下的同一化学反应,根据能否构成原电池判断化学反应的快慢。 二、影响化学反应速率的因素(续上表)尝试应用1.(双选题)下列有关化学反应速率的描述中,错误的是( )
A.是描述化学反应快慢的物理量
B.可用单位时间内反应物浓度的减少或生成物浓度的增加来表示
C.在同一化学反应中,各物质的速率可能不相同,因此用不同物质来表示的化学反应的速率也不同
D.化学反应速率可以用固体物质来表示解析:在同一化学反应中,用不同物质来表示的化学反应的速率可能不同,但是意义相同,故C项错误;固体反应时没有浓度的变化,不能用以表示化学反应速率。
答案:CD2.反应4A(s)+3B(g)===2C(g)+D(g),经2 min后B的浓度减少0.6 mol/L。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol/(L·min)
B.用B、C、D分别表示反应的速率,其比值是3:2:1
C.在2 min末的反应速率用B表示是0.3 mol/(L·min)
D.在这2 min内B和C的物质的量都是逐渐减少的解析:A为固体,一般不用固体表示反应速率,所以A项错误;同一反应中,用不同物质表示的速率与化学方程式中各物质的化学计量数成正比,故B项正确;反应速率为平均值,并非2 min末的速率,所以C项错误;B为反应物,而C为生成物,两者不可能同时减少,故D项错误。
答案:B3.把铝条放入盛有过量稀盐酸的试管中,不影响产生氢气速率的因素是( )
A.盐酸的浓度 B.铝条的接触面积
C.溶液的温度 D.加少量Na2SO4解析:加入Na2SO4,即加入Na+和 ,对化学反应2Al+6H+===2Al3++3H2↑没有影响。
答案:D一、化学反应速率的有关计算 已知某反应的各物质的量浓度数据如下:
aA(g)+bB(g)?? cC(g)
起始浓度/(mol·L-1) 3.0 1.0 0
2 s末浓度/(mol·L-1) 1.8 0.6 0.8(1)据此可推算出上述方程式中各物质的化学计量数之比是( )
A.9:3:4 B.3:1:2
C.2:1:3 D.3:2:1
(2)v(A)=________。解析:(1) aA(g)+bB(g) cC(g)
c(初)/(mol·L-1) 3.0 1.0 0
Δc/(mol·L-1) 1.2 0.4 0.8c(末)/(mol·L-1) 1.8 0.6 0.8
所以各物质的化学计量数之比为1.20.40.8=3:1:2,B项正确。答案:(1)B (2)0.6 mol·(L·s)-1
名师点睛:应用“三段法”进行有关化学反应速率的计算。(1)计算原理:化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比。
(2)计算模式:设A、B两物质的起始浓度分别为a mol·L-1、b mol·L-1,反应物A的转化浓度为mx mol·L-1,B的转化浓度为nx mol·L-1,则
mA(g)+nB(g) pC(g)+qD(g)起始浓度/(mol·L-1) a b 0 0
变化浓度/(mol·L-1) mx nx px qx
终态浓度/(mol·L-1) a-mx b-nx px qx变式应用1.氨气的分解反应在容积为2 L的密闭容器内进行。已知氨气的物质的量起始时为4 mol,5 s末为2.4 mol,则用氮气表示该反应的速率为( )
A.0.32 mol·(L·s)-1
B.0.16 mol·(L·s)-1
C.1.6 mol·(L·s)-1
D.0.08 mol·(L·s)-1D二、影响化学反应速率的因素 (双选题)下列措施对增大化学反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe 与硫酸反应制取H2时,选用浓硫酸
C.两支试管中分别加入相同浓度的过氧化氢溶液,其中一支试管中再加入二氧化锰制取氧气
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉解析:固体或纯液体的量对化学反应速率无影响,故A项错误;Fe遇浓硫酸会钝化,不产生氢气,B项错误;MnO2作催化剂能加快过氧化氢的分解(氧气的产生)速率,C项正确;将铝片改成铝粉能增大与氧气的接触面积,化学反应速率增大,D项正确。
答案:CD
名师点睛:影响化学反应速率的主要因素是反应物本身的性质,同时,也受外因的影响。中学阶段主要研究浓度、温度、压强等外因对化学反应速率的影响。变式应用2.(2011年山东临沂模拟)少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸④加CH3COONa固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10 mL 0.1 mol·L-1盐酸
A.①⑥⑦ B.③⑤⑦ C.③⑥⑦ D.⑤⑥⑦解析:该反应的本质是:Fe+2H+===Fe2++H2↑,所以要加快反应速率同时不改变H2的产量可以采取升高温度、增大H+浓度、增大接触面积、使用催化剂等措施。加入浓HNO3虽然增大了H+浓度,但Fe与HNO3反应不会产生H2,会使H2的量减少;Na+与Cl-不参与反应,故加NaCl固体对反应速率无影响。
答案:C水平测试1.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)解析:由化学反应速率的意义可知,同一反应在同一时刻用不同物质表示时,各物质的速率之比等于化学计量数之比,故C项正确。
答案:C2.在相同条件下,等质量(金属颗粒大小相当)的不同金属与足量1 mol/L盐酸反应时,反应速率最快的是( )
A.镁 B.铝 C.钠 D.铁解析:影响化学反应速率的内因是反应物本身的性质,钠是四种金属中最活泼的,它与盐酸的反应速率最快。
答案:C3.反应2SO2+O2 2SO3经过一段时间后,SO3的浓度增加了0.4 mol·L-1, 在这段时间内用O2表示的反应速率为 0.04 mol·L-1·s-1,则这段时间为 ( )
A.0.1 s B.2.5 s?
C.5 s D.10 s?C解析:A为固体,一般不用固体表示化学反应速率,因为固体的浓度一般视为常数,A项错误;在同一反应中,不同物质表示的化学反应速率的比值等于它们的化学计量数之比,B项正确;v(B)=0.3 mol·(L·min)-1为平均值并非2 min末的速率,C项错误;B为反应物,则C为生成物,两者不可能同时减小,D项错误。
答案:B4.常温下,分别将四块形状相同,质量均为7 g的铁块同时投入下列四种溶液中,铁块首先溶解完的是( )
A.250.0 mL 2 mol·L-1HCl溶液
B.150.0 mL 2 mol·L-1H2SO4溶液
C.500.0 mL 3 mol·L-1HCl溶液
D.20.0 mL 18 mol·L-1H2SO4溶液解析:浓硫酸使铁块钝化;A、B、C项中H+都过量,H+浓度越大,反应越快。
答案:B5.把0.6 mol X气体和0.4 mol Y气体混合于2 L容器中,使它们发生反应:3X(g)+Y(g)??nZ(g)+2W(g)。在5 min时已经生成0.2 mol W,若测知以Z的浓度变化表示的平均速率为0.01 mol·L-1·min-1,则在上述反应中Z气体的化学计量数n的值为( )
A.1 B.2 C.3 D.4解析:经计算生成0.1 mol Z,根据同一反应中,物质的反应速率之比等于其化学计量数之比推知n=1。
答案:A6.在下列事实中,什么因素影响了化学反应的速率?
(1)集气瓶中有H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸:________________________________________________________________________。
(2)黄铁矿煅烧时要粉碎成细小的矿粒:________________________________________________________________________。(3)KI晶体和HgCl2晶体混合后无明显现象,若一起投入水中,很快生成红色HgI2:________________________________________________________________________。
(4)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体:________________________________________________________________________。(5)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢:________________________________________________________________________。
(6)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速率不同:________________________________________________________________________。(7)夏天的食品易变霉,冬天就不易发生该现象:________________________________________________________________________。
(8)葡萄糖在空气中燃烧时需要较高的温度,可是在人体里,在正常体温(37℃)时,就可以被氧化,这是因为________________________________________________________________________________________________________________________________________________。解析:本题考查的是影响化学反应速率的因素,用事实加以说明。
答案:(1)光 (2)反应物的接触面积 (3)在溶液中,水作溶剂,增大了反应物的接触面 (4)催化剂 (5)反应物本身的性质 (6)反应物的浓度 (7)反应温度 (8)在人体里的生物酶起到了催化作用,降低了葡萄糖发生氧化反应时所需要的能量能力提升7.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)??2NO2(g),若N2O4的浓度由0.1 mol/L 降到0.07 mol/L需要15 s,那么N2O4的浓度由0.07 mol/L 降到0.05 mol/L所需反应的时间( )
A.等于5 s B.等于10 s
C.大于10 s D.小于10 s解析:化学反应不是匀速反应,随着反应的不断进行,反应物不断消耗,化学反应速率会逐渐变小。前15 s N2O4的浓度变化了0.03 mol/L,平均每5 s变化0.01 mol/L,则按此速率计算c(N2O4)再减少0.02 mol/L需10 s,显然实际时间应多于10 s。
答案:C8.反应A+3B 2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·s-1
该反应进行的快慢顺序为____________。9.将4 mol A气体和2 mol B气体在2 L密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)??2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,则:
(1)用物质A表示的反应速率为________________________________________________________________________。
(2)2 s时物质A的转化率是________________________________________________________________________。(3)2 s时物质B的浓度为________________________________________________________________________。
(4)反应过程中容器内气体的平均相对分子质量如何变化?____________(填“增大”、“减小”或“不变”,下同)。气体的密度如何变化?________。解析: 2A(g)+B(g)??2C(g)
c(初)/(mol·L-1) 2 1 0
Δc/(mol·L-1) 0.6 0.3 0.6
c(末)/(mol·L-1) 1.4 0.7 0.6回答下列问题:
(1)该实验的目的是__________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40°C下进行编号③对应浓度的实验,显色时间t2的范围为________。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断29.3 sA(4)通过分析比较上表数据,得到的结论是________________________________________________________________________________________________________。反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)感谢您的使用,退出请按ESC键本小节结束
