【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第三节 第2课时 化学反应的限度(56张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第二章第三节 第2课时 化学反应的限度(56张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 830.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:09:31 | ||
图片预览









文档简介
课件56张PPT。第三节 化学反应的速率和限度
第2课时 化学反应的限度化学反应与能量第2课时 化学反应的限度 人类对粮食的需求使人工固氮在19世纪初成了世界性的重大研究课题。不少化学家耗费了相当大的精力,但仍未掌握一种较理想的人工固氮方法,主要困难是氮气和氢气非常难反应,反应速率特别慢,且氮气的转化率非常低。1909年德国科学家哈伯在实验室采用600 ℃、200个大气压和用金属铁作催化剂的条件使人工固氮成功,1918年瑞典皇家科学院因哈伯在合成氨发明上的杰出贡献,决定授予他诺贝尔化学奖。1.认识可逆反应及其特征。
2.了解并会判断化学平衡状态。
3.初步了解化学反应条件的控制。化学反应的限度1.可逆反应
(1)定义:在同一条件下__________和__________均能进行的化学反应。
(2)表示。
书写可逆反应的化学方程式时不用“===”而用“______”。
(3)特点。正反应方向 逆反应方向正、逆反应是在__________下______进行的。
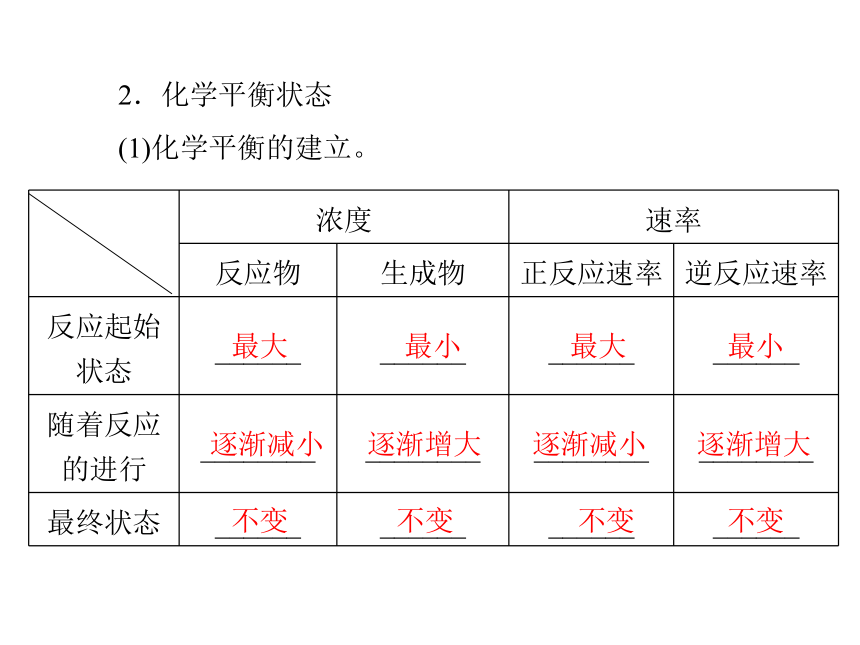
②共存性:________和______同时存在,反应不能进行彻底。同一条件 同时反应物 生成物2.化学平衡状态
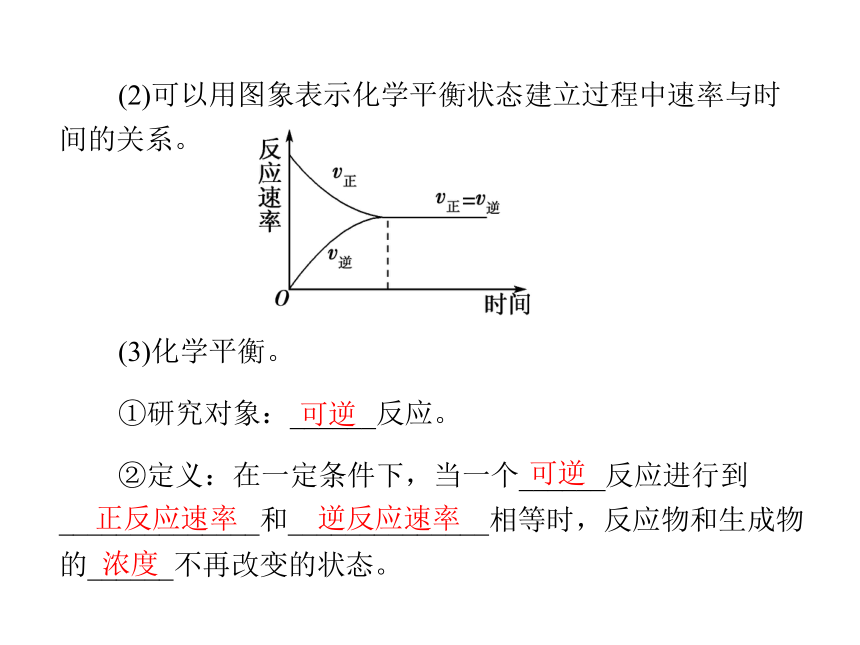
(1)化学平衡的建立。最大 最小 最大 最小逐渐减小 逐渐增大 逐渐减小 逐渐增大不变 不变 不变 不变(2)可以用图象表示化学平衡状态建立过程中速率与时间的关系。(3)化学平衡。
①研究对象:______反应。
②定义:在一定条件下,当一个______反应进行到______________和______________相等时,反应物和生成物的______不再改变的状态。浓度可逆可逆正反应速率 逆反应速率应用思考:1.(1)2H2+O2 2H2O和2H2O 2H2↑+O2↑属于可逆反应吗? (2)把3 mol H2和1 mol N2充入密闭容器中反应,最终可以生成2 mol NH3吗?提示:(1)二者不属于可逆反应,因为可逆反应是在相同条件下进行的,而上述两个反应的反应条件不同。
(2)可逆反应不能进行彻底,故不能生成2 mol NH3。 2.可逆反应在一定条件下达到化学平衡状态,此时反应物的转化率最大吗?提示:可逆反应在一定条件下达到化学平衡状态后,反应物的量不再随时间的变化而变化,因此反应物的转化率达最大值,且保持不变。化学反应条件的控制原料的利用率
反应速率反应速率
有害物质的产生2.燃料燃烧的条件
(1)燃料与____________接触,且空气要________。
(2)温度达到燃料的______。
3.提高燃料燃烧效率的措施
(1)尽可能使燃料________提高能量的转化率。关键是燃料与空气或氧气尽可能_________,且空气要________。
(2)尽可能充分地利用燃料燃烧所释放出的热能,提高____________。热能的利用率空气或氧气 适当过量着火点充分燃烧充分接触 适当过量应用思考:3.结合燃料燃烧的条件分析灭火的措施有哪些?提示:隔绝空气、降低火焰的温度。综合拓展一、化学反应的限度——化学平衡状态的特征
1.逆:化学平衡研究的对象是可逆反应。
2.等:达到平衡状态时,正反应速率和逆反应速率相等,但不等于零,即v正=v逆≠0。
3.动:是指动态平衡。达到平衡状态时,正、逆反应仍在不断进行,只是v正=v逆而已。4.定:平衡时,各组分的浓度保持一定,各组成成分的含量保持一定。
5.变:当外界条件(如浓度、压强、温度等)变化时,则原平衡被破坏,反应混合物中各组分的浓度就会发生变化,在新的条件下会重新建立平衡。二、化学平衡状态的判断
判断一个可逆反应在一定条件下是否达到化学反应的限度或化学平衡状态,直接依据就是其本质和特征,即正、逆反应速率是否相等;各组分浓度是否不变,含量是否不变。
通常从如下几个方面进行判断:(续上表)(续上表)三、控制化学反应条件的基本措施
1.通过改变反应体系的温度、溶液的浓度、固体的表面积、反应物的状态以及催化剂的使用等,改变化学反应速率。
2.通过改变可逆反应体系的温度、溶液的浓度、气体压强等,改变可逆反应进行的限度。尝试应用1.可逆反应达到平衡的重要特征是( )
A.反应停止了
B.正、逆反应的速率都为0
C.正、逆反应都还在继续进行
D.正、逆反应的速率相等D2.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)解析:达到化学平衡状态时,正、逆反应速率相等,用NH3、H2、N2表示的化学反应速率之比等于它们的化学计量数之比。结合这两个条件,可以得出答案为C。
答案:C3.下列措施可以提高燃料的燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理
A.①③④⑤ B.②③⑤
C.③④⑤ D.①②③④C一、可逆反应的特点 (双选题)在密闭容器中发生反应X(g)+3Y(g)??2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,则平衡时各物质的浓度可能是( )
A.X为0.2 mol·L-1
B.Y为0.1 mol·L-1
C.Z为0.3 mol·L-1
D.Z为0.1 mol·L-1时,Y为0.4 mol·L-1解析:化学反应的限度决定了可逆反应中的各种成分是不能完全转化的。所以平衡时各物质的浓度范围为0<c(X)<0.2 mol·L-1,0<c(Y)<0.6 mol·L-1,0<c(Z)<0.4 mol·L-1。而当c(Z)=0.1 mol·L-1时,c(Y)=0.45 mol·L-1。
答案:BC
名师点睛:(1)可逆反应既可向正反应方向进行,同时又可向逆反应方向进行;可逆反应不能进行到底,只能反应到一定程度达到平衡状态,平衡时各物质的物质的量都不能为0。 (2)化学反应是有限度的,可逆反应不能进行到底。化学反应遵循质量守恒定律。变式应用1.在一密闭容器中进行反应:2SO2(g)+O2(g)??2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是 ( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1解析:化学反应的限度决定了可逆反应中的各种成分是不可能完全转化的,所以平衡时各物质的浓度范围为0<c(SO2)<0.4 mol·L-1,0<c(O2)<0.2 mol·L-1,0<c(SO3)<0.4 mol·L-1,因此A、C错误;对于D项,若SO2为0.15 mol·L-1,则转化的SO2的浓度为(0.2-0.15) mol·L-1=0.05 mol·L-1,此时SO3的浓度为(0.2+0.05)mol·L-1=0.25 mol·L-1,故D错误。本题选B。
答案:B二、化学平衡的特征及判断依据 可逆反应2NO2(g)??2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①用NO2、NO、O2表示的反应速率之比为2:2:1
②混合气体的颜色不再改变
③混合气体的密度不再改变
④混合气体的压强不再改变
⑤混合气体的平均相对分子质量不再改变
A.②④⑤ B.①③⑤ C.①②⑤ D.全部解析:可逆反应无论达到平衡与否,各物质化学反应速率之比都等于化学计量数之比,①错误;有色气体的颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡,②正确;体积固定,反应前后物质质量守恒,密度始终不变,③错误;反应前后气体体积不等,当压强不变时,意味着各物质的含量不再变化,④正确;由于气体的质量不变,则气体的平均相对分子质量不变时,气体中各物质的物质的量不变,说明反应达到平衡,⑤正确。
答案:A名师点睛:在解决化学平衡的特征问题时,要看清反应条件是恒温恒容还是恒温恒压、化学方程式中气体的前后化学计量数是否相等、是否有非气态物质参与。化学平衡状态的判断依据:
(1)v正=v逆。
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的且前后化学计量数改变的可逆反应,压强保持不变。(4)全是气体参加的且前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对于有颜色的气体参加或生成的可逆反应,颜色不随着时间发生变化。
(6)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。变式应用2.下列方法中可以证明2HI(g)??H2(g)+I2(g)一定达到平衡状态的是________。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③HI的体积分数与I2的体积分数相等
④反应速率v(H2)=v(I2)= v(HI)
⑤v(HI):v(H2):v(I2)=2:1:1⑥温度和体积一定时,某一生成物的浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化解析:注意化学平衡状态的实质是正、逆反应速率相等,要仔细分析各项叙述中的反应速率。①中正、逆反应速率不相等,④、⑤是相同的,都指的是单向反应速率,故均不正确。平衡时,各物质的浓度或百分含量保持不变,并不一定相等,故③不正确。该反应前后气体分子数不变,故压强、相对分子质量、气体密度均不随反应的进行而改变,⑦、⑧、⑩均不正确。各气体中只有I2有颜色,反应进行时,随I2的浓度改变,颜色会发生改变,颜色不再改变时,说明已达平衡,故②、⑥、⑨正确。
答案:②⑥⑨水平测试1.N2+3H2 2NH3在密闭容器中反应一段时间后,达到限度。则下列说法中正确的是( )
A.N2、H2不再化合
B.N2、H2、NH3浓度不再变化
C.N2、H2、NH3的质量相等
D.改变条件,N2、H2、NH3的浓度也不再变化B2.(双选题)下列关于化学反应限度的说法正确的是( )
A.一个可逆反应达到的平衡状态,就是这个反应所能达到的限度
B.当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变AB3.一定温度下,向a L密闭容器中加入2 mol NO2(g),发生反应:2NO2??2NO+O2,此反应达到平衡状态时的标志是( )
A.混合气体的颜色变浅
B.混合气体的密度不再变化
C.混合气中NO2、NO、O2物质的量之比为2:2:1
D.单位时间内生成2n mol NO,同时生成2n mol NO2解析:颜色变浅,说明反应还在由左向右进行,没有达到平衡,A错;体积一定,气体密度不论反应是否平衡均为定值,B错;物质的量之比等于化学计量数之比不能说明各组分浓度已保持恒定,更不能说明v正=v逆,C错;D能表明v正=v逆,正确。
答案:D4.(双选题)下列说法可以证明反应N2+3H2??2NH3已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—N键断裂
C.1个N≡N键断裂的同时,有6个H—N键断裂
D.1个N≡N键断裂的同时,有6个H—N键形成解析:根据化学平衡的定义,当一个可逆反应达到平衡时,v正=v逆,同时各物质的质量分数保持不变,从本质上来讲反应虽然仍在进行,但各物质的绝对量不再变化,我们就称为达到平衡状态。对此题关键要分清谁表示v正,谁表示v逆。例如,1个N≡N键断裂,即表示反应要向正反应方向进行,生成NH3即为v正;而6个N—H键断裂表示反应要向逆反应方向进行,生成N2,表示v逆。根据同一反应中,用不同的物质来表示反应的速率,若正、逆反应速率之比等于化学方程式各物质的化学计量数之比,反应亦达到平衡。
答案:AC5.(双选题)下列说法正确的是( )
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后燃烧效果好
D.固体煤变为气体燃料后,燃烧效率将更低BC6.某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如右图所示,由图中数据分析求:
(1)该反应的化学方程式为__________________________________。(2)反应开始至4 min时,A的平均反应速率为_______________。
(3)4 min时,正、逆反应速率的大小关系为:v正____(填“>”、“<”或“=”,下同)v逆,8 min时,v正_____v逆。=0.05 mol/(L·min)>3A 2B能力提升7.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述中正确的是( )A.反应的化学方程式为:2M??N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍答案:D8.一定条件下,可逆反应X(g)+3Y(g)??2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol·L-19.在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应放出热量。反应中变化的情况如右上图所示。
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。CO2的浓度随时间A.CO减少的化学反应速率和CO2减少的化学反应速率相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为零(2)判断该反应达到平衡的依据是________。 10.在2 L密闭容器内,800℃时反应2NO(g)+O2(g)??2NO2(g)体系中,n(NO)随时间的变化如下表: (1)上述反应____________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为____________。(2)如右图所示,表示NO2变化曲线的是____________。用O2表示从0~2 s内该反应的平均速率v=________。(3)能说明该反应已达到平衡状态的是____________ 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变 (3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是反应前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡,容器内密度总保持不变,故d项无法说明该反应是否达到平衡状态。
答案:(1)是 65%
(2)b 1.5×10-3mol/(L·s) (3)b、c感谢您的使用,退出请按ESC键本小节结束
第2课时 化学反应的限度化学反应与能量第2课时 化学反应的限度 人类对粮食的需求使人工固氮在19世纪初成了世界性的重大研究课题。不少化学家耗费了相当大的精力,但仍未掌握一种较理想的人工固氮方法,主要困难是氮气和氢气非常难反应,反应速率特别慢,且氮气的转化率非常低。1909年德国科学家哈伯在实验室采用600 ℃、200个大气压和用金属铁作催化剂的条件使人工固氮成功,1918年瑞典皇家科学院因哈伯在合成氨发明上的杰出贡献,决定授予他诺贝尔化学奖。1.认识可逆反应及其特征。
2.了解并会判断化学平衡状态。
3.初步了解化学反应条件的控制。化学反应的限度1.可逆反应
(1)定义:在同一条件下__________和__________均能进行的化学反应。
(2)表示。
书写可逆反应的化学方程式时不用“===”而用“______”。
(3)特点。正反应方向 逆反应方向正、逆反应是在__________下______进行的。
②共存性:________和______同时存在,反应不能进行彻底。同一条件 同时反应物 生成物2.化学平衡状态
(1)化学平衡的建立。最大 最小 最大 最小逐渐减小 逐渐增大 逐渐减小 逐渐增大不变 不变 不变 不变(2)可以用图象表示化学平衡状态建立过程中速率与时间的关系。(3)化学平衡。
①研究对象:______反应。
②定义:在一定条件下,当一个______反应进行到______________和______________相等时,反应物和生成物的______不再改变的状态。浓度可逆可逆正反应速率 逆反应速率应用思考:1.(1)2H2+O2 2H2O和2H2O 2H2↑+O2↑属于可逆反应吗? (2)把3 mol H2和1 mol N2充入密闭容器中反应,最终可以生成2 mol NH3吗?提示:(1)二者不属于可逆反应,因为可逆反应是在相同条件下进行的,而上述两个反应的反应条件不同。
(2)可逆反应不能进行彻底,故不能生成2 mol NH3。 2.可逆反应在一定条件下达到化学平衡状态,此时反应物的转化率最大吗?提示:可逆反应在一定条件下达到化学平衡状态后,反应物的量不再随时间的变化而变化,因此反应物的转化率达最大值,且保持不变。化学反应条件的控制原料的利用率
反应速率反应速率
有害物质的产生2.燃料燃烧的条件
(1)燃料与____________接触,且空气要________。
(2)温度达到燃料的______。
3.提高燃料燃烧效率的措施
(1)尽可能使燃料________提高能量的转化率。关键是燃料与空气或氧气尽可能_________,且空气要________。
(2)尽可能充分地利用燃料燃烧所释放出的热能,提高____________。热能的利用率空气或氧气 适当过量着火点充分燃烧充分接触 适当过量应用思考:3.结合燃料燃烧的条件分析灭火的措施有哪些?提示:隔绝空气、降低火焰的温度。综合拓展一、化学反应的限度——化学平衡状态的特征
1.逆:化学平衡研究的对象是可逆反应。
2.等:达到平衡状态时,正反应速率和逆反应速率相等,但不等于零,即v正=v逆≠0。
3.动:是指动态平衡。达到平衡状态时,正、逆反应仍在不断进行,只是v正=v逆而已。4.定:平衡时,各组分的浓度保持一定,各组成成分的含量保持一定。
5.变:当外界条件(如浓度、压强、温度等)变化时,则原平衡被破坏,反应混合物中各组分的浓度就会发生变化,在新的条件下会重新建立平衡。二、化学平衡状态的判断
判断一个可逆反应在一定条件下是否达到化学反应的限度或化学平衡状态,直接依据就是其本质和特征,即正、逆反应速率是否相等;各组分浓度是否不变,含量是否不变。
通常从如下几个方面进行判断:(续上表)(续上表)三、控制化学反应条件的基本措施
1.通过改变反应体系的温度、溶液的浓度、固体的表面积、反应物的状态以及催化剂的使用等,改变化学反应速率。
2.通过改变可逆反应体系的温度、溶液的浓度、气体压强等,改变可逆反应进行的限度。尝试应用1.可逆反应达到平衡的重要特征是( )
A.反应停止了
B.正、逆反应的速率都为0
C.正、逆反应都还在继续进行
D.正、逆反应的速率相等D2.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2)
B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3)
D.v正(N2)=3v逆(H2)解析:达到化学平衡状态时,正、逆反应速率相等,用NH3、H2、N2表示的化学反应速率之比等于它们的化学计量数之比。结合这两个条件,可以得出答案为C。
答案:C3.下列措施可以提高燃料的燃烧效率的是( )
①提高燃料的着火点 ②降低燃料的着火点 ③将固体燃料粉碎 ④将液体燃料雾化 ⑤将煤气化处理
A.①③④⑤ B.②③⑤
C.③④⑤ D.①②③④C一、可逆反应的特点 (双选题)在密闭容器中发生反应X(g)+3Y(g)??2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.2 mol·L-1,则平衡时各物质的浓度可能是( )
A.X为0.2 mol·L-1
B.Y为0.1 mol·L-1
C.Z为0.3 mol·L-1
D.Z为0.1 mol·L-1时,Y为0.4 mol·L-1解析:化学反应的限度决定了可逆反应中的各种成分是不能完全转化的。所以平衡时各物质的浓度范围为0<c(X)<0.2 mol·L-1,0<c(Y)<0.6 mol·L-1,0<c(Z)<0.4 mol·L-1。而当c(Z)=0.1 mol·L-1时,c(Y)=0.45 mol·L-1。
答案:BC
名师点睛:(1)可逆反应既可向正反应方向进行,同时又可向逆反应方向进行;可逆反应不能进行到底,只能反应到一定程度达到平衡状态,平衡时各物质的物质的量都不能为0。 (2)化学反应是有限度的,可逆反应不能进行到底。化学反应遵循质量守恒定律。变式应用1.在一密闭容器中进行反应:2SO2(g)+O2(g)??2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当反应达到平衡时,可能存在的数据是 ( )
A.SO2为0.4 mol·L-1,O2为0.2 mol·L-1
B.SO2为0.25 mol·L-1
C.SO3为0.4 mol·L-1
D.SO2、SO3均为0.15 mol·L-1解析:化学反应的限度决定了可逆反应中的各种成分是不可能完全转化的,所以平衡时各物质的浓度范围为0<c(SO2)<0.4 mol·L-1,0<c(O2)<0.2 mol·L-1,0<c(SO3)<0.4 mol·L-1,因此A、C错误;对于D项,若SO2为0.15 mol·L-1,则转化的SO2的浓度为(0.2-0.15) mol·L-1=0.05 mol·L-1,此时SO3的浓度为(0.2+0.05)mol·L-1=0.25 mol·L-1,故D错误。本题选B。
答案:B二、化学平衡的特征及判断依据 可逆反应2NO2(g)??2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( )
①用NO2、NO、O2表示的反应速率之比为2:2:1
②混合气体的颜色不再改变
③混合气体的密度不再改变
④混合气体的压强不再改变
⑤混合气体的平均相对分子质量不再改变
A.②④⑤ B.①③⑤ C.①②⑤ D.全部解析:可逆反应无论达到平衡与否,各物质化学反应速率之比都等于化学计量数之比,①错误;有色气体的颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡,②正确;体积固定,反应前后物质质量守恒,密度始终不变,③错误;反应前后气体体积不等,当压强不变时,意味着各物质的含量不再变化,④正确;由于气体的质量不变,则气体的平均相对分子质量不变时,气体中各物质的物质的量不变,说明反应达到平衡,⑤正确。
答案:A名师点睛:在解决化学平衡的特征问题时,要看清反应条件是恒温恒容还是恒温恒压、化学方程式中气体的前后化学计量数是否相等、是否有非气态物质参与。化学平衡状态的判断依据:
(1)v正=v逆。
(2)体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
(3)全是气体参加的且前后化学计量数改变的可逆反应,压强保持不变。(4)全是气体参加的且前后化学计量数改变的可逆反应,平均相对分子质量保持不变。
(5)对于有颜色的气体参加或生成的可逆反应,颜色不随着时间发生变化。
(6)对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。变式应用2.下列方法中可以证明2HI(g)??H2(g)+I2(g)一定达到平衡状态的是________。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③HI的体积分数与I2的体积分数相等
④反应速率v(H2)=v(I2)= v(HI)
⑤v(HI):v(H2):v(I2)=2:1:1⑥温度和体积一定时,某一生成物的浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化解析:注意化学平衡状态的实质是正、逆反应速率相等,要仔细分析各项叙述中的反应速率。①中正、逆反应速率不相等,④、⑤是相同的,都指的是单向反应速率,故均不正确。平衡时,各物质的浓度或百分含量保持不变,并不一定相等,故③不正确。该反应前后气体分子数不变,故压强、相对分子质量、气体密度均不随反应的进行而改变,⑦、⑧、⑩均不正确。各气体中只有I2有颜色,反应进行时,随I2的浓度改变,颜色会发生改变,颜色不再改变时,说明已达平衡,故②、⑥、⑨正确。
答案:②⑥⑨水平测试1.N2+3H2 2NH3在密闭容器中反应一段时间后,达到限度。则下列说法中正确的是( )
A.N2、H2不再化合
B.N2、H2、NH3浓度不再变化
C.N2、H2、NH3的质量相等
D.改变条件,N2、H2、NH3的浓度也不再变化B2.(双选题)下列关于化学反应限度的说法正确的是( )
A.一个可逆反应达到的平衡状态,就是这个反应所能达到的限度
B.当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变AB3.一定温度下,向a L密闭容器中加入2 mol NO2(g),发生反应:2NO2??2NO+O2,此反应达到平衡状态时的标志是( )
A.混合气体的颜色变浅
B.混合气体的密度不再变化
C.混合气中NO2、NO、O2物质的量之比为2:2:1
D.单位时间内生成2n mol NO,同时生成2n mol NO2解析:颜色变浅,说明反应还在由左向右进行,没有达到平衡,A错;体积一定,气体密度不论反应是否平衡均为定值,B错;物质的量之比等于化学计量数之比不能说明各组分浓度已保持恒定,更不能说明v正=v逆,C错;D能表明v正=v逆,正确。
答案:D4.(双选题)下列说法可以证明反应N2+3H2??2NH3已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—N键断裂
C.1个N≡N键断裂的同时,有6个H—N键断裂
D.1个N≡N键断裂的同时,有6个H—N键形成解析:根据化学平衡的定义,当一个可逆反应达到平衡时,v正=v逆,同时各物质的质量分数保持不变,从本质上来讲反应虽然仍在进行,但各物质的绝对量不再变化,我们就称为达到平衡状态。对此题关键要分清谁表示v正,谁表示v逆。例如,1个N≡N键断裂,即表示反应要向正反应方向进行,生成NH3即为v正;而6个N—H键断裂表示反应要向逆反应方向进行,生成N2,表示v逆。根据同一反应中,用不同的物质来表示反应的速率,若正、逆反应速率之比等于化学方程式各物质的化学计量数之比,反应亦达到平衡。
答案:AC5.(双选题)下列说法正确的是( )
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后燃烧效果好
D.固体煤变为气体燃料后,燃烧效率将更低BC6.某温度时,在2 L密闭容器中某一反应的A、B物质的量随时间变化的曲线如右图所示,由图中数据分析求:
(1)该反应的化学方程式为__________________________________。(2)反应开始至4 min时,A的平均反应速率为_______________。
(3)4 min时,正、逆反应速率的大小关系为:v正____(填“>”、“<”或“=”,下同)v逆,8 min时,v正_____v逆。=0.05 mol/(L·min)>3A 2B能力提升7.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示,下列表述中正确的是( )A.反应的化学方程式为:2M??N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍答案:D8.一定条件下,可逆反应X(g)+3Y(g)??2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是( )
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol·L-19.在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g),反应放出热量。反应中变化的情况如右上图所示。
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速率为________;反应平衡时c(H2)=________。CO2的浓度随时间A.CO减少的化学反应速率和CO2减少的化学反应速率相等
B.CO、H2O、CO2、H2的浓度都相等
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.正、逆反应速率都为零(2)判断该反应达到平衡的依据是________。 10.在2 L密闭容器内,800℃时反应2NO(g)+O2(g)??2NO2(g)体系中,n(NO)随时间的变化如下表: (1)上述反应____________(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为____________。(2)如右图所示,表示NO2变化曲线的是____________。用O2表示从0~2 s内该反应的平均速率v=________。(3)能说明该反应已达到平衡状态的是____________ 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变 (3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是反应前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡,容器内密度总保持不变,故d项无法说明该反应是否达到平衡状态。
答案:(1)是 65%
(2)b 1.5×10-3mol/(L·s) (3)b、c感谢您的使用,退出请按ESC键本小节结束
