【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第三章第三节 第1课时 乙醇(51张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第三章第三节 第1课时 乙醇(51张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 800.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 08:14:16 | ||
图片预览








文档简介
课件61张PPT。第三节 生活中两种常见的有机物
第1课时 乙 醇有机化合物第1课时 乙 醇日本一家名为“日本食粮”的公司最近研究出了利用生活垃圾和农业废弃物制造乙醇的方法,用它生产的乙醇成本仅为现有同类产品的一半,而且生产效率比较高。
据悉,这家公司采用了日本森林综合研究所开发的臭氧处理法来分解旧报纸、纸制容器、废木材等垃圾,以及树皮、稻草等农业废弃物,并用一种特殊的酶把其中的纤维素转化成为葡萄糖,进而再使用酵母发酵、成熟、蒸馏,制造乙醇。这种技术生产效率颇高,10吨垃圾可制造2.5吨乙醇,价格比现在市场上销售的工业乙醇要便宜一半。生产乙醇剩下的残渣还能够用作园艺材料。因此可以说,这是一种“零排放”技术。
乙醇既是一种重要化工原料,又是一种比较优良的燃料,它有哪些性质呢?1.了解烃的衍生物和官能团的概念。
2.了解乙醇的主要用途。
3.掌握乙醇的组成、主要性质。
4.了解乙醇与人类日常生活与健康的知识。
5.初步学会分析官能团与性质关系的方法。烃的衍生物1.烃的衍生物
烃分子中的______被其他原子或原子团所取代而生成的一系列化合物。
2.官能团
(1)定义。
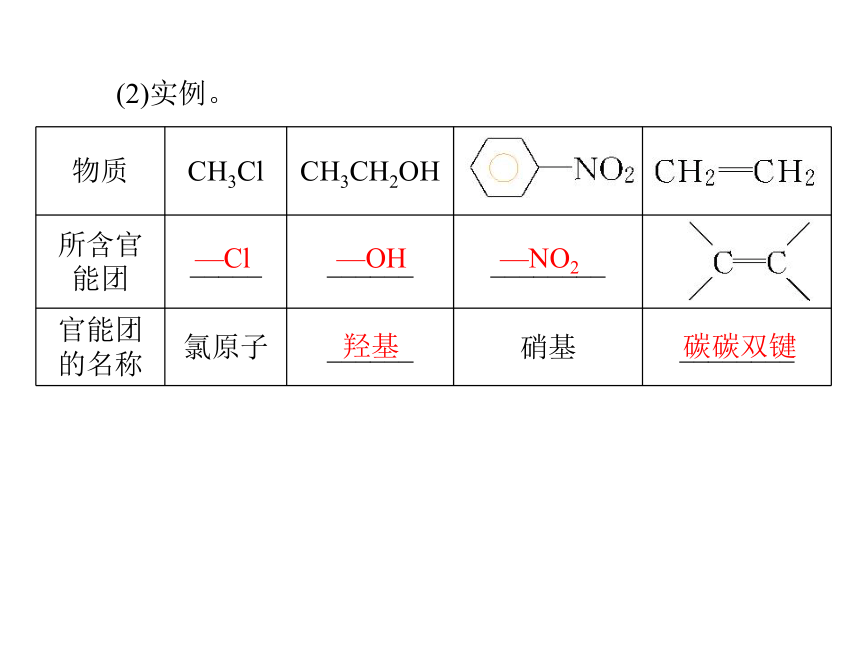
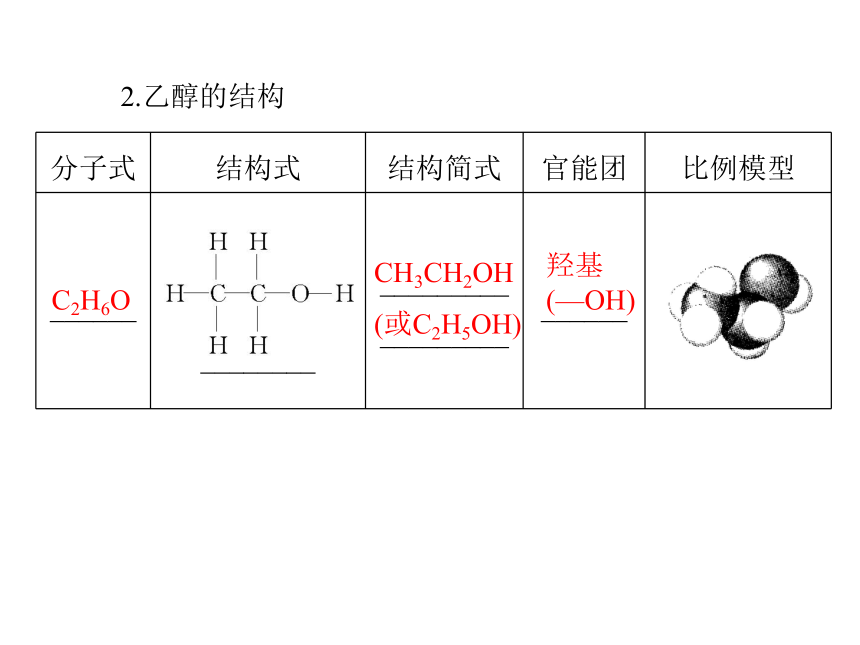
决定有机化合物_________的原子或原子团。氢原子化学特性 (2)实例。—Cl —OH —NO2羟基 碳碳双键乙醇1.物理性质无特殊香液小以任意比混溶易易2.乙醇的结构C2H6O羟基(—OH)CH3CH2OH(或C2H5OH)3.化学性质
(1)与钠反应。__________________________________________________。
(2)氧化反应。
①燃烧。
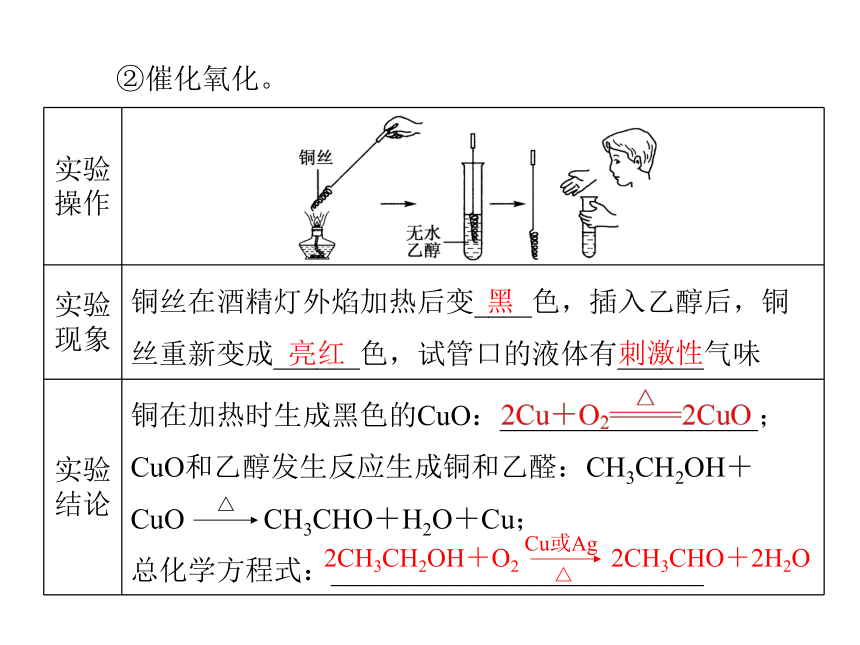
乙醇在空气中燃烧,发出______色火焰,并放出大量的热:______________________________________________。2CH3CH2OH+2Na 2CH3CH2ONa+H2↑淡蓝 ②催化氧化。亮红 刺激性黑③与强氧化剂反应。CH3COOH应用思考:1.能否用分液的方法分离酒精与水的混合物?如何制取无水酒精呢?2.制得的无水酒精真的“无水”吗?如何进行检验?提示:不能,因为乙醇与水互溶,形成混合溶液,不分层。加入CaO,再加热蒸馏。提示:可以取少量无水酒精,加入无水硫酸铜固体,若固体变蓝,则含有水分;若不变蓝,则不含有水分。综合拓展一、乙醇的性质与结构
1.乙醇的性质与键的断裂2.乙醇催化氧化的实质总反应方程式为2CH3CH2OH+O2 2CH3CHO+2H2O,反应中Cu作催化剂。
特别关注:(1)醇催化氧化的条件:与羟基相连的碳原子上有氢原子。
(2)醇发生催化氧化时,由于分子中去掉了2个氢原子,相应的氧化产物的相对分子质量比醇小2。 二、钠分别与水、乙醇反应的比较特别关注:(1)密度关系。
金属钠与乙醇反应时钠沉在乙醇的底部,而与水反应时浮在水面上,说明三者的密度关系为:水>钠>乙醇。
(2)氢原子的活泼性。
钠和乙醇反应时没有熔化成小球,也没有发出声响。这说明水分子中的氢原子相对更活泼,而乙醇分子羟基中的氢原子相对不活泼。(3)数量关系。
1 mol乙醇跟足量钠反应,产生0.5 mol氢气。该关系可以延伸为1 mol羟基跟足量钠反应,产生0.5 mol氢气。
(4)金属钠与乙醇和水的混合物反应。
把金属钠放入乙醇和水的混合物中,钠先和水反应,再和乙醇反应,据此可以除去乙醇中少量的水。尝试应用1.下列关于乙醇的说法不正确的是( )
A.乙醇易挥发
B.是无色透明、有特殊香味的液体
C.密度比水小,沸点比水高
D.乙醇不能用于萃取碘水中的碘C2.(2011年湖北宜昌联考)下列物质不能从溴水中萃取溴的是( )
A.乙醇 B.苯
C.四氯化碳 D.戊烷解析:萃取剂必须具备3个条件:①与原溶剂互不相溶;②溶质在其中的溶解度比在原溶剂中的溶解度大;③萃取剂与溶质不反应。乙醇与水互溶,A项错误。
答案:A3.苯中混有乙醇杂质,除去乙醇的方法是( )
A.加热蒸发 B.过滤
C.加水、萃取、分液 D.加CCl4、萃取、分液解析:乙醇与水互溶,加水后乙醇溶于水,而苯与水不互溶,分液,可以除去乙醇。
答案:C一、乙醇的结构 为了测定乙醇分子中有几个可被置换的氢原子(即确定乙醇的分子结构),可使乙醇与金属钠反应,使生成的H2排出水,测量排出水的体积可计算出标准状况下H2的体积,根据所消耗乙醇的物质的量,可确定乙醇分子中被置换的氢原子个数,从而确定乙醇的分子结构。
(1)若用下图中仪器和导管组装实验装置,如果所制气体流向从左到右时,则仪器与导管连接的顺序是( )接( )接( )接( )接( )接( )。(2)仪器连接好后进行实验时有下列操作:①在仪器F中注入适量的无水乙醇,在C中装入3 g碎块状金属钠(足量),在E中注满蒸馏水;②检查气密性;③待仪器C恢复到室温时,测定仪器D中水的体积;④慢慢开启仪器F的活塞。正确的操作顺序是________。 (3)若实验时消耗2.9 mL的无水乙醇(密度为0.8 g·mL-1),测量排出水的体积后折算成标准状况下H2的体积为560 mL。根据以上数据推算出乙醇分子中可被置换的氢原子个数为________,结构式为____________________________。(1)要知道仪器的连接顺序,首先应明确各种仪器在测量中的作用。F和C组成乙醇和钠反应的发生装置,E(内盛水)是量气瓶,D是排出水的收集装置,由排出水的体积推算出在标准状况下H2的体积。A和B是连接导管。连接发生装置和量气瓶的导管的作用是保证量气瓶中的气体能顺利排出。所以导管应短,选用A管。而连接量气瓶和收集装置的导管则应选用长的导管B,目的是保证水能顺利排出。所以,装置的连接顺序是F→C→A→E→B→D。(2)实验的操作顺序:首先是②检验装置的气密性,然后是①装药品,接着是④使乙醇跟Na反应,最后是③待恢复到常温后测量水的体积。
(3)取得实验数据后具体计算如下:说明生成1 mol H2需2 mol乙醇跟Na反应,也就是说乙醇分子中的6个氢原子中只有1个可被置换,所以乙醇的结构式解得:x = 2应为 。名师点睛:利用有机物的性质,通过定性或定量实验推断或确定有机物的结构,主要是利用官能团对有机物性质的决定作用,通过有机物的性质,推断出有机物分子中所含有的官能团,进而确定有机物的结构式。变式应用1.乙醇的下列实验现象或性质,可以证明乙醇分子中有1个氢原子与另外的氢原子不同的是( )
A.1 mol乙醇完全燃烧可以生成3 mol的水
B.乙醇可以按任意比例与水混溶
C.1 mol乙醇可以在一定条件下氧化成l mol的乙醛
D.1 mol乙醇跟足量的金属钠反应可得0.5 mol的氢气解析:乙醇分子中有6个氢原子,其中1个氢原子与氧原子相连接。1 mol乙醇跟足量的金属钠反应可得0.5 mol氢气,说明1 mol乙醇中只有1 mol的氢原予可以与金属钠反应,说明这1个氢原子与其余5个氢原子是不同的。
答案:D二、醇的催化氧化下列醇不能在铜的催化下发生氧化反应的是( )解析:根据醇的催化氧化规律:与羟基相连的碳原子上有氢原子的醇才可被催化氧化。答案:D变式应用2.下列有机物的分子式都是C4H10O,其中能发生催化氧化反应,但不能被氧化为具有相同碳原子数的醛的是( )解析:D项中的—OH所连碳原子上无氢原子,该醇不能被氧化,其他醇均能发生催化氧化反应,但是A项中的—OH不是连在端点碳原子上,故虽然能被氧化但不能被氧化为醛。
答案:A水平测试1.下列物质含有两种官能团的是( )解析:决定物质化学性质的原子或原子团称为官能团。
答案:C2.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化还原反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生资源
④燃烧时放出大量的热量
A.①②③ B.①②④
C.①③④ D.②③④D3.下列说法正确的是( )
A.羟基与氢氧根有相同的化学式和电子式
B.乙醇的官能团是—OH,乙醇是含—OH的化合物
C.常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
D.已知乙醇的结构式如下图所示,则乙醇催化氧化时断裂的化学键为②③4.(2011年雅安检测)下列有关乙醇的物理性质的说法中不正确的是( )
A.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去解析:乙醇易挥发,容易闻到其特殊香味,A项说法正确;乙醇是一种重要的有机溶剂,可用乙醇提取中药的有效成分,B项说法正确;乙醇能够以任意比例溶于水,因此乙醇中的水无法用分液法除去,除去乙醇中的水可在乙醇中加入生石灰,加热蒸馏得到无水乙醇,C项说法正确,D项说法错误。
答案:D5.(2011年安徽淮南检测)将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻后,铜片质量增加的是( )
A.硝酸 B.无水乙醇
C.石灰水 D.盐酸6.乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请回答关于乙醇的若干问题:
(1)用物理、化学方法各一种鉴别乙醇和汽油。
若用物理方法,应选择的试剂为________________________________________________________________________;
若用化学方法,应选择的试剂为________________________________________________________________________。(2)用乙醇为主要原料(无机试剂任选),根据要求,分别写出相应的化学方程式(注明反应条件)。
①氧化反应________________________________________________________________________。
②置换反应________________________________________________________________________。能力提升7.下列物质都能与金属钠反应放出H2,产生H2的速率排序正确的是( )
①C2H5OH ②NaOH溶液 ③稀盐酸
A.①>②>③ B.②>①>③
C.③>②>① D.③>①>②C8.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间解析:主要利用原子守恒。
C2H6O~3H2O
1 3
0.2 mol 0.6 mol
即设CO为x mol。由CO、CO2得n总=0.4 mol,m总=16.8 g,则28 x+44×(0.4-x)=16.8 g,x=0.05 mol,
所以m(CO)=28×0.05=1.4 g。
答案:A9.现有①CH3OH、②ClCH2CH2OH、 ③CH2===CHCH2CH2OH、④HOCH2CH2OH、⑤HOCH2CH(OH)CH2OH五种有机物。根据下列要求用序号回答问题:
(1)既能发生加成反应又能发生消去反应的是________。
(2)上述五种有机物与钠反应产生相同体积的氢气时,消耗醇的物质的量最少的是________。
(3)不能发生消去反应的是________。
(4) 1 mol有机物能催化氧化生成2 mol醛基(—CHO)的是________。解析:根据有机物官能团判断其化学性质,上述五种物质中,只有含碳碳双键的有机物能发生加成,所以③能发生加成反应;能发生消去反应的有:②③④⑤;等物质的量的有机物中只有丙三醇含—OH最多,所以与钠反应产生等量的氢气,丙三醇需要的物质的量最小;含有碳卤键的有机物②在氢氧化钠水溶液中发生水解;—CH2OH催化氧化生成一个—CHO,含2个—CH2OH的有机物分子催化氧化生成2个醛基(—CHO),④⑤符合题意。
答案:(1)③ (2)⑤ (3)① (4)② ④⑤ 10.某实验小组用如下图所示装置进行乙醇的催化氧化实验。(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________________________________________________________________________
________________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应。(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________,集气瓶中收集到的主要成分是________。解析:(1)铜网由红变黑是由于Cu与O2反应生成了CuO,由黑再变红是由于CuO被CH3CH2OH还原生成了Cu和CH3CHO。起初反应需加热,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是放热反应。
(2)甲中产生的乙醇蒸气进入玻璃管中,所以甲的作用是加热;反应产生的乙醛蒸气要冷凝成液体,所以乙的作用是冷却。 (3)试管a中除能收集到CH3CHO外,肯定还有未被氧化的乙醇和生成的水,空气中O2参与反应后,剩下的主要气体是N2,所以集气瓶中收集到的主要气体为N2。答案:(1)2Cu+O2 2CuO,CH3CH2OH+CuO CH3CHO+Cu+H2O 放热 (2)加热 冷却 (3)乙醛、乙醇、水 氮气感谢您的使用,退出请按ESC键本小节结束
第1课时 乙 醇有机化合物第1课时 乙 醇日本一家名为“日本食粮”的公司最近研究出了利用生活垃圾和农业废弃物制造乙醇的方法,用它生产的乙醇成本仅为现有同类产品的一半,而且生产效率比较高。
据悉,这家公司采用了日本森林综合研究所开发的臭氧处理法来分解旧报纸、纸制容器、废木材等垃圾,以及树皮、稻草等农业废弃物,并用一种特殊的酶把其中的纤维素转化成为葡萄糖,进而再使用酵母发酵、成熟、蒸馏,制造乙醇。这种技术生产效率颇高,10吨垃圾可制造2.5吨乙醇,价格比现在市场上销售的工业乙醇要便宜一半。生产乙醇剩下的残渣还能够用作园艺材料。因此可以说,这是一种“零排放”技术。
乙醇既是一种重要化工原料,又是一种比较优良的燃料,它有哪些性质呢?1.了解烃的衍生物和官能团的概念。
2.了解乙醇的主要用途。
3.掌握乙醇的组成、主要性质。
4.了解乙醇与人类日常生活与健康的知识。
5.初步学会分析官能团与性质关系的方法。烃的衍生物1.烃的衍生物
烃分子中的______被其他原子或原子团所取代而生成的一系列化合物。
2.官能团
(1)定义。
决定有机化合物_________的原子或原子团。氢原子化学特性 (2)实例。—Cl —OH —NO2羟基 碳碳双键乙醇1.物理性质无特殊香液小以任意比混溶易易2.乙醇的结构C2H6O羟基(—OH)CH3CH2OH(或C2H5OH)3.化学性质
(1)与钠反应。__________________________________________________。
(2)氧化反应。
①燃烧。
乙醇在空气中燃烧,发出______色火焰,并放出大量的热:______________________________________________。2CH3CH2OH+2Na 2CH3CH2ONa+H2↑淡蓝 ②催化氧化。亮红 刺激性黑③与强氧化剂反应。CH3COOH应用思考:1.能否用分液的方法分离酒精与水的混合物?如何制取无水酒精呢?2.制得的无水酒精真的“无水”吗?如何进行检验?提示:不能,因为乙醇与水互溶,形成混合溶液,不分层。加入CaO,再加热蒸馏。提示:可以取少量无水酒精,加入无水硫酸铜固体,若固体变蓝,则含有水分;若不变蓝,则不含有水分。综合拓展一、乙醇的性质与结构
1.乙醇的性质与键的断裂2.乙醇催化氧化的实质总反应方程式为2CH3CH2OH+O2 2CH3CHO+2H2O,反应中Cu作催化剂。
特别关注:(1)醇催化氧化的条件:与羟基相连的碳原子上有氢原子。
(2)醇发生催化氧化时,由于分子中去掉了2个氢原子,相应的氧化产物的相对分子质量比醇小2。 二、钠分别与水、乙醇反应的比较特别关注:(1)密度关系。
金属钠与乙醇反应时钠沉在乙醇的底部,而与水反应时浮在水面上,说明三者的密度关系为:水>钠>乙醇。
(2)氢原子的活泼性。
钠和乙醇反应时没有熔化成小球,也没有发出声响。这说明水分子中的氢原子相对更活泼,而乙醇分子羟基中的氢原子相对不活泼。(3)数量关系。
1 mol乙醇跟足量钠反应,产生0.5 mol氢气。该关系可以延伸为1 mol羟基跟足量钠反应,产生0.5 mol氢气。
(4)金属钠与乙醇和水的混合物反应。
把金属钠放入乙醇和水的混合物中,钠先和水反应,再和乙醇反应,据此可以除去乙醇中少量的水。尝试应用1.下列关于乙醇的说法不正确的是( )
A.乙醇易挥发
B.是无色透明、有特殊香味的液体
C.密度比水小,沸点比水高
D.乙醇不能用于萃取碘水中的碘C2.(2011年湖北宜昌联考)下列物质不能从溴水中萃取溴的是( )
A.乙醇 B.苯
C.四氯化碳 D.戊烷解析:萃取剂必须具备3个条件:①与原溶剂互不相溶;②溶质在其中的溶解度比在原溶剂中的溶解度大;③萃取剂与溶质不反应。乙醇与水互溶,A项错误。
答案:A3.苯中混有乙醇杂质,除去乙醇的方法是( )
A.加热蒸发 B.过滤
C.加水、萃取、分液 D.加CCl4、萃取、分液解析:乙醇与水互溶,加水后乙醇溶于水,而苯与水不互溶,分液,可以除去乙醇。
答案:C一、乙醇的结构 为了测定乙醇分子中有几个可被置换的氢原子(即确定乙醇的分子结构),可使乙醇与金属钠反应,使生成的H2排出水,测量排出水的体积可计算出标准状况下H2的体积,根据所消耗乙醇的物质的量,可确定乙醇分子中被置换的氢原子个数,从而确定乙醇的分子结构。
(1)若用下图中仪器和导管组装实验装置,如果所制气体流向从左到右时,则仪器与导管连接的顺序是( )接( )接( )接( )接( )接( )。(2)仪器连接好后进行实验时有下列操作:①在仪器F中注入适量的无水乙醇,在C中装入3 g碎块状金属钠(足量),在E中注满蒸馏水;②检查气密性;③待仪器C恢复到室温时,测定仪器D中水的体积;④慢慢开启仪器F的活塞。正确的操作顺序是________。 (3)若实验时消耗2.9 mL的无水乙醇(密度为0.8 g·mL-1),测量排出水的体积后折算成标准状况下H2的体积为560 mL。根据以上数据推算出乙醇分子中可被置换的氢原子个数为________,结构式为____________________________。(1)要知道仪器的连接顺序,首先应明确各种仪器在测量中的作用。F和C组成乙醇和钠反应的发生装置,E(内盛水)是量气瓶,D是排出水的收集装置,由排出水的体积推算出在标准状况下H2的体积。A和B是连接导管。连接发生装置和量气瓶的导管的作用是保证量气瓶中的气体能顺利排出。所以导管应短,选用A管。而连接量气瓶和收集装置的导管则应选用长的导管B,目的是保证水能顺利排出。所以,装置的连接顺序是F→C→A→E→B→D。(2)实验的操作顺序:首先是②检验装置的气密性,然后是①装药品,接着是④使乙醇跟Na反应,最后是③待恢复到常温后测量水的体积。
(3)取得实验数据后具体计算如下:说明生成1 mol H2需2 mol乙醇跟Na反应,也就是说乙醇分子中的6个氢原子中只有1个可被置换,所以乙醇的结构式解得:x = 2应为 。名师点睛:利用有机物的性质,通过定性或定量实验推断或确定有机物的结构,主要是利用官能团对有机物性质的决定作用,通过有机物的性质,推断出有机物分子中所含有的官能团,进而确定有机物的结构式。变式应用1.乙醇的下列实验现象或性质,可以证明乙醇分子中有1个氢原子与另外的氢原子不同的是( )
A.1 mol乙醇完全燃烧可以生成3 mol的水
B.乙醇可以按任意比例与水混溶
C.1 mol乙醇可以在一定条件下氧化成l mol的乙醛
D.1 mol乙醇跟足量的金属钠反应可得0.5 mol的氢气解析:乙醇分子中有6个氢原子,其中1个氢原子与氧原子相连接。1 mol乙醇跟足量的金属钠反应可得0.5 mol氢气,说明1 mol乙醇中只有1 mol的氢原予可以与金属钠反应,说明这1个氢原子与其余5个氢原子是不同的。
答案:D二、醇的催化氧化下列醇不能在铜的催化下发生氧化反应的是( )解析:根据醇的催化氧化规律:与羟基相连的碳原子上有氢原子的醇才可被催化氧化。答案:D变式应用2.下列有机物的分子式都是C4H10O,其中能发生催化氧化反应,但不能被氧化为具有相同碳原子数的醛的是( )解析:D项中的—OH所连碳原子上无氢原子,该醇不能被氧化,其他醇均能发生催化氧化反应,但是A项中的—OH不是连在端点碳原子上,故虽然能被氧化但不能被氧化为醛。
答案:A水平测试1.下列物质含有两种官能团的是( )解析:决定物质化学性质的原子或原子团称为官能团。
答案:C2.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化还原反应
②充分燃烧的产物不污染环境
③乙醇是一种可再生资源
④燃烧时放出大量的热量
A.①②③ B.①②④
C.①③④ D.②③④D3.下列说法正确的是( )
A.羟基与氢氧根有相同的化学式和电子式
B.乙醇的官能团是—OH,乙醇是含—OH的化合物
C.常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
D.已知乙醇的结构式如下图所示,则乙醇催化氧化时断裂的化学键为②③4.(2011年雅安检测)下列有关乙醇的物理性质的说法中不正确的是( )
A.由于乙醇容易挥发,所以才有俗语“酒香不怕巷子深”的说法
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去解析:乙醇易挥发,容易闻到其特殊香味,A项说法正确;乙醇是一种重要的有机溶剂,可用乙醇提取中药的有效成分,B项说法正确;乙醇能够以任意比例溶于水,因此乙醇中的水无法用分液法除去,除去乙醇中的水可在乙醇中加入生石灰,加热蒸馏得到无水乙醇,C项说法正确,D项说法错误。
答案:D5.(2011年安徽淮南检测)将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻后,铜片质量增加的是( )
A.硝酸 B.无水乙醇
C.石灰水 D.盐酸6.乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请回答关于乙醇的若干问题:
(1)用物理、化学方法各一种鉴别乙醇和汽油。
若用物理方法,应选择的试剂为________________________________________________________________________;
若用化学方法,应选择的试剂为________________________________________________________________________。(2)用乙醇为主要原料(无机试剂任选),根据要求,分别写出相应的化学方程式(注明反应条件)。
①氧化反应________________________________________________________________________。
②置换反应________________________________________________________________________。能力提升7.下列物质都能与金属钠反应放出H2,产生H2的速率排序正确的是( )
①C2H5OH ②NaOH溶液 ③稀盐酸
A.①>②>③ B.②>①>③
C.③>②>① D.③>①>②C8.一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间解析:主要利用原子守恒。
C2H6O~3H2O
1 3
0.2 mol 0.6 mol
即设CO为x mol。由CO、CO2得n总=0.4 mol,m总=16.8 g,则28 x+44×(0.4-x)=16.8 g,x=0.05 mol,
所以m(CO)=28×0.05=1.4 g。
答案:A9.现有①CH3OH、②ClCH2CH2OH、 ③CH2===CHCH2CH2OH、④HOCH2CH2OH、⑤HOCH2CH(OH)CH2OH五种有机物。根据下列要求用序号回答问题:
(1)既能发生加成反应又能发生消去反应的是________。
(2)上述五种有机物与钠反应产生相同体积的氢气时,消耗醇的物质的量最少的是________。
(3)不能发生消去反应的是________。
(4) 1 mol有机物能催化氧化生成2 mol醛基(—CHO)的是________。解析:根据有机物官能团判断其化学性质,上述五种物质中,只有含碳碳双键的有机物能发生加成,所以③能发生加成反应;能发生消去反应的有:②③④⑤;等物质的量的有机物中只有丙三醇含—OH最多,所以与钠反应产生等量的氢气,丙三醇需要的物质的量最小;含有碳卤键的有机物②在氢氧化钠水溶液中发生水解;—CH2OH催化氧化生成一个—CHO,含2个—CH2OH的有机物分子催化氧化生成2个醛基(—CHO),④⑤符合题意。
答案:(1)③ (2)⑤ (3)① (4)② ④⑤ 10.某实验小组用如下图所示装置进行乙醇的催化氧化实验。(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________________________________________________________________________
________________________________________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应。(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________,集气瓶中收集到的主要成分是________。解析:(1)铜网由红变黑是由于Cu与O2反应生成了CuO,由黑再变红是由于CuO被CH3CH2OH还原生成了Cu和CH3CHO。起初反应需加热,熄灭酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是放热反应。
(2)甲中产生的乙醇蒸气进入玻璃管中,所以甲的作用是加热;反应产生的乙醛蒸气要冷凝成液体,所以乙的作用是冷却。 (3)试管a中除能收集到CH3CHO外,肯定还有未被氧化的乙醇和生成的水,空气中O2参与反应后,剩下的主要气体是N2,所以集气瓶中收集到的主要气体为N2。答案:(1)2Cu+O2 2CuO,CH3CH2OH+CuO CH3CHO+Cu+H2O 放热 (2)加热 冷却 (3)乙醛、乙醇、水 氮气感谢您的使用,退出请按ESC键本小节结束
