【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第三章第三节 第2课时 乙酸(67张ppt)
文档属性
| 名称 | 【寒假备课精选】2013-2014下学期高中化学同步配套辅导与检测(人教版,必修2):第三章第三节 第2课时 乙酸(67张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 923.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-23 00:00:00 | ||
图片预览






文档简介
课件67张PPT。第三节 生活中两种常见的有机物
第1课时 乙 酸有机化合物第1课时 乙 酸 从前,有一个刻薄的地主,过年时找教书先生写了这样一副对联:“酿酒缸缸好,造醋坛坛酸。”但是街坊四邻却都是这么“识文断字”的:“酿酒缸缸好造醋,坛坛酸。”出处大约是教书先生因为东家克扣了工钱,就想办法作弄先生写对联时,先生就写了这么一副。给东家说的时候就是第一种断法,贴出去以后,就是第二种断法。从这个对联看来,酒和醋之间具有一定的联系,我们对这两种物质都不陌东家。东家让生,酒精的学名为乙醇,醋酸的学名为乙酸。
乙酸具有怎样的性质呢?乙酸和乙醇又具有怎样的联系?1.了解乙酸的主要用途。
2.掌握乙酸的组成与主要性质。
3.了解乙酸与人类日常生活与健康的知识。
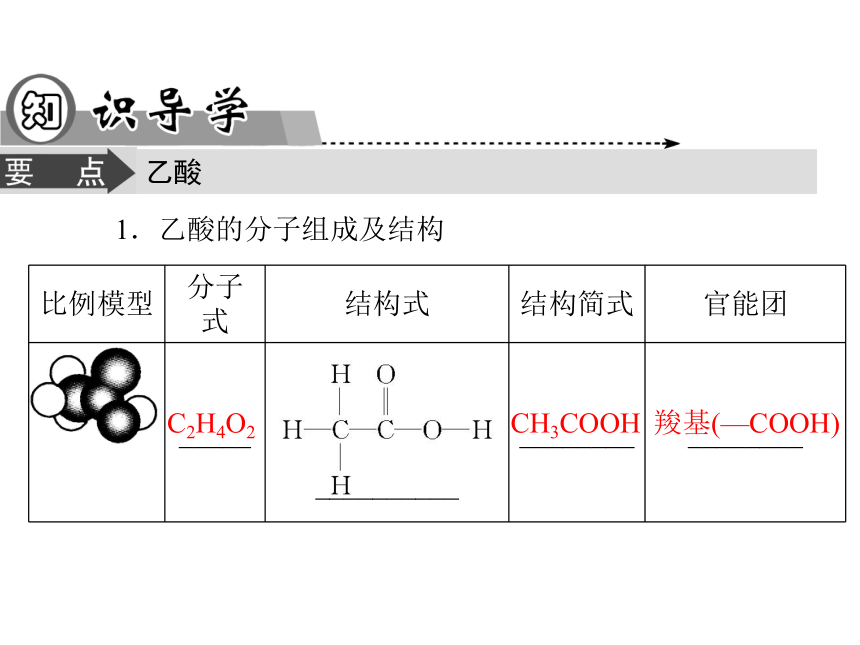
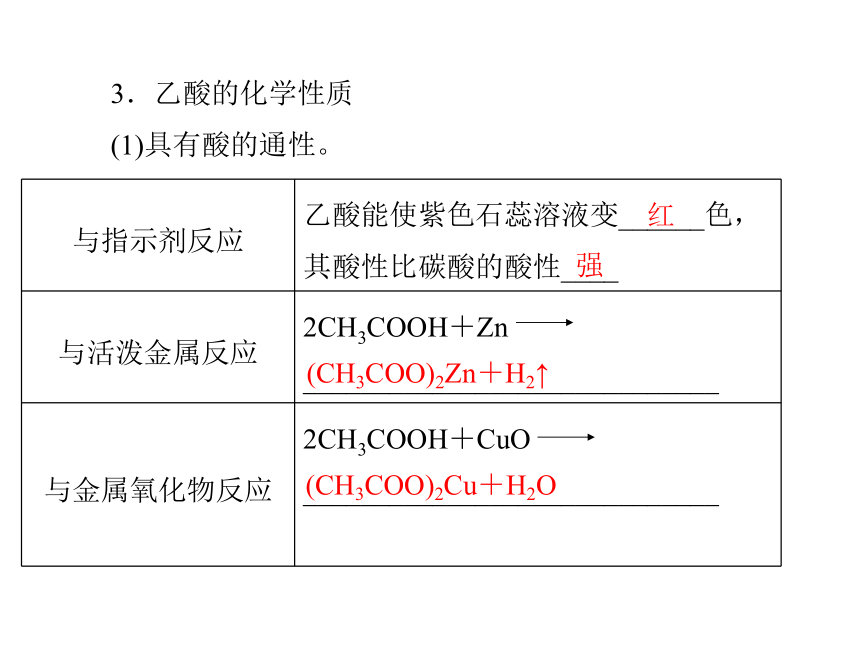
4.学会分析官能团与物质性质关系的方法。乙酸1.乙酸的分子组成及结构C2H4O2CH3COOH羧基(—COOH)2.乙酸的物理性质当温度低于16.6 ℃时,乙酸凝结为类似____一样的晶体,所以纯净的乙酸又称为______。无强烈刺激性液易冰冰醋酸3.乙酸的化学性质
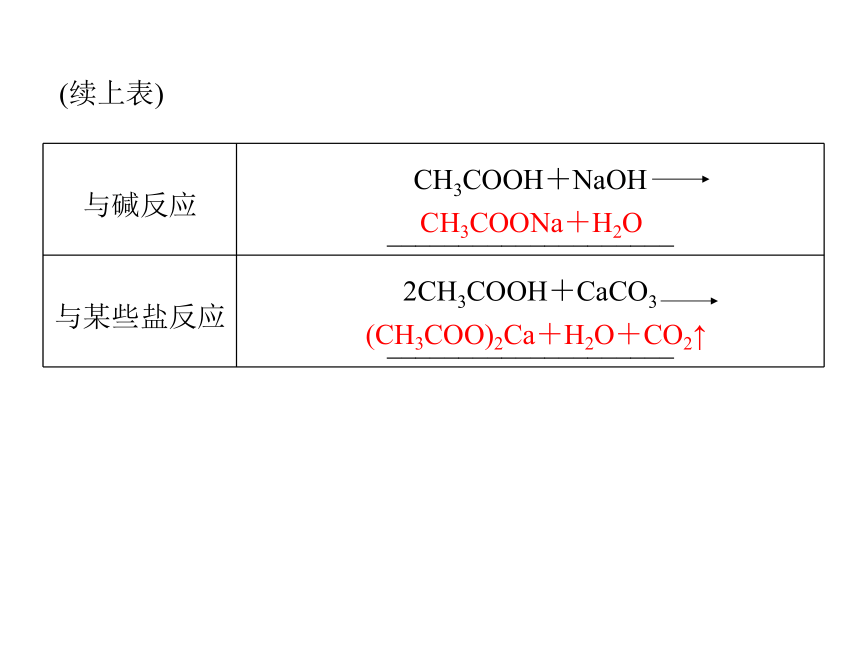
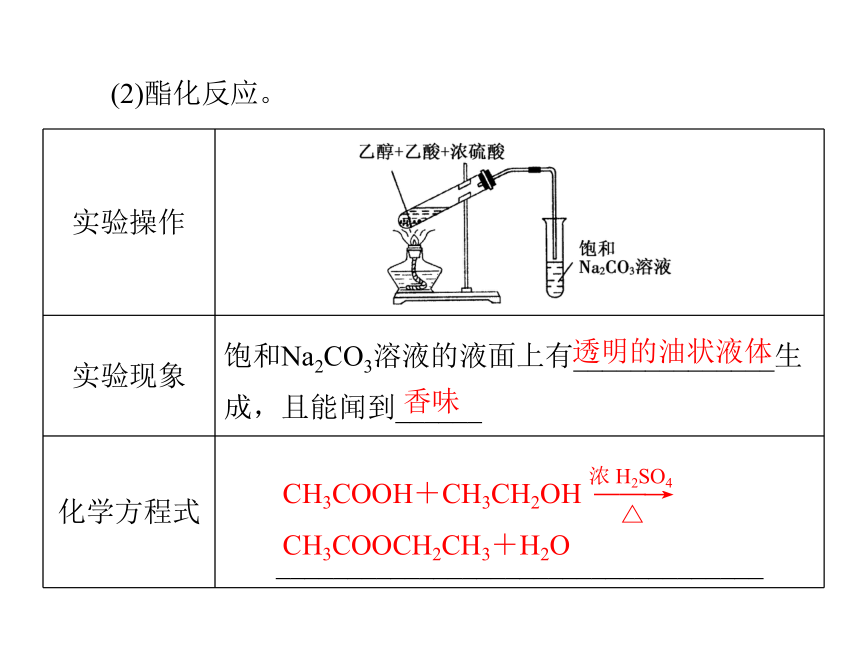
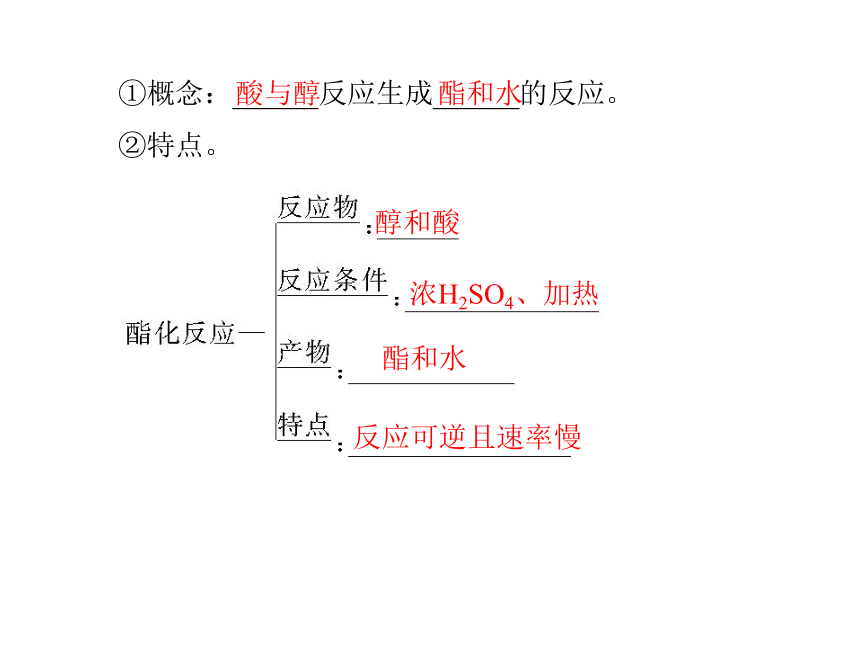
(1)具有酸的通性。红强(CH3COO)2Zn+H2↑(CH3COO)2Cu+H2O(续上表)CH3COONa+H2O(CH3COO)2Ca+H2O+CO2↑(2)酯化反应。香味透明的油状液体①概念:______反应生成______的反应。
②特点。反应可逆且速率慢酸与醇 酯和水醇和酸浓H2SO4、加热酯和水应用思考:1.无水乙酸又称冰醋酸,温度较低时,无水乙酸会凝结成像冰一样的晶体。若在实验室中遇到这种情况时,应如何从试剂瓶中取出无水乙酸?提示:可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。2.如何证明CH3COOH的酸性比H2CO3强?提示:将CH3COOH溶液滴加到盛有少量Na2CO3或NaHCO3溶液的试管中,产生气泡,即证明酸性CH3COOH>H2CO3。3.(1)如何配制酯化反应的混合物?
(2)实验中浓H2SO4起什么作用?
(3)酯化反应还属于哪一类有机反应类型?
(4)为什么用饱和Na2CO3溶液吸收乙酸乙酯?提示:(1)在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸。
(2)催化剂、吸水剂。
(3)取代反应。
(4)用饱和Na2CO3溶液可除去少量乙酸,并可降低乙酸乙酯的溶解度,便于分层。综合拓展一、几种物质中羟基氢原子的活泼性二、乙酸的酯化反应:酸与醇反应生成酯和水的反应4.酯化反应的实质
酯化反应的反应机理可用示踪原子法来证明:若用含18O的乙醇和不含18O的乙酸反应,可以发现所生成的乙酸乙酯分子里含有18O原子,而水分子中不含18O原子,这说明酯化反应的一般过程是羧酸分子中的—OH与醇分子中—OH上的氢原子结合生成水,其余部分结合生成酯:即酯化反应可认为是“酸脱羟基、醇脱氢”,属于取代反应。
特别关注:(1)刚开始小火均匀加热,防止没有反应的乙醇和乙酸大量挥发,反应一段时间后大火加热,主要使生成的乙酸乙酯蒸发出来。
(2)有机实验中因有机化合物的熔、沸点较低,反应速率较慢,且往往需要加热,所以有部分反应物没有来得及反应就被蒸发出来,为此通过采用长导管的装置,当被蒸发出的物质通过长导管时,受冷又变为液态,回流到反应体系中继续参与反应,所以长导管除导气外,还起到冷凝回流的作用。 (3)该反应属于可逆反应,从反应类型来看,属于酯化反应,也属于取代反应。反应的实质是酸脱羟基醇脱氢形成水,剩下的两部分结合生成酯。1.乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( )
A.乙酸的官能团为—OH
B.乙酸的酸性比碳酸弱
C.乙酸能够与金属钠反应产生氢气
D.乙酸能使紫色的石蕊溶液变蓝C尝试应用2.下列物质与水混合后静置,不出现分层的是( )
A.乙酸 B.三氯甲烷
C.苯 D.四氯化碳A3.炒菜时,加酒又加醋,可使菜变得味香可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成解析:酒中的CH3CH2OH和醋中的CH3COOH生成有香味的乙酸乙酯。
答案:D一、乙酸的结构及性质 (双选题)下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )
A.将醋酸不小心滴到大理石桌面上,桌面失去光泽
B.熏醋可一定程度上防止流行感冒
C.醋可以除去水壶中的水垢
D.用醋烹饪鱼,除去鱼的腥味解析:醋酸与CaCO3发生反应:CaCO3+2CH3COOH―→(CH3COO)2Ca+CO2↑+H2O,显酸性。水垢的主要成分是CaCO3和Mg(OH)2,乙酸的酸性比碳酸强,所以可以与水垢反应,体现出乙酸的酸性。做鱼的时候一般要放料酒,酸和醇发生反应生成具有特殊香味的酯。
答案:AC
名师点睛:CH3COOH分子只存在一个—COOH的事实:
①1 mol CH3COOH与Na反应生成0.5 mol H2。②1 mol CH3COOH与1 mol NaOH恰好完全中和。
③1 mol CH3COOH与0.5 mol Na2CO3完全反应生成 0.5 mol CO2。
④1 mol CH3COOH与1 mol NaHCO3完全反应生成1 mol CO2。
⑤酯化反应中,1 mol CH3COOH消耗1 mol CH3CH2OH。 变式应用1.苹果酸是一种常见的有机酸,其结构简式为,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下与乙酸酯化
⑤一定条件下与乙醇酯化A.①②③ B.①②③④
C.①②③⑤ D.①②③④⑤解析:苹果酸中含有羧基、羟基两种官能团。羧基具有酸的通性,能使石蕊试液变红,与碱金属反应,与乙醇酯化。羟基的存在使其能与乙酸酯化,与钠等活泼金属反应。
答案:D二、酯化反应 (2011年实验中学期末)某课外小组设计的实验室制取乙酸乙酯的装置如右图所示,长颈漏斗中盛有浓硫酸,烧瓶中盛有乙醇、无水醋酸钠,烧杯中盛有饱和碳酸钠溶液。
请回答:
(1)浓硫酸的作用是________________________________________________________________________________________________________________________________________________,若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:____________________________________________________________________________________________________。
(2)球形干燥管的作用是__________________________________________________,若反应前向烧杯中加入几滴酚酞,溶液呈红色,反应结束后烧杯中的现象是__________________________________________________。 (3)要分离含乙酸、乙醇和乙酸乙酯的粗产品,下图是分离操作步骤流程图。试剂a是________,试剂b是________;分离方法①是________,分离方法②是________,分离方法③是__________________________________________________。(4)在得到的A中加入无水碳酸钠粉末并振荡,其目的是__________________________________________________。 解析:(1)浓硫酸可与无水醋酸钠反应生成醋酸,在制备乙酸乙酯的反应中,浓硫酸又作为催化剂和吸水剂。(2)用Na2CO3溶液吸收产物时注意防止倒吸。开始反应前饱和碳酸钠溶液显碱性,所以滴入酚酞溶液呈红色,而反应结束后产物中除乙酸乙酯外,还伴随有蒸出的乙醇和乙酸,少量的乙酸将中和掉烧杯中的部分OH-,溶液碱性降低从而使红色变浅,并且生成的乙酸乙酯不溶于水,所以出现分层现象。对于第(3)、(4)小题,可从分析粗产品的成分入手。粗产品中有乙酸乙酯、乙酸、乙醇三种物质,用饱和碳酸钠溶液进行萃取、分液可把混合物分离成两种半成品,其中一份是乙酸乙酯(即A)、另一份是乙酸钠和乙醇的水溶液(即B)。蒸馏B可得到乙醇(即E),留下的残液是乙酸钠溶液(即C)。再在C中加稀硫酸,经蒸馏可得到乙酸溶液。
答案:(1)与醋酸钠反应生成醋酸,作催化剂和吸水剂CH3CO18OH+CH3CH2OH(2)冷凝和防止倒吸 溶液颜色变浅,出现分层现象,上层是透明的有特殊香味的油状液体
(3)饱和碳酸钠溶液 稀硫酸 萃取、分液 蒸馏 蒸馏
(4)除去乙酸乙酯中的水分名师点睛:实验室制C2H4(CH3CH2OH CH2===CH2↑+H2O)、苯的硝化反应、乙酸的酯化反应中均用到浓H2SO4,但浓H2SO4的作用并不相同,判断时应特别注意区别。变式应用2.(2011年福建宁德检测)“酒是陈的香”就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如下反应:CH3COOH+C2H5OH CH3COOC2H5+H2O来制取乙酸乙酯。(1)实验时,试管B观察到的现象是界面处产生浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是________________________________________________________________________(用化学方程式表示)。
欲从上述混合物中分离出乙酸乙酯,采用的分离方法是________。(2)事实证明,此反应以浓H2SO4为催化剂,也存在缺陷,其原因可能是________。
a.浓H2SO4易挥发,因此不能重复使用
b.会使部分原料炭化
c.浓H2SO4有吸水性
d.会造成环境污染解析:(1)乙酸乙酯中混有乙酸,振荡时乙酸与Na2CO3反应产生CO2,界面处溶液酸性变弱,因此溶液浅红色消失;乙酸乙酯不溶于Na2CO3溶液,液体出现分层,故可用分液法分离出乙酸乙酯。
(2)浓H2SO4在加热条件下能使部分有机物脱水炭化,同时产生SO2,H2SO4废液及SO2会造成环境污染。
答案:(1)2CH3COOH+Na2CO3 2CH3COONa+CO2↑+H2O 分液 (2)bd水平测试1.下列关于乙醇和醋酸的比较中,错误的是( )
A.分子内都含有羟基,都有酸性
B.都属于烃的含氧衍生物
C.都能发生酯化反应
D.都可在人们的生活中应用解析:乙醇在水中不能电离,没有酸性。
答案:A2.酯化反应属于( )
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应D3.除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液解析:因酯和酸沸点相近而不易蒸馏分离。NaOH在除酸的同时,除掉部分酯。饱和Na2CO3既能反应掉乙酸又能降低酯的溶解度。
答案:C4.(双选题)下列物质可以用来鉴别乙醇、乙酸、乙酸乙酯的试剂是( )
A.稀硫酸 B.NaOH溶液
C.碳酸钠溶液 D.紫色石蕊溶液CD5.在CH3COOH+C2H5OH CH3COOC2H5+H2O的平衡体系中,加入一定量的C2H518OH,当重新达到平衡时,18O原子还应存在于( )
A.乙酸乙酯中
B.乙酸中
C.水中
D.乙酸、乙醇、乙酸乙酯和水中解析:酯化反应的实质是羧酸脱去羟基,醇脱去氢原子。
答案:A6.可用如右图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去),请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序和操作是____________________________________。 (2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是____________________________________。(3)实验中加热试管的目的是:
①____________________________________________;
②____________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是__________________________________________________。
(5)反应结束后,振荡试管b,静置,观察到的现象是__________________________________________________。解析:液体与固体混合,通常将固体放入液体中溶解;液体与液体混合,通常将密度较大的注入密度较小的液体中,如果放热,要边加边搅拌,如稀释硫酸应向水中加入浓硫酸,边加边搅拌,浓硫酸溶解放热,如果后加密度较小的水,易使水浮于浓硫酸表面,受热沸腾而溅出,引起安全事故。沸石可防止液体暴沸。饱和Na2CO3溶液不与乙酸乙酯反应,可降低乙酸乙酯在水中的溶解度,又可吸收未反应的乙酸和乙醇。乙酸乙酯的密度小于水的密度,浮在溶液上层。答案:(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 (2)在试管a中加入几粒沸石(或碎瓷片) (3)①加快反应速率 ②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇,抑制乙酸乙酯在水中的溶解 (5)b中的液体分层,上层是透明的油状液体能力提升7.(2011年吉林长春模拟)在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有机物可能是( ) 解析:相同条件下气体的物质的量之比等于体积之比。n1、n2分别为该状况下所得到的氢气、二氧化碳的物质的量,设选项中各物质的物质的量均为1 mol,则各物质与n1、n2的对应关系如下表:由表中数据可知,若V1=V2≠0即n1=n2≠0,则有机物可能为 。
答案:A8.当乙酸分子中的氧全部是18O,乙醇分子中的氧全部是16O时,二者在一定条件下反应生成水的相对分子质量为( )
A.16 B.18
C.20 D.229.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:________________________________________________________________________________________________________。(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是________________________________________________________________________________________________________。
(3)浓硫酸的作用是:___________________________________________________。
(4)饱和碳酸钠溶液的主要作用是________________________________________________________________________________________________________。(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止___________________________________________________。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________________。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是___________________________________________________。(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有________。
①单位时间里,生成1 mol 乙酸乙酯,同时生成1 mol 水
②单位时间里,生成1 mol 乙酸乙酯,同时生成1 mol 乙酸
③单位时间里,消耗1 mol 乙醇,同时消耗1 mol 乙酸④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化解析:因浓硫酸与其他液体混合时会放出大量热,乙醇沸点低,很容易挥发,所以先加入乙醇,再慢慢加入浓硫酸并注意摇动试管,最后加入乙酸。生成乙酸乙酯的反应为可逆反应,为加快反应速率并使平衡向正反应方向移动以提高乙酸乙酯的产率,可采用加热的方法。产物乙酸乙酯是一种无色透明的油状液体,不溶于水,密度比水小。答案:(1)(2)先在试管中加入一定量的乙醇,然后边振荡试管边慢慢加入浓硫酸,最后再加入乙酸
(3)催化作用和吸水作用(4)中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分液得到酯
(5)倒吸 (6)分液
(7)防止试管中液体暴沸
(8)②④⑤①苹果醋的分子式为___________________________________________________。
②1 mol 苹果醋与足量金属钠反应,能生成标准状况下的氢气________L。
③苹果醋可能发生的反应有________。
A.与NaOH溶液反应
B.与石蕊溶液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化解析:1 mol完全反应时,分别消耗的Na、NaOH、NaHCO3、Na2CO3的物质的量之比为4:2:2:1。
答案:(1)4:2:2:1
(2)①C4H6O5 ②33.6 ③ABCD感谢您的使用,退出请按ESC键本小节结束
第1课时 乙 酸有机化合物第1课时 乙 酸 从前,有一个刻薄的地主,过年时找教书先生写了这样一副对联:“酿酒缸缸好,造醋坛坛酸。”但是街坊四邻却都是这么“识文断字”的:“酿酒缸缸好造醋,坛坛酸。”出处大约是教书先生因为东家克扣了工钱,就想办法作弄先生写对联时,先生就写了这么一副。给东家说的时候就是第一种断法,贴出去以后,就是第二种断法。从这个对联看来,酒和醋之间具有一定的联系,我们对这两种物质都不陌东家。东家让生,酒精的学名为乙醇,醋酸的学名为乙酸。
乙酸具有怎样的性质呢?乙酸和乙醇又具有怎样的联系?1.了解乙酸的主要用途。
2.掌握乙酸的组成与主要性质。
3.了解乙酸与人类日常生活与健康的知识。
4.学会分析官能团与物质性质关系的方法。乙酸1.乙酸的分子组成及结构C2H4O2CH3COOH羧基(—COOH)2.乙酸的物理性质当温度低于16.6 ℃时,乙酸凝结为类似____一样的晶体,所以纯净的乙酸又称为______。无强烈刺激性液易冰冰醋酸3.乙酸的化学性质
(1)具有酸的通性。红强(CH3COO)2Zn+H2↑(CH3COO)2Cu+H2O(续上表)CH3COONa+H2O(CH3COO)2Ca+H2O+CO2↑(2)酯化反应。香味透明的油状液体①概念:______反应生成______的反应。
②特点。反应可逆且速率慢酸与醇 酯和水醇和酸浓H2SO4、加热酯和水应用思考:1.无水乙酸又称冰醋酸,温度较低时,无水乙酸会凝结成像冰一样的晶体。若在实验室中遇到这种情况时,应如何从试剂瓶中取出无水乙酸?提示:可将试剂瓶用手或热毛巾捂热,也可放在温水浴中温热,待冰醋酸熔化后,倒出即可。2.如何证明CH3COOH的酸性比H2CO3强?提示:将CH3COOH溶液滴加到盛有少量Na2CO3或NaHCO3溶液的试管中,产生气泡,即证明酸性CH3COOH>H2CO3。3.(1)如何配制酯化反应的混合物?
(2)实验中浓H2SO4起什么作用?
(3)酯化反应还属于哪一类有机反应类型?
(4)为什么用饱和Na2CO3溶液吸收乙酸乙酯?提示:(1)在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸。
(2)催化剂、吸水剂。
(3)取代反应。
(4)用饱和Na2CO3溶液可除去少量乙酸,并可降低乙酸乙酯的溶解度,便于分层。综合拓展一、几种物质中羟基氢原子的活泼性二、乙酸的酯化反应:酸与醇反应生成酯和水的反应4.酯化反应的实质
酯化反应的反应机理可用示踪原子法来证明:若用含18O的乙醇和不含18O的乙酸反应,可以发现所生成的乙酸乙酯分子里含有18O原子,而水分子中不含18O原子,这说明酯化反应的一般过程是羧酸分子中的—OH与醇分子中—OH上的氢原子结合生成水,其余部分结合生成酯:即酯化反应可认为是“酸脱羟基、醇脱氢”,属于取代反应。
特别关注:(1)刚开始小火均匀加热,防止没有反应的乙醇和乙酸大量挥发,反应一段时间后大火加热,主要使生成的乙酸乙酯蒸发出来。
(2)有机实验中因有机化合物的熔、沸点较低,反应速率较慢,且往往需要加热,所以有部分反应物没有来得及反应就被蒸发出来,为此通过采用长导管的装置,当被蒸发出的物质通过长导管时,受冷又变为液态,回流到反应体系中继续参与反应,所以长导管除导气外,还起到冷凝回流的作用。 (3)该反应属于可逆反应,从反应类型来看,属于酯化反应,也属于取代反应。反应的实质是酸脱羟基醇脱氢形成水,剩下的两部分结合生成酯。1.乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( )
A.乙酸的官能团为—OH
B.乙酸的酸性比碳酸弱
C.乙酸能够与金属钠反应产生氢气
D.乙酸能使紫色的石蕊溶液变蓝C尝试应用2.下列物质与水混合后静置,不出现分层的是( )
A.乙酸 B.三氯甲烷
C.苯 D.四氯化碳A3.炒菜时,加酒又加醋,可使菜变得味香可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成解析:酒中的CH3CH2OH和醋中的CH3COOH生成有香味的乙酸乙酯。
答案:D一、乙酸的结构及性质 (双选题)下列是有关生活中的醋酸,其中主要利用了醋酸酸性的是( )
A.将醋酸不小心滴到大理石桌面上,桌面失去光泽
B.熏醋可一定程度上防止流行感冒
C.醋可以除去水壶中的水垢
D.用醋烹饪鱼,除去鱼的腥味解析:醋酸与CaCO3发生反应:CaCO3+2CH3COOH―→(CH3COO)2Ca+CO2↑+H2O,显酸性。水垢的主要成分是CaCO3和Mg(OH)2,乙酸的酸性比碳酸强,所以可以与水垢反应,体现出乙酸的酸性。做鱼的时候一般要放料酒,酸和醇发生反应生成具有特殊香味的酯。
答案:AC
名师点睛:CH3COOH分子只存在一个—COOH的事实:
①1 mol CH3COOH与Na反应生成0.5 mol H2。②1 mol CH3COOH与1 mol NaOH恰好完全中和。
③1 mol CH3COOH与0.5 mol Na2CO3完全反应生成 0.5 mol CO2。
④1 mol CH3COOH与1 mol NaHCO3完全反应生成1 mol CO2。
⑤酯化反应中,1 mol CH3COOH消耗1 mol CH3CH2OH。 变式应用1.苹果酸是一种常见的有机酸,其结构简式为,苹果酸可能发生的反应是( )①与NaOH溶液反应
②与石蕊试液作用变红
③与金属钠反应放出气体
④一定条件下与乙酸酯化
⑤一定条件下与乙醇酯化A.①②③ B.①②③④
C.①②③⑤ D.①②③④⑤解析:苹果酸中含有羧基、羟基两种官能团。羧基具有酸的通性,能使石蕊试液变红,与碱金属反应,与乙醇酯化。羟基的存在使其能与乙酸酯化,与钠等活泼金属反应。
答案:D二、酯化反应 (2011年实验中学期末)某课外小组设计的实验室制取乙酸乙酯的装置如右图所示,长颈漏斗中盛有浓硫酸,烧瓶中盛有乙醇、无水醋酸钠,烧杯中盛有饱和碳酸钠溶液。
请回答:
(1)浓硫酸的作用是________________________________________________________________________________________________________________________________________________,若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:____________________________________________________________________________________________________。
(2)球形干燥管的作用是__________________________________________________,若反应前向烧杯中加入几滴酚酞,溶液呈红色,反应结束后烧杯中的现象是__________________________________________________。 (3)要分离含乙酸、乙醇和乙酸乙酯的粗产品,下图是分离操作步骤流程图。试剂a是________,试剂b是________;分离方法①是________,分离方法②是________,分离方法③是__________________________________________________。(4)在得到的A中加入无水碳酸钠粉末并振荡,其目的是__________________________________________________。 解析:(1)浓硫酸可与无水醋酸钠反应生成醋酸,在制备乙酸乙酯的反应中,浓硫酸又作为催化剂和吸水剂。(2)用Na2CO3溶液吸收产物时注意防止倒吸。开始反应前饱和碳酸钠溶液显碱性,所以滴入酚酞溶液呈红色,而反应结束后产物中除乙酸乙酯外,还伴随有蒸出的乙醇和乙酸,少量的乙酸将中和掉烧杯中的部分OH-,溶液碱性降低从而使红色变浅,并且生成的乙酸乙酯不溶于水,所以出现分层现象。对于第(3)、(4)小题,可从分析粗产品的成分入手。粗产品中有乙酸乙酯、乙酸、乙醇三种物质,用饱和碳酸钠溶液进行萃取、分液可把混合物分离成两种半成品,其中一份是乙酸乙酯(即A)、另一份是乙酸钠和乙醇的水溶液(即B)。蒸馏B可得到乙醇(即E),留下的残液是乙酸钠溶液(即C)。再在C中加稀硫酸,经蒸馏可得到乙酸溶液。
答案:(1)与醋酸钠反应生成醋酸,作催化剂和吸水剂CH3CO18OH+CH3CH2OH(2)冷凝和防止倒吸 溶液颜色变浅,出现分层现象,上层是透明的有特殊香味的油状液体
(3)饱和碳酸钠溶液 稀硫酸 萃取、分液 蒸馏 蒸馏
(4)除去乙酸乙酯中的水分名师点睛:实验室制C2H4(CH3CH2OH CH2===CH2↑+H2O)、苯的硝化反应、乙酸的酯化反应中均用到浓H2SO4,但浓H2SO4的作用并不相同,判断时应特别注意区别。变式应用2.(2011年福建宁德检测)“酒是陈的香”就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如下反应:CH3COOH+C2H5OH CH3COOC2H5+H2O来制取乙酸乙酯。(1)实验时,试管B观察到的现象是界面处产生浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是________________________________________________________________________(用化学方程式表示)。
欲从上述混合物中分离出乙酸乙酯,采用的分离方法是________。(2)事实证明,此反应以浓H2SO4为催化剂,也存在缺陷,其原因可能是________。
a.浓H2SO4易挥发,因此不能重复使用
b.会使部分原料炭化
c.浓H2SO4有吸水性
d.会造成环境污染解析:(1)乙酸乙酯中混有乙酸,振荡时乙酸与Na2CO3反应产生CO2,界面处溶液酸性变弱,因此溶液浅红色消失;乙酸乙酯不溶于Na2CO3溶液,液体出现分层,故可用分液法分离出乙酸乙酯。
(2)浓H2SO4在加热条件下能使部分有机物脱水炭化,同时产生SO2,H2SO4废液及SO2会造成环境污染。
答案:(1)2CH3COOH+Na2CO3 2CH3COONa+CO2↑+H2O 分液 (2)bd水平测试1.下列关于乙醇和醋酸的比较中,错误的是( )
A.分子内都含有羟基,都有酸性
B.都属于烃的含氧衍生物
C.都能发生酯化反应
D.都可在人们的生活中应用解析:乙醇在水中不能电离,没有酸性。
答案:A2.酯化反应属于( )
A.中和反应 B.不可逆反应
C.离子反应 D.取代反应D3.除去乙酸乙酯中含有的乙酸,最好的处理方法是( )
A.蒸馏
B.水洗后分液
C.用过量饱和碳酸钠溶液洗涤后分液
D.用过量NaOH溶液洗涤后分液解析:因酯和酸沸点相近而不易蒸馏分离。NaOH在除酸的同时,除掉部分酯。饱和Na2CO3既能反应掉乙酸又能降低酯的溶解度。
答案:C4.(双选题)下列物质可以用来鉴别乙醇、乙酸、乙酸乙酯的试剂是( )
A.稀硫酸 B.NaOH溶液
C.碳酸钠溶液 D.紫色石蕊溶液CD5.在CH3COOH+C2H5OH CH3COOC2H5+H2O的平衡体系中,加入一定量的C2H518OH,当重新达到平衡时,18O原子还应存在于( )
A.乙酸乙酯中
B.乙酸中
C.水中
D.乙酸、乙醇、乙酸乙酯和水中解析:酯化反应的实质是羧酸脱去羟基,醇脱去氢原子。
答案:A6.可用如右图所示装置制取少量乙酸乙酯(酒精灯等在图中均已略去),请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序和操作是____________________________________。 (2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是____________________________________。(3)实验中加热试管的目的是:
①____________________________________________;
②____________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是__________________________________________________。
(5)反应结束后,振荡试管b,静置,观察到的现象是__________________________________________________。解析:液体与固体混合,通常将固体放入液体中溶解;液体与液体混合,通常将密度较大的注入密度较小的液体中,如果放热,要边加边搅拌,如稀释硫酸应向水中加入浓硫酸,边加边搅拌,浓硫酸溶解放热,如果后加密度较小的水,易使水浮于浓硫酸表面,受热沸腾而溅出,引起安全事故。沸石可防止液体暴沸。饱和Na2CO3溶液不与乙酸乙酯反应,可降低乙酸乙酯在水中的溶解度,又可吸收未反应的乙酸和乙醇。乙酸乙酯的密度小于水的密度,浮在溶液上层。答案:(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 (2)在试管a中加入几粒沸石(或碎瓷片) (3)①加快反应速率 ②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇,抑制乙酸乙酯在水中的溶解 (5)b中的液体分层,上层是透明的油状液体能力提升7.(2011年吉林长春模拟)在同温、同压下,某有机物与过量Na反应得到V1 L氢气,另取一份等量的该有机物与足量NaHCO3反应得V2 L二氧化碳,若V1=V2≠0,则有机物可能是( ) 解析:相同条件下气体的物质的量之比等于体积之比。n1、n2分别为该状况下所得到的氢气、二氧化碳的物质的量,设选项中各物质的物质的量均为1 mol,则各物质与n1、n2的对应关系如下表:由表中数据可知,若V1=V2≠0即n1=n2≠0,则有机物可能为 。
答案:A8.当乙酸分子中的氧全部是18O,乙醇分子中的氧全部是16O时,二者在一定条件下反应生成水的相对分子质量为( )
A.16 B.18
C.20 D.229.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:________________________________________________________________________________________________________。(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是________________________________________________________________________________________________________。
(3)浓硫酸的作用是:___________________________________________________。
(4)饱和碳酸钠溶液的主要作用是________________________________________________________________________________________________________。(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止___________________________________________________。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是________________。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是___________________________________________________。(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有________。
①单位时间里,生成1 mol 乙酸乙酯,同时生成1 mol 水
②单位时间里,生成1 mol 乙酸乙酯,同时生成1 mol 乙酸
③单位时间里,消耗1 mol 乙醇,同时消耗1 mol 乙酸④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化解析:因浓硫酸与其他液体混合时会放出大量热,乙醇沸点低,很容易挥发,所以先加入乙醇,再慢慢加入浓硫酸并注意摇动试管,最后加入乙酸。生成乙酸乙酯的反应为可逆反应,为加快反应速率并使平衡向正反应方向移动以提高乙酸乙酯的产率,可采用加热的方法。产物乙酸乙酯是一种无色透明的油状液体,不溶于水,密度比水小。答案:(1)(2)先在试管中加入一定量的乙醇,然后边振荡试管边慢慢加入浓硫酸,最后再加入乙酸
(3)催化作用和吸水作用(4)中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分液得到酯
(5)倒吸 (6)分液
(7)防止试管中液体暴沸
(8)②④⑤①苹果醋的分子式为___________________________________________________。
②1 mol 苹果醋与足量金属钠反应,能生成标准状况下的氢气________L。
③苹果醋可能发生的反应有________。
A.与NaOH溶液反应
B.与石蕊溶液作用
C.与乙酸在一定条件下酯化
D.与乙醇在一定条件下酯化解析:1 mol完全反应时,分别消耗的Na、NaOH、NaHCO3、Na2CO3的物质的量之比为4:2:2:1。
答案:(1)4:2:2:1
(2)①C4H6O5 ②33.6 ③ABCD感谢您的使用,退出请按ESC键本小节结束
