化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2.1元素性质的周期性变化规律(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 12:09:38 | ||
图片预览





文档简介
(共17张PPT)
第二节元素周期律
第一课时
元素性质的周期性变化规律
1. 电子分层排布
2. 能量最低原理
原子的核外电子总是优先排布在能量较低的电子层,然后由内到外,依次排布在能量逐渐升高的电子层。
3. 数目规律
(1)每层最多容纳2n2个电子;
(2)最外层电子数目不超过8个(K层2个);
(3)次外层电子数目不超过18个;
(4)倒数第三层电子数目不超过32个。
电子在能量不同的区域分层排布离核由近到远,能量由低到高
【复习回顾】(核外电子排布规律)
导入
Leading……
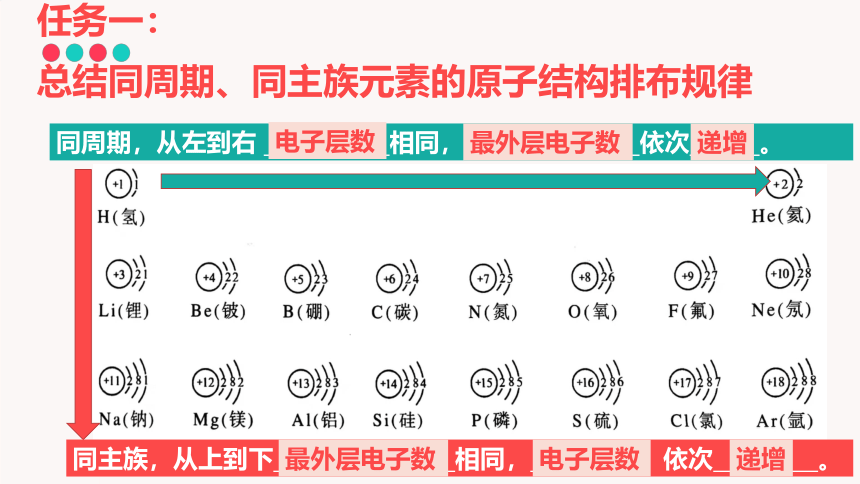
任务一:
总结同周期、同主族元素的原子结构排布规律
同周期,从左到右 相同, 依次 。
同主族,从上到下 相同, 依次 。
电子层数
最外层电子数
递增
最外层电子数
电子层数
递增
一、主族元素原子的电子排布规律
1、同周期元素, 相同,且周期数= 。
2、同主族元素, 相同,且主族序数= 。
3、同周期元素从左向右,元素的原子最外层电子数逐渐 ,(1→8,第一周期1→2)。
4、同主族元素从上至下,元素的原子电子层数逐渐 。
电子层数
电子层数
最外层电子数
最外层电子数
增多
增多
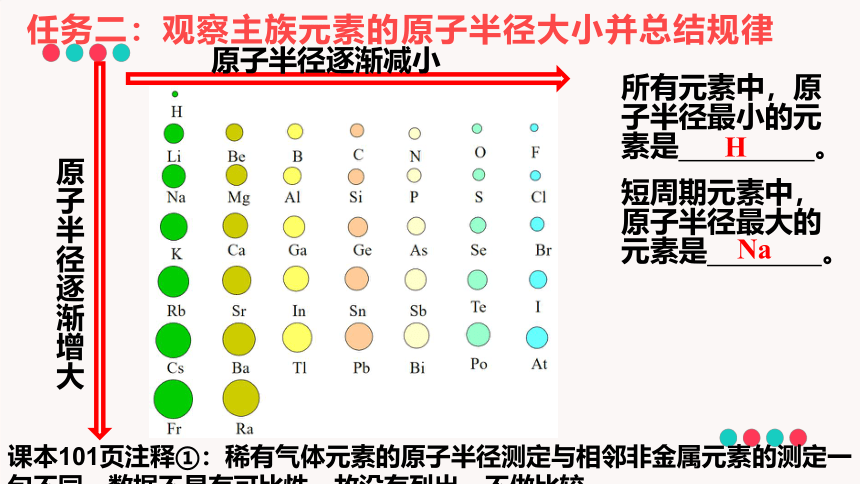
任务二:观察主族元素的原子半径大小并总结规律
原子半径逐渐减小
原子半径逐渐增大
课本101页注释①:稀有气体元素的原子半径测定与相邻非金属元素的测定一句不同,数据不具有可比性,故没有列出,不做比较
所有元素中,原子半径最小的元素是 。
短周期元素中,原子半径最大的元素是 。
Na
H
1、同周期,从左至右半径逐渐 。(不包含稀有气体)
2、同主族,从上至下半径逐渐 。
二、主族元素原子半径变化规律
减小
增大
如:原子半径大小:Na>Mg>Al>Si>P>S>Cl
如:原子半径大小:F思考1:为什么原子半径大小会有上述的递变规律?
同一主族,从上往下,电子层增加,所以半径增加,同一周期,电子层不变,但是核电荷数增加,对核外电子吸引力变大,所以半径变小。
思考2:对比一下数据,回答问题:
电子层多的原子半径一定大于电子层数少的原子吗?
不一定,比如第二周期的Li的原子半径比第三周期的Si、P原子半径大
影响微粒半径大小的主要因素有哪些
【问题思考】
微粒半径
电子层数
核电荷数(质子数)
电子数
影响
(主)
(中)
(次)
②电子层数相同时,核电荷数越大,原子核对核外电子引力越大,半径越小
①电子层数越多,半径越大
3、重点突破:原子半径、离子半径大小的比较
(1)影响因素
(5) 周期、主族、电子层结构不同的粒子半径大小比较
【练习1】比较K+、Ca2+、Cl-、S2-粒子半径的大小
S2- > Cl- > K+ > Ca2+
【小结】“三看”规律比较微粒半径的大小:
1. 一看“电子层数”:电子层数不同时,电子层越多,半径越大。
2. 二看“核电荷数”:电子层数相同时,核电荷数越大,半径越小。
3. 三看“电子数”:电子层和核电荷数相同,电子数越多,半径越大。
【练习2】 O2-、F-、Na+、Mg2+的半径由大到小的顺序?
【练习3】试比较下列微粒半径大小(填“>”“<”或“=”)。
(1)Mg______Ca______K;
(2)P______S______Cl;
(3)Fe3+______Fe2+______Fe;
(4)P3-______S2-______Cl-______Na+______Mg2+______Al3+。
(5)F- ___F
【练习4】下列各组粒子,按半径由大到小顺序排列正确的是
( )
A.Mg、Ca、K、Na
B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S
D.Na+、Al3+、Cl-、F-
总结:
比较原子以及简单离子大小的“三看法”
一看层,层多径大;
二看序。层同序大径小;
三看e-,层同核同e-多径大,如Cl->Cl,Fe2+>Fe3+。
任务三:观察元素下表思考元素化合价规律
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
电子层 结构
最高正价或最低负价
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
电子层 结构
最高正价或最低负价
2 1
2 2
2 3
2 4
2 5
2 6
2 7
2 8
2 8 1
+ 1
+ 5
– 3
– 2
– 1
+ 4
– 4
0
+ 3
+ 2
+ 5
– 3
+ 6
– 2
+ 7
– 1
+ 4
– 4
+ 3
+ 2
+ 1
0
2 8 2
2 8 3
2 8 4
2 8 5
2 8 6
2 8 7
2 8 8
规律:随原子序数的递增,元素的最高正价呈现由+1到+7,最低负价呈现由-4到-1的周期性变化。
重点总结
2.元素最高正价 = 最外层电子数=主族序数
1.氟只有0和-1价,氧一般无正价,金属元素无负化合价
3. |最低负化合价| + 最高正化合价 = 8
【练习5】. 某元素的最高正价与负价的代数和为4,则该元素的最外层电子数为( )
A. 4 B. 5 C. 6 D. 7
【练习6】某元素最高价含氧酸的化学式为HXO4,这种元素的气态氢化物的化学式是( )
A. HX B. H2X C. XH3 D. XH4
【答案】CA
【答案】B
【练习7】 某1-18号元素中,X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为( )
A. 5n – 12 B. 3n – 12 C. 3n – 6 D. n – 10
第二节元素周期律
第一课时
元素性质的周期性变化规律
1. 电子分层排布
2. 能量最低原理
原子的核外电子总是优先排布在能量较低的电子层,然后由内到外,依次排布在能量逐渐升高的电子层。
3. 数目规律
(1)每层最多容纳2n2个电子;
(2)最外层电子数目不超过8个(K层2个);
(3)次外层电子数目不超过18个;
(4)倒数第三层电子数目不超过32个。
电子在能量不同的区域分层排布离核由近到远,能量由低到高
【复习回顾】(核外电子排布规律)
导入
Leading……
任务一:
总结同周期、同主族元素的原子结构排布规律
同周期,从左到右 相同, 依次 。
同主族,从上到下 相同, 依次 。
电子层数
最外层电子数
递增
最外层电子数
电子层数
递增
一、主族元素原子的电子排布规律
1、同周期元素, 相同,且周期数= 。
2、同主族元素, 相同,且主族序数= 。
3、同周期元素从左向右,元素的原子最外层电子数逐渐 ,(1→8,第一周期1→2)。
4、同主族元素从上至下,元素的原子电子层数逐渐 。
电子层数
电子层数
最外层电子数
最外层电子数
增多
增多
任务二:观察主族元素的原子半径大小并总结规律
原子半径逐渐减小
原子半径逐渐增大
课本101页注释①:稀有气体元素的原子半径测定与相邻非金属元素的测定一句不同,数据不具有可比性,故没有列出,不做比较
所有元素中,原子半径最小的元素是 。
短周期元素中,原子半径最大的元素是 。
Na
H
1、同周期,从左至右半径逐渐 。(不包含稀有气体)
2、同主族,从上至下半径逐渐 。
二、主族元素原子半径变化规律
减小
增大
如:原子半径大小:Na>Mg>Al>Si>P>S>Cl
如:原子半径大小:F
同一主族,从上往下,电子层增加,所以半径增加,同一周期,电子层不变,但是核电荷数增加,对核外电子吸引力变大,所以半径变小。
思考2:对比一下数据,回答问题:
电子层多的原子半径一定大于电子层数少的原子吗?
不一定,比如第二周期的Li的原子半径比第三周期的Si、P原子半径大
影响微粒半径大小的主要因素有哪些
【问题思考】
微粒半径
电子层数
核电荷数(质子数)
电子数
影响
(主)
(中)
(次)
②电子层数相同时,核电荷数越大,原子核对核外电子引力越大,半径越小
①电子层数越多,半径越大
3、重点突破:原子半径、离子半径大小的比较
(1)影响因素
(5) 周期、主族、电子层结构不同的粒子半径大小比较
【练习1】比较K+、Ca2+、Cl-、S2-粒子半径的大小
S2- > Cl- > K+ > Ca2+
【小结】“三看”规律比较微粒半径的大小:
1. 一看“电子层数”:电子层数不同时,电子层越多,半径越大。
2. 二看“核电荷数”:电子层数相同时,核电荷数越大,半径越小。
3. 三看“电子数”:电子层和核电荷数相同,电子数越多,半径越大。
【练习2】 O2-、F-、Na+、Mg2+的半径由大到小的顺序?
【练习3】试比较下列微粒半径大小(填“>”“<”或“=”)。
(1)Mg______Ca______K;
(2)P______S______Cl;
(3)Fe3+______Fe2+______Fe;
(4)P3-______S2-______Cl-______Na+______Mg2+______Al3+。
(5)F- ___F
【练习4】下列各组粒子,按半径由大到小顺序排列正确的是
( )
A.Mg、Ca、K、Na
B.S2-、Cl-、K+、Na+
C.Br-、Br、Cl、S
D.Na+、Al3+、Cl-、F-
总结:
比较原子以及简单离子大小的“三看法”
一看层,层多径大;
二看序。层同序大径小;
三看e-,层同核同e-多径大,如Cl->Cl,Fe2+>Fe3+。
任务三:观察元素下表思考元素化合价规律
元素 3Li 4Be 5B 6C 7N 8O 9F 10Ne
电子层 结构
最高正价或最低负价
元素 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
电子层 结构
最高正价或最低负价
2 1
2 2
2 3
2 4
2 5
2 6
2 7
2 8
2 8 1
+ 1
+ 5
– 3
– 2
– 1
+ 4
– 4
0
+ 3
+ 2
+ 5
– 3
+ 6
– 2
+ 7
– 1
+ 4
– 4
+ 3
+ 2
+ 1
0
2 8 2
2 8 3
2 8 4
2 8 5
2 8 6
2 8 7
2 8 8
规律:随原子序数的递增,元素的最高正价呈现由+1到+7,最低负价呈现由-4到-1的周期性变化。
重点总结
2.元素最高正价 = 最外层电子数=主族序数
1.氟只有0和-1价,氧一般无正价,金属元素无负化合价
3. |最低负化合价| + 最高正化合价 = 8
【练习5】. 某元素的最高正价与负价的代数和为4,则该元素的最外层电子数为( )
A. 4 B. 5 C. 6 D. 7
【练习6】某元素最高价含氧酸的化学式为HXO4,这种元素的气态氢化物的化学式是( )
A. HX B. H2X C. XH3 D. XH4
【答案】CA
【答案】B
【练习7】 某1-18号元素中,X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为( )
A. 5n – 12 B. 3n – 12 C. 3n – 6 D. n – 10
