黑龙江省大庆市2022-2023学年高三(上)期中考试化学试卷(含解析)
文档属性
| 名称 | 黑龙江省大庆市2022-2023学年高三(上)期中考试化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 267.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 16:10:04 | ||
图片预览

文档简介
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
学校:___________姓名:___________班级:___________考号:___________
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
2022-2023学年黑龙江省大庆市高三(上)期中化学试卷
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
化学与生活、生产密切相关。下列说法中错误的是( )
A. 市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤
B. “天和”核心舱其腔体使用的氮化硼陶瓷基复合材料属于无机非金属材料
C. 制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型有机高分子材料
D. “凡引水种盐,待夏秋之交,南风大起,则一宵结成”该过程属于蒸发结晶
下列说法正确的是( )
A. 的结构示意图为 B. 水晶的分子式:
C. 甲基的电子式: D. 石炭酸的最简式:
宏观辨识和微观探析是化学学科的核心素养之一。下列描述物质制备和应用的离子方程式正确的是( )
A. 泡沫灭火器的反应原理:
B. 海水提溴工艺中,用纯碱溶液富集 :
C. 锅炉除垢过程中 转化为:
D. 溶液逐滴滴入溶液中,反应后溶液呈中性:
设为阿伏加德罗常数的值,下列说法正确的是( )
A. 溶液:和粒子数目之和为
B. 质量分数为的乙醇水溶液中氧原子数为
C. 新戊烷含有非极性共价键数目为
D. 含的浓盐酸与足量的加热充分反应,转移的电子数为
下列关于有机物的说法不正确的是( )
A. 与互为同分异构体
B. 乙醇和甘油都属于醇类
C. 经催化加氢后能生成甲基戊烷
D. 苯和乙烯的所有原子都在同一平面上
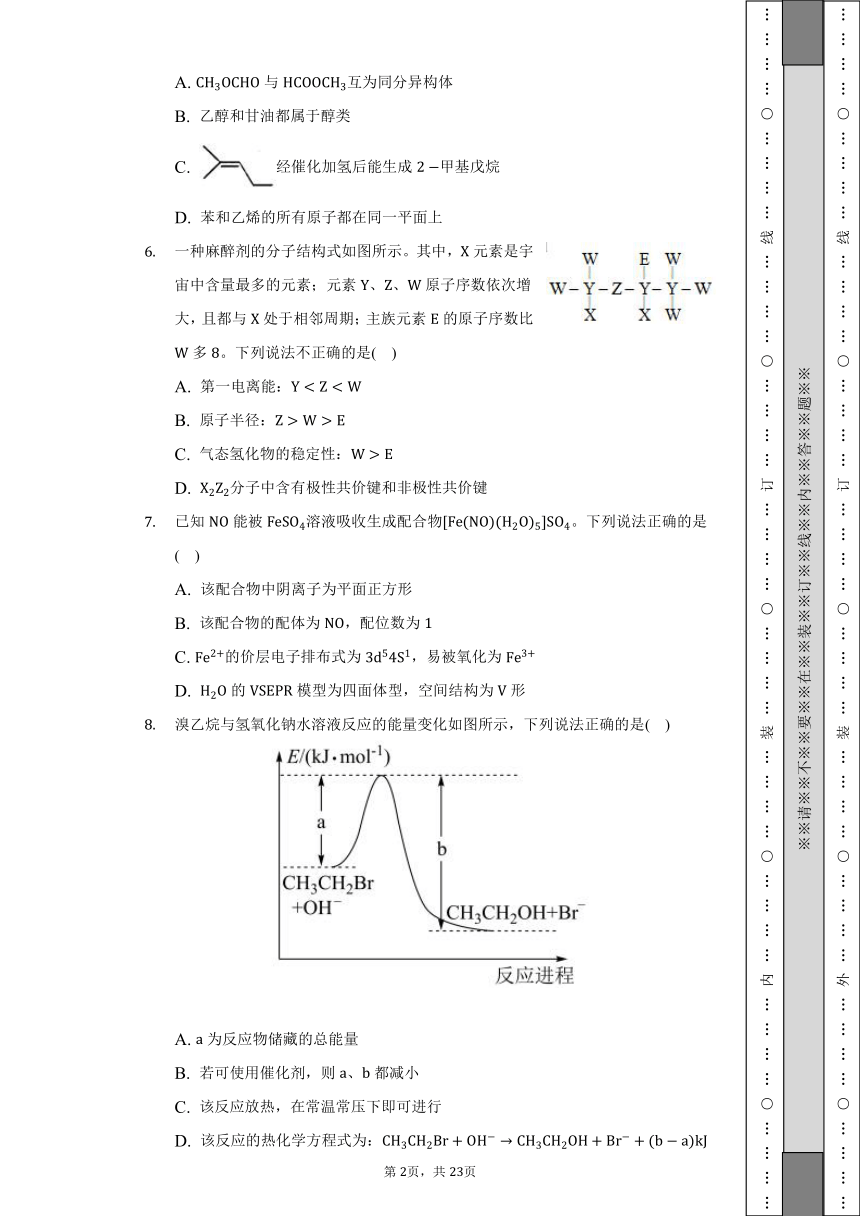
一种麻醉剂的分子结构式如图所示。其中,元素是宇宙中含量最多的元素;元素、、原子序数依次增大,且都与处于相邻周期;主族元素的原子序数比多。下列说法不正确的是( )
A. 第一电离能:
B. 原子半径:
C. 气态氢化物的稳定性:
D. 分子中含有极性共价键和非极性共价键
已知能被溶液吸收生成配合物。下列说法正确的是( )
A. 该配合物中阴离子为平面正方形
B. 该配合物的配体为,配位数为
C. 的价层电子排布式为,易被氧化为
D. 的模型为四面体型,空间结构为形
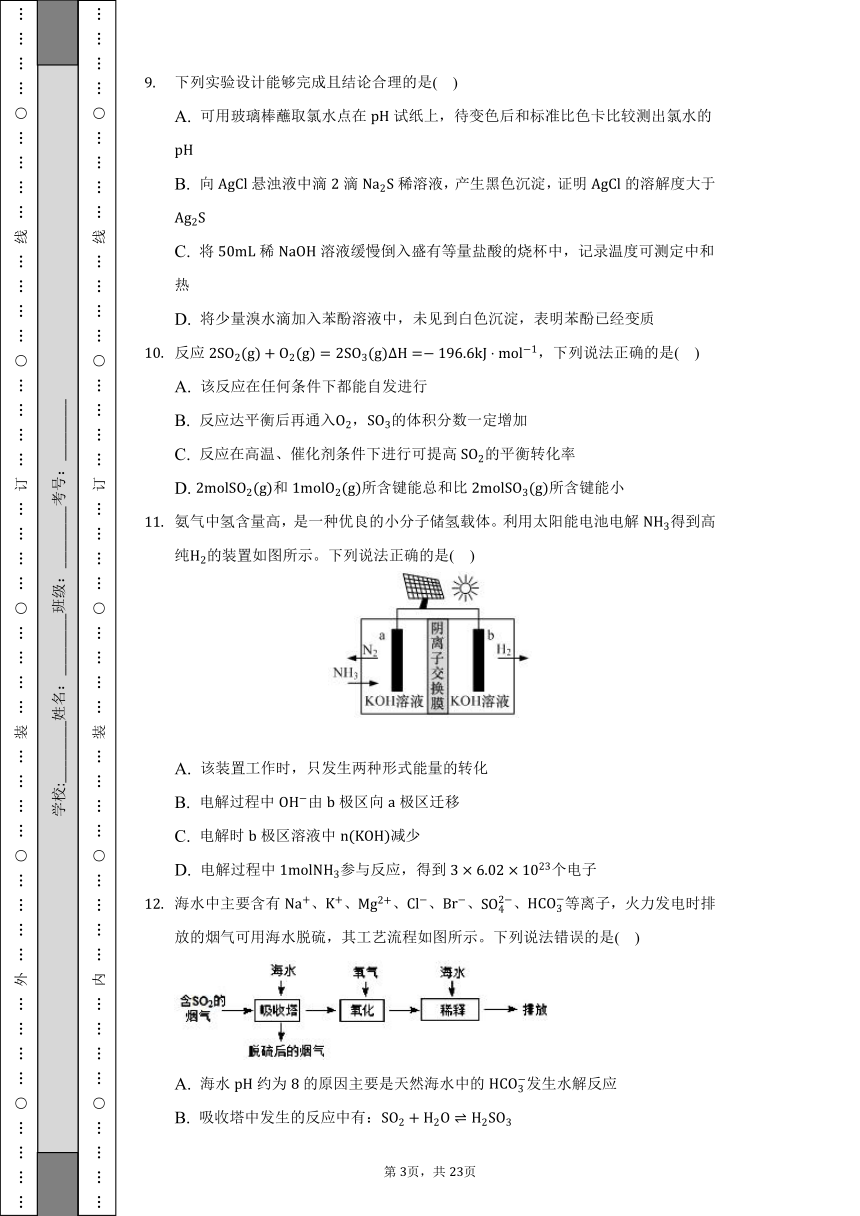
溴乙烷与氢氧化钠水溶液反应的能量变化如图所示,下列说法正确的是( )
A. 为反应物储藏的总能量
B. 若可使用催化剂,则、都减小
C. 该反应放热,在常温常压下即可进行
D. 该反应的热化学方程式为:
下列实验设计能够完成且结论合理的是( )
A. 可用玻璃棒蘸取氯水点在试纸上,待变色后和标准比色卡比较测出氯水的
B. 向悬浊液中滴滴稀溶液,产生黑色沉淀,证明的溶解度大于
C. 将稀溶液缓慢倒入盛有等量盐酸的烧杯中,记录温度可测定中和热
D. 将少量溴水滴加入苯酚溶液中,未见到白色沉淀,表明苯酚已经变质
反应,下列说法正确的是( )
A. 该反应在任何条件下都能自发进行
B. 反应达平衡后再通入,的体积分数一定增加
C. 反应在高温、催化剂条件下进行可提高的平衡转化率
D. 和所含键能总和比所含键能小
氨气中氢含量高,是一种优良的小分子储氢载体。利用太阳能电池电解得到高纯的装置如图所示。下列说法正确的是( )
A. 该装置工作时,只发生两种形式能量的转化
B. 电解过程中由极区向极区迁移
C. 电解时极区溶液中减少
D. 电解过程中参与反应,得到个电子
海水中主要含有、、、、、、等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A. 海水约为的原因主要是天然海水中的发生水解反应
B. 吸收塔中发生的反应中有:
C. 氧化主要是氧气将、、氧化为
D. 可用酸性溶液或溶液检验脱硫后的烟气是否还有
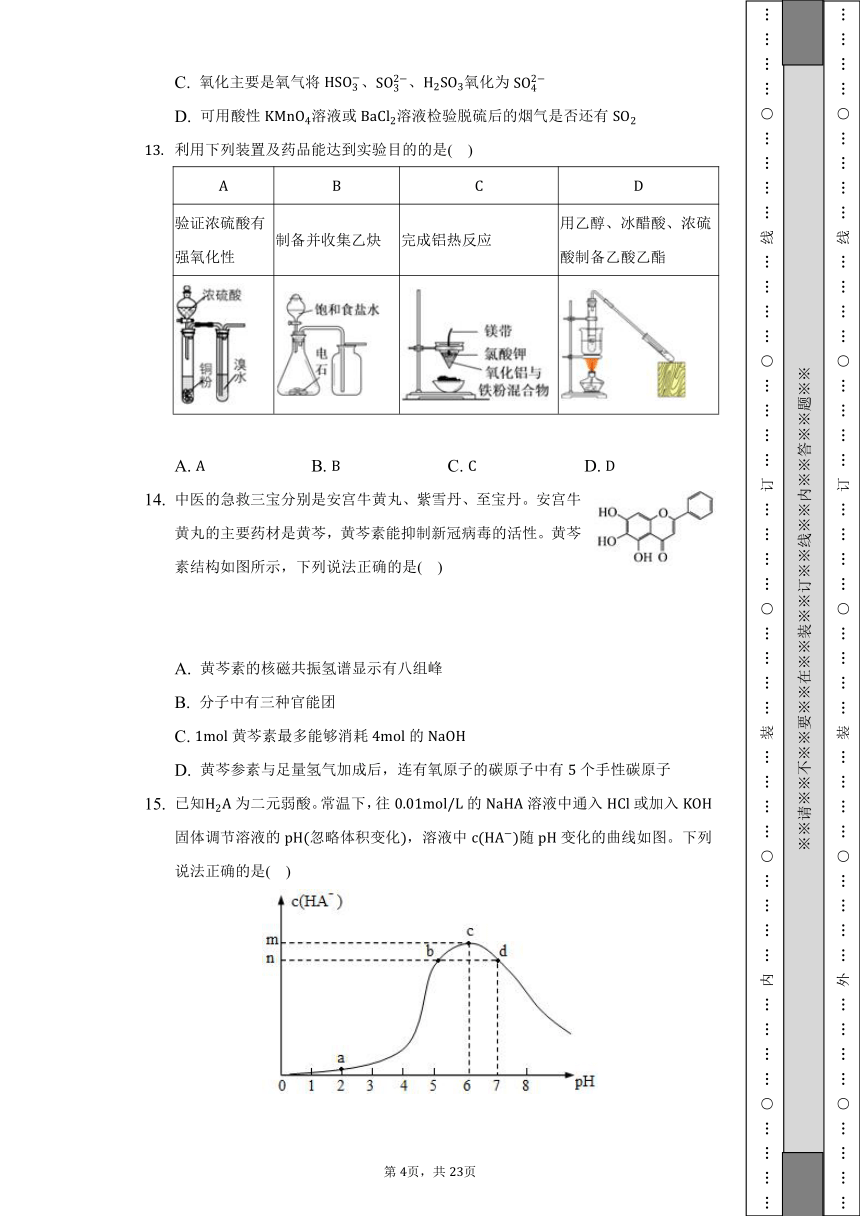
利用下列装置及药品能达到实验目的的是( )
验证浓硫酸有强氧化性 制备并收集乙炔 完成铝热反应 用乙醇、冰醋酸、浓硫酸制备乙酸乙酯
A. B. C. D.
中医的急救三宝分别是安宫牛黄丸、紫雪丹、至宝丹。安宫牛黄丸的主要药材是黄芩,黄芩素能抑制新冠病毒的活性。黄芩素结构如图所示,下列说法正确的是( )
A. 黄芩素的核磁共振氢谱显示有八组峰
B. 分子中有三种官能团
C. 黄芩素最多能够消耗的
D. 黄芩参素与足量氢气加成后,连有氧原子的碳原子中有个手性碳原子
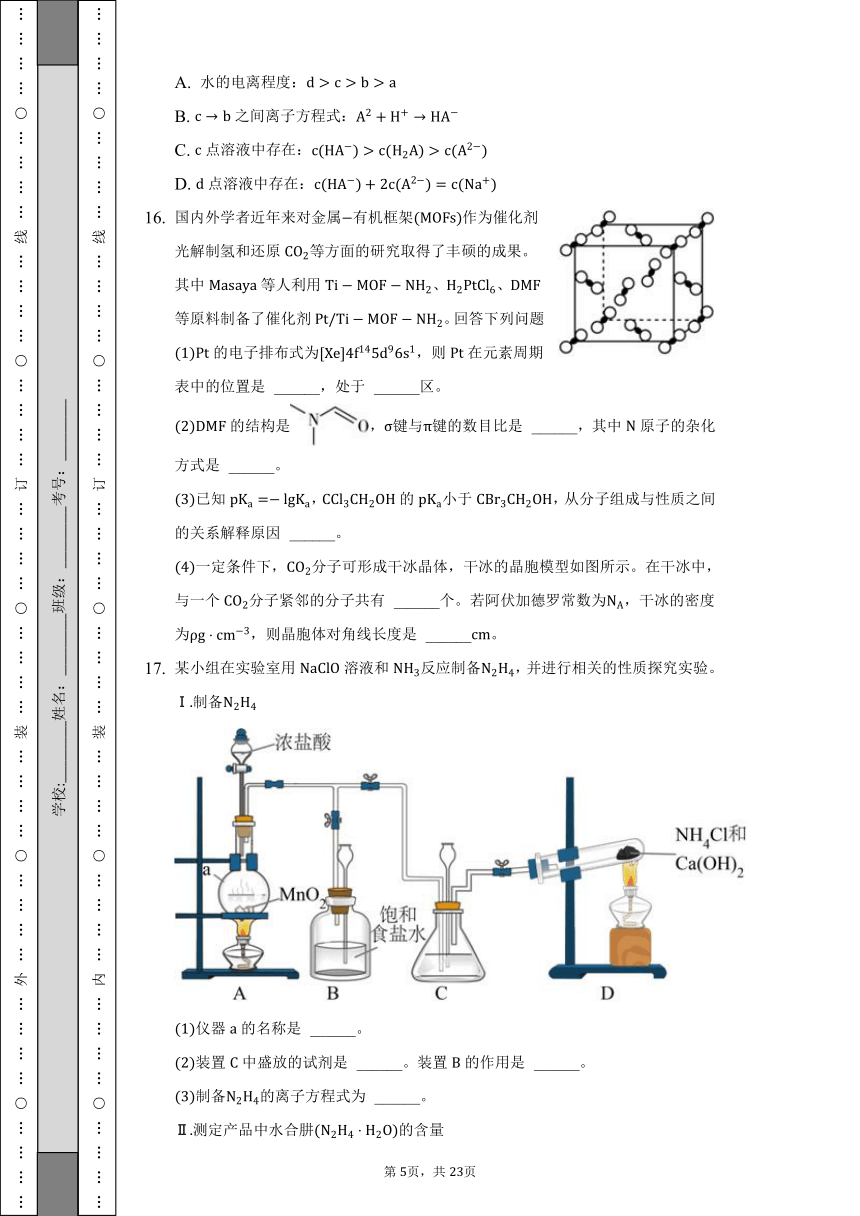
已知为二元弱酸。常温下,往的溶液中通入或加入固体调节溶液的忽略体积变化,溶液中随变化的曲线如图。下列说法正确的是( )
A. 水的电离程度:
B. 之间离子方程式:
C. 点溶液中存在:
D. 点溶液中存在:
国内外学者近年来对金属有机框架作为催化剂光解制氢和还原等方面的研究取得了丰硕的成果。其中等人利用、、等原料制备了催化剂。回答下列问题:
的电子排布式为,则在元素周期表中的位置是 ______,处于 ______区。
的结构是,键与键的数目比是 ______,其中原子的杂化方式是 ______。
已知,的小于,从分子组成与性质之间的关系解释原因 ______。
一定条件下,分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个分子紧邻的分子共有 ______个。若阿伏加德罗常数为,干冰的密度为,则晶胞体对角线长度是 ______。
某小组在实验室用溶液和反应制备,并进行相关的性质探究实验。
Ⅰ制备
仪器的名称是 ______。
装置中盛放的试剂是 ______。装置的作用是 ______。
制备的离子方程式为 ______。
Ⅱ测定产品中水合肼的含量
称取产品,加入适量固体滴定过程中,调节溶液的保持在左右,加水配成溶液,移取置于锥形瓶中,并滴加滴淀粉溶液,用的碘标准溶液滴定已知:。
滴定到达终点的现象是 ______。
实验测得消耗碘标准溶液的平均值为,计算产品中水合腓的质量分数 ______。
铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏主要成分为、,还有少量、、制备的流程如图:
回答下列问题:
步骤将废铅膏研磨过筛的目的是 ______。
向废铅膏粉中加入溶液可将转化为,反应的离子方程式是 ______。
溶液中主要含有的阴离子有、______。
为使完全沉淀并获得纯净的,需向溶液Ⅱ中分两次加入溶液。第一次加入的目的是 ______,过滤后,第二次加入溶液调节溶液的至少为 ______已知:,,。
是主要的温室气体之一,可利用和的反应生成,减少温室气体排放的同时提供能量物质。
Ⅰ
Ⅱ
和的反应生成的热化学方程式Ⅲ为______。
下列描述能说明反应Ⅰ在密闭恒压容器中达到平衡状态的是______。填选项序号
体系压强不变
混合气体密度不变
质量保持不变
温度为时向容积为的密闭容器中投入和发生反应Ⅲ反应达到平衡时,测得各组分的休积分数如表。
______,的转化率为______。
时反应Ⅲ的平衡常数______。
若要增大甲醇的产率,可采取的措施为______。任写两点
反应Ⅰ、Ⅱ、Ⅲ共存的体系中,升高温度的体积分数并未发生明显变化,原因是______。
将反应Ⅲ设计成如图所示的原电池,气体为______,写出原电池正极的电极反应式______。
化合物是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
的分子式 ______;的反应类型 ______。
的含氧官能团名称 ______;中氮的杂化方式 ______。
的结构简式 ______。
反应中乙醇可能发生的副反应方程式 ______。
的一种同分异构体同时满足下列条件,写出任意一种该同分异构体的结构简式 ______。
分子中含有苯环;
不能与反应生成;
含有手性碳原子。
答案和解析
1.【答案】
【解析】解:聚酯纤维在碱性环境下易发生水解反应,所以市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤,故A正确;
B.氮化硼陶瓷基复合材料,属于新型无机非金属材料,故B正确;
C.制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型无机非金属材料,故C错误;
D.依据“南风大起,则一宵结成”可知,该过程通过蒸发水分得到固体,为蒸发结晶的操作,故D正确;
故选:。
A.聚酯纤维在碱性环境下易发生水解反应;
B.氮化硼陶瓷基复合材料,属于新型无机非金属材料;
C.碳纤维属于碳的单质,为无机物;
D.依据“南风大起,则一宵结成”判断。
本题考查了化学与生活有关知识,熟悉相关物质的组成和性质是解题关键,题目难度中等,注意对相关知识的积累。
2.【答案】
【解析】解:.是的一种,质子数为,电子数为,核外电子分层排布,其结构示意图为,故A错误;
B.水晶的主要成分是二氧化硅,由硅、氧原子直接构成,不存在分子,化学式为,故B错误;
C.甲基的结构简式为,碳原子和氢原子共用对电子,碳原子最外层电子数为,其电子式为,故C错误;
D.石炭酸是苯酚的俗名,结构简式为,分子式和最简式均为,故D正确;
故选:。
A.的的质子数是,不是;
B.水晶的主要成分是二氧化硅,不存在分子;
C.甲基含有个单电子,最外层电子数为;
D.石炭酸是苯酚的俗名,结构简式为。
本题考查了常见化学用语的表示方法,涉及最简式、电子式、化学式及分子式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力,题目难度不大。
3.【答案】
【解析】解:泡沫灭火器工作原理的离子方程式为:,故A错误;
B.用纯碱溶液富集离子方程式为:,故B错误;
C.往锅炉注入溶液浸泡,将水垢中的转化为,同时生成硫酸钠,则反应的离子方程式为,故C正确;
D.溶液中逐滴滴入至溶液呈中性,离子方程式为:,故D错误;
故选:。
A.铝离子与碳酸氢根离子发生双水解反应;
B.纯碱是碳酸钠;
C.往锅炉注入溶液浸泡,将水垢中的转化为,同时生成硫酸钠;
D.二者物质的量之比为:。
本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大。
4.【答案】
【解析】解:硝酸铵溶液中存在物料守恒:,故A正确;
B.在的乙醇溶液中,乙醇含有的原子的物质的量,而乙醇溶液中除了乙醇外,水也含原子,则水中含有的原子的物质的量,故此溶液中共含原子为,即个,故B错误;
C.个新戊烷含有个非极性共价键,新戊烷含有非极性共价键数目为,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则转移的电子数小于个,故D错误;
故选:。
A.依据物料守恒判断;
B.乙醇水溶液中,乙醇分子中、水分子中都含有氧原子;
C.个新戊烷含有个非极性共价键;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应。
本题考查了物质的量和阿伏加德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键。
5.【答案】
【解析】解:与都表示甲酸甲酯,是同一种物质,不互为同分异构体,故A错误;
B.乙醇和甘油都含有羟基,属于醇类,故B正确;
C.为烯烃,被氢气加成生成烷烃,主碳链个碳,离取代基近的一端编号得到名称:甲基戊烷,故C正确;
D.苯和乙烯的所有原子都在同一平面上,苯环也是平面结构,故苯和乙烯的所有原子都在同一平面上,故D正确;
故选:。
A.分子式相同,结构不同的物质互为同分异构体;
B.含有羟基的有机物属于醇类;
C.为烯烃,被氢气加成生成烷烃,主碳链个碳,离取代基近的一端编号得到名称;
D.苯和乙烯的所有原子都在同一平面上,苯环也是平面结构。
本题综合考查物质的分类、同分异构体及有机基本反应,为高频考点,侧重考查学生的分析能力和双基的掌握,注重相关概念的辨识,题目难度不大。
6.【答案】
【解析】解;由上述分析可知,为、为、为、为、为;
A.第一电离能:,即,故A正确;
B.电子层越多、原子半径越大,同周期,从左向右原子半径减小,则原子半径:,即,故B错误;
C.元素非金属性越强气态氢化物的稳定性越强,非金属性,则气态氢化物的稳定性:,故C正确;
D.分子即中含有极性共价键和非极性共价键,故D正确;
故选:。
元素是宇宙中含量最多的元素,为;元素、乙、原子序数依次增大,且均位于的下一周期,即位于第二周期,由化合物中化学键可知,为、为、为;元素的原子比原子多个质子,的质子数为,为。
本题考查原子结构与元素周期律,结合原子序数、物质结构来推断元素为解答关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
7.【答案】
【解析】解:中阴离子是,其中心原子价层电子对数是,原子上无孤对电子,因此的空间构型为正四面体形,故A错误;
B.配离子为,配位体是和,配位数为,故B错误;
C.铁时号元素,价层电子排布式是,故C错误;
D.分子中原子与个原子形成对共用电子对,但由于原子上还存在对孤电子对,所以的模型为四面球型空间结构为形,故D正确;
故选:。
A.该配合物中阴离子是,其中心原子价层电子对数是,原子上无孤对电子;
B.配离子为,配位体是和;
C.价层电子排布式是;
D.分子中原子与个原子形成对共用电子对。
本题考查配合物、微粒空间构型判断等知识点,侧重考查基础知识的掌握和灵活运用能力,明确配合物中配位数的判断方法、微粒空间结构判断方法是解本题关键,题目难度不大。
8.【答案】
【解析】解:为正反应的活化能,不是反应物储藏的总能量,故A错误;
B.催化剂可以降低反应的活化能,则若可使用催化剂,则、都减小,故B正确;
C.该反应反应物的总能量高于产物的总能量,所以该反应为放热反应,但是放热反应在常温常压下不一定就能进行,故C错误;
D.热化学方程式表明物质的聚集状态,不同状态不同能量,故D错误;
故选:。
A.为正反应的活化能;
B.催化剂可以降低反应的活化能;
C.反应条件与反应中能量变化无关;
D.物质的聚集状态未知。
本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学方程式为解答的关键,侧重分析与应用能力的考查,注意物质的聚集状态,题目难度不大。
9.【答案】
【解析】解:氯水能使试纸褪色,所以不能用试纸检验氯水的,可用计测定,故A错误;
B.向悬浊液中滴加滴稀溶液,产生黑色沉淀,反应向溶解度更小的沉淀方向进行,证明的溶解度大于,故B正确;
C.缓慢倒入盛有等量盐酸的烧杯中,导致热量散失,不能测定中和热,故C错误;
D.溴水与苯酚反应生成的三溴苯酚,能溶解在过量的苯酚中,不能证明苯酚已经变质,故D错误;
故选:。
A.氯水具有漂白性;
B.向悬浊液中滴加滴稀溶液,产生黑色沉淀;
C.稍过量,可保证盐酸完全反应,缓慢混合可使热量散失;
D.溴水与苯酚反应生成的三溴苯酚,能溶解在过量的苯酚中。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、难溶电解质、中和热测定、测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
10.【答案】
【解析】解:该反应的,反应正向气体分子数减小,,时反应自发,故该反应低温时自发,故A错误;
B.反应达平衡后再通入,平衡正向移动,三氧化硫的物质的量增加,当氧气通入较少时,三氧化硫的体积分数增大,当氧气通过过多时,混合气的总物质的量增加程度更大,三氧化硫的的体积分数减小,故B错误;
C.反应正向放热,升温,平衡逆向移动,二氧化硫的转化率变小,加入催化剂,平衡不移动,二氧化硫的平衡转化率不变,故C错误;
D.反应正向放热,和所含键能总和比所含键能小,故D正确;
故选:。
A.时反应自发;
B.体系种物质体积分数由物质自身的物质的量和混合气的总物质的量决定;
C.由外界条件改变对平衡的影响判断;
D.放热反应中反应物的总键能小于生成物的总键能。
本题考查反应中的热量变化和化学平衡,题目难度中等,掌握外界条件改变对化学平衡的影响是解题的关键。
11.【答案】
【解析】解:
A.该装置工作时,实现了光能转化为电能,电能转化为化学能,化学能转化为热能等,故A错误;
B.电解池中,左侧消耗生成,发生氧化反应是阳极,消耗了,右侧水中得电子生成,发生还原反应,是阴极,电极反应中生成,故从右向左移动,由极区向极区迁移,故B正确;
C.是阴极,电极反应中生成,电解时极区溶液中不变,故C错误;
D.阳极是失电子发生氧化反应生成,则电极反应式为,电解过程中参与反应,失去个电子,故D错误;
故选:。
本题考查了电解原理、电极反应、离子移向和电子守恒的计算应用,主要是电解池和能量变化的分析判断,题目难度不大。
12.【答案】
【解析】解:海水约为,说明呈碱性,则应含有,发生,水解呈碱性,故A正确;
B.吸收塔中涉及二氧化硫和水反应生成亚硫酸、亚硫酸与的反应,则存在,故B正确;
C.、、具有还原性,可与氧气发生氧化还原反应,可将、、氧化为,故C正确;
D.二氧化硫与氯化钡溶液不反应,不能用于检验二氧化硫,故D错误。
故选:。
A.海水约为,说明呈碱性,应含有水解呈碱性的阴离子;
B.吸收塔中涉及二氧化硫和水反应生成亚硫酸、亚硫酸与的反应;
C.、、具有还原性,可与氧气发生氧化还原反应;
D.二氧化硫与氯化钡溶液不反应。
本题考查了海水资源的综合利用、物质的分离与提纯等知识,为高考常见题型和高频考点,试题综合性较强,侧重分析能力、知识迁移应用能力的考查,题目难度中等。
13.【答案】
【解析】解:与浓硫酸常温下不反应,图中缺少酒精灯,故A错误;
B.乙炔是密度比空气密度小,不能选图中向下排空气法收集,故B错误;
C.不能与氧化铝发生反应,点燃镁条时可与氧化铁发生铝热反应,故C错误;
D.乙醇、冰醋酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,图中装置可制备乙酸乙酯,故D正确;
故选:。
A.与浓硫酸常温下不反应;
B.乙炔是密度比空气密度小;
C.不能与氧化铝发生反应;
D.乙醇、冰醋酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
14.【答案】
【解析】解:如图,黄芩素分子中含有种原子,其核磁共振氢谱显示有八组峰,故A正确;
B.黄芩素分子中含有种官能团,分别为酚羟基、酮羰基、醚键和碳碳双键,故B错误;
C.该有机物分子含有的官能团中,只有酚羟基与氢氧化钠溶液反应,黄芩素最多能够消耗的,故C错误;
D.如图,黄芩参素与足量氢气加成后,连有氧原子的碳原子中有个手性碳原子,故D错误;
故选:。
结合图示结构简式可知,黄芩素分子中含有酚羟基、酮羰基、醚键和碳碳双键,具有酚、烯烃、醚、酮的性质,能够发生加成反应、取代反应、氧化反应,以此分析解答。
本题考查有机物结构与性质,为高频考点,明确有机物分子中含有官能团类型为解答关键,注意掌握常见有机物组成、结构与性质,试题侧重考查学生灵活应用基础知识的能力,题目难度不大。
15.【答案】
【解析】解:根据图知,点向左溶液的值减小,应该是通入,点向右为加入固体,溶液的值增大,点为的溶液,点溶液,溶液呈酸性,说明电离程度大于水解程度;
A.酸抑制水电离,酸中越大,水电离程度越小,中性溶液不影响水电离,、、点溶液都呈酸性,且是酸电离导致溶液呈酸性,这三点都抑制水电离,:,点溶液呈中性,不影响水电离,所以水电离程度:,故A正确;
B.之间是向溶液中通入,和反应生成弱电解质,即发生离子反应方程式为,故B错误;
C.点溶液,溶液呈酸性,说明电离程度大于水解程度,但其电离和水解程度都较小,所以存在,故C错误;
D.点溶液,溶液呈中性,,溶液中存在电荷守恒,则存在,故D错误;
故选:。
根据图知,点向左溶液的值减小,应该是通入,点向右为加入固体,溶液的值增大,点为的溶液,点溶液,溶液呈酸性,说明电离程度大于水解程度;
A.酸抑制水电离,酸中越大,水电离程度越小,中性溶液不影响水电离;
B.之间是向溶液中通入,和反应生成弱电解质;
C.点溶液,溶液呈酸性,说明电离程度大于水解程度;
D.点溶液,溶液呈中性,,溶液中存在电荷守恒。
本题考查酸碱混合溶液定性判断,侧重考查图象分析判断及知识综合运用能力,明确图中曲线变化原因、水电离影响因素、溶液中溶质成分及其性质等知识点是解本题关键,注意中易忽略而导致错误判断。
16.【答案】第六周期第Ⅷ族 : 吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于
【解析】解:的电子排布式为,可知在位于周期表中第六周期第Ⅷ族,位于区,
故答案为:第六周期第Ⅷ族;;
的结构是,该分子中含有个键、个键、个中含有个键和个键,所以键与键的数目比是:,原子价层电子对个数是且含有个孤电子对,则原子的杂化方式是,
故答案为::;;
吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于,则的小于,
故答案为:吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于;
在干冰中,与一个分子紧邻的分子个数;该晶胞中分子个数,该晶胞中个数是,晶体密度,,晶胞棱长,晶胞体对角线长度是晶胞棱长的倍,
故答案为:;。
根据的电子排布式为推断在周期表中的位置和分区;
共价单键为键,共价双键中含有个键和个键;原子价层电子对个数是且含有个孤电子对;
卤原子吸引电子能力越强,极性越强,越易电离出氢离子,其酸性越强,电离平衡常数越大,则越小;
在干冰中,与一个分子紧邻的分子个数;该晶胞中分子个数,该晶胞中个数是,晶体密度,,晶胞棱长,晶胞体对角线长度是晶胞棱长的倍。
本题考查物质结构和性质,侧重考查分析、判断及计算能力,明确原子结构、元素周期表结构、原子杂化类型方法、晶胞计算方法是解本题关键,难点是晶胞密度的计算,题目难度中等。
17.【答案】圆底烧瓶 溶液 平衡气压,收集多余氯气 当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色
【解析】解:分析图示可知,仪器的名称是圆底烧瓶,
故答案为:圆底烧瓶;
由以上分析可知,装置中盛放的试剂是溶液;装置的作用是平衡气压,收集多余氯气,
故答案为:溶液;平衡气压,收集多余氯气;
与反应生成、和,离子方程式为:,
故答案为:;
实验中使用淀粉和碘标准溶液,故滴定到达终点的现象是当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色,
故答案为:当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色;
由化学反应方程式可知,,故产品中水合腓的质量分数为,
故答案为:。
二氧化锰和浓盐酸反应生成氯气,通入中与反应生成,中氯化铵与氢氧化钙反应生成氨气,与中反应生成,
分析图示可知,仪器的名称是圆底烧瓶;
由以上分析可知,装置中盛放的试剂是溶液;装置的作用是平衡气压;
与反应生成、和;
实验中使用淀粉和碘标准溶液,故滴定到达终点的现象是当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色;
由化学反应方程式可知,,据此计算。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据实验目的及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
18.【答案】增大反应物接触面积,提高反应速率 、 除去多余的并将转为沉淀除去
【解析】解:步骤将废铅膏研磨过筛的目的是增大反应物接触面积,提高反应速率,
故答案为:增大反应物接触面积,提高反应速率;
加入溶液可将转化为,反应的离子方程式是,
故答案为:;
与反应生成和水,溶液Ⅰ中主要含有的阴离子有、、,
故答案为:、;
加入溶液与发生氧化还原反应生成,与溶液和反应转化为,则转化为的化学方程式是,
故答案为:;
杂质与醋酸反应生成,第一次加入溶液的目的是除去多余的并将转为沉淀除去;过滤除去沉淀后,第二次加入溶液调节溶液的恰好开始沉淀,由溶解平衡:,此时,则,时,调节溶液的至少为,
故答案为:除去多余的并将转为沉淀除去;。
利用废铅蓄电池的铅膏主要成分为、,还有少量、、制备,铅膏研磨过筛,加入可将转化为,反应的离子方程式是,溶液与杂质中反应生成和水,溶液Ⅰ中主要含有的阴离子有、、,加入溶液和溶液可将转化为,化学方程式是,杂质与醋酸反应生成,第一次加入溶液除去杂质铁离子,第二次使完全沉淀并获得纯净的,据此分析解答。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据反应流程及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
19.【答案】 增大压强,降低温度或分离水蒸气 温度变化时,反应和反应平衡移动方向相反,程度相同
【解析】解:和的反应生成的化学方程式,
ⅠⅡ
根据盖斯定律:反应反应计算的焓变,热化学方程式Ⅲ为,
故答案为:;
恒压体系中,体系的压强始终不变,即不能判断反应是否达到平衡,故错误;
反应是气体体积不变的反应,容器的体积不变,各物质均为气体,所以混合气体密度始终不变,即不能判断反应是否达到平衡,故错误;
反应无论是否达到平衡状态,始终有,即不能判断反应是否达到平衡,故错误;
质量保持不变的状态是平衡状态的本质特征,故正确;
故答案为:;
反应:是放热反应,反应三行式为,
起始量
变化量
平衡量
平衡时的休积分数为,则,解得,平衡时,,,
的休积分数,的转化率,
故答案为:;;
平衡常数,
故答案为:;
反应:正向是气体体积减少的放热反应,增大压强、降低温度、分离水蒸气等措施均可使平衡正向移动,提高甲醇的产率,
故答案为:增大压强,降低温度或分离水蒸气;
反应正向吸热,反应正向放热,升高温度时,反应正向进行,反应逆向进行,当二者进行的程度相当时,的体积分数会基本不变,
故答案为:温度变化时,反应和反应平衡移动方向相反,程度相同;
反应:中,发生得电子的还原反应,发生失电子的氧化反应,则通入的电极为正极,通入的电极为负极,结合装置图中电子的流向可知,气体为,气体为,在正极上得电子生成,电极反应式为,
故答案为:;。
和的反应生成的化学方程式,根据盖斯定律:反应反应计算的焓变;
反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到不变时,说明可逆反应到达平衡状态;
反应:是放热反应,反应三行式为,
起始量
变化量
平衡量
平衡时的休积分数为,则,解得,结合休积分数、转化率、平衡常数的公式和化学平衡影响因素解答;
反应正向吸热,反应正向放热,升高温度时,反应正向进行的程度和反应逆向进行的程度相当,导致的体积分数并未发生明显变化;
反应:中,发生得电子的还原反应,发生失电子的氧化反应,则通入的电极为正极,通入的电极为负极,结合装置图中电子的流向可知,气体为,气体为,结合电子和电荷守恒写出正极电极反应式。
本题考查盖斯定律的计算应用、化学平衡的计算、化学平衡状态的判断、化学平衡影响因素和原电池原理的应用等知识,侧重考查分析、计算和运用能力,把握化学平衡的计算、化学平衡影响因素和原电池原理是解题关键,注意三行式格式在化学平衡计算中的应用、结合电解质条件书写书写电极反应式,题目难度中等。
20.【答案】 取代反应 羟基
【解析】解:的分子式;的反应类型取代反应,
故答案为:;取代反应;
的含氧官能团名称羟基;中氮原子价层电子对数是,则原子的杂化方式为,
故答案为:羟基;;
的结构简式为,
故答案为:;
反应中乙醇可能发生的副反应方程式,
故答案为:;
的一种同分异构体同时满足下列条件:
分子中含有苯环;
不能与反应生成,说明不含;
含有手性碳原子,其中一个符合条件的同分异构体结构简式为,
故答案为:。
中羰基发生还原反应生成中醇羟基,中醇羟基发生取代反应生成,发生取代反应生成,发生水解反应然后酸化得到,发生取代反应生成,和乙醇发生酯化反应生成为,中溴原子被取代生成。
本题考查有机推断和有机合成,侧重考查学生分析推理及知识综合应用能力,注意对题目给予信息的理解,熟练掌握官能团的性质与衍变,采用知识迁移、逆向思维方法进行合成路线设计,题目难度中等。
第2页,共2页
第1页,共1页
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
) (
学校:___________姓名:___________班级:___________考号:___________
) (
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
2022-2023学年黑龙江省大庆市高三(上)期中化学试卷
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
化学与生活、生产密切相关。下列说法中错误的是( )
A. 市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤
B. “天和”核心舱其腔体使用的氮化硼陶瓷基复合材料属于无机非金属材料
C. 制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型有机高分子材料
D. “凡引水种盐,待夏秋之交,南风大起,则一宵结成”该过程属于蒸发结晶
下列说法正确的是( )
A. 的结构示意图为 B. 水晶的分子式:
C. 甲基的电子式: D. 石炭酸的最简式:
宏观辨识和微观探析是化学学科的核心素养之一。下列描述物质制备和应用的离子方程式正确的是( )
A. 泡沫灭火器的反应原理:
B. 海水提溴工艺中,用纯碱溶液富集 :
C. 锅炉除垢过程中 转化为:
D. 溶液逐滴滴入溶液中,反应后溶液呈中性:
设为阿伏加德罗常数的值,下列说法正确的是( )
A. 溶液:和粒子数目之和为
B. 质量分数为的乙醇水溶液中氧原子数为
C. 新戊烷含有非极性共价键数目为
D. 含的浓盐酸与足量的加热充分反应,转移的电子数为
下列关于有机物的说法不正确的是( )
A. 与互为同分异构体
B. 乙醇和甘油都属于醇类
C. 经催化加氢后能生成甲基戊烷
D. 苯和乙烯的所有原子都在同一平面上
一种麻醉剂的分子结构式如图所示。其中,元素是宇宙中含量最多的元素;元素、、原子序数依次增大,且都与处于相邻周期;主族元素的原子序数比多。下列说法不正确的是( )
A. 第一电离能:
B. 原子半径:
C. 气态氢化物的稳定性:
D. 分子中含有极性共价键和非极性共价键
已知能被溶液吸收生成配合物。下列说法正确的是( )
A. 该配合物中阴离子为平面正方形
B. 该配合物的配体为,配位数为
C. 的价层电子排布式为,易被氧化为
D. 的模型为四面体型,空间结构为形
溴乙烷与氢氧化钠水溶液反应的能量变化如图所示,下列说法正确的是( )
A. 为反应物储藏的总能量
B. 若可使用催化剂,则、都减小
C. 该反应放热,在常温常压下即可进行
D. 该反应的热化学方程式为:
下列实验设计能够完成且结论合理的是( )
A. 可用玻璃棒蘸取氯水点在试纸上,待变色后和标准比色卡比较测出氯水的
B. 向悬浊液中滴滴稀溶液,产生黑色沉淀,证明的溶解度大于
C. 将稀溶液缓慢倒入盛有等量盐酸的烧杯中,记录温度可测定中和热
D. 将少量溴水滴加入苯酚溶液中,未见到白色沉淀,表明苯酚已经变质
反应,下列说法正确的是( )
A. 该反应在任何条件下都能自发进行
B. 反应达平衡后再通入,的体积分数一定增加
C. 反应在高温、催化剂条件下进行可提高的平衡转化率
D. 和所含键能总和比所含键能小
氨气中氢含量高,是一种优良的小分子储氢载体。利用太阳能电池电解得到高纯的装置如图所示。下列说法正确的是( )
A. 该装置工作时,只发生两种形式能量的转化
B. 电解过程中由极区向极区迁移
C. 电解时极区溶液中减少
D. 电解过程中参与反应,得到个电子
海水中主要含有、、、、、、等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如图所示。下列说法错误的是( )
A. 海水约为的原因主要是天然海水中的发生水解反应
B. 吸收塔中发生的反应中有:
C. 氧化主要是氧气将、、氧化为
D. 可用酸性溶液或溶液检验脱硫后的烟气是否还有
利用下列装置及药品能达到实验目的的是( )
验证浓硫酸有强氧化性 制备并收集乙炔 完成铝热反应 用乙醇、冰醋酸、浓硫酸制备乙酸乙酯
A. B. C. D.
中医的急救三宝分别是安宫牛黄丸、紫雪丹、至宝丹。安宫牛黄丸的主要药材是黄芩,黄芩素能抑制新冠病毒的活性。黄芩素结构如图所示,下列说法正确的是( )
A. 黄芩素的核磁共振氢谱显示有八组峰
B. 分子中有三种官能团
C. 黄芩素最多能够消耗的
D. 黄芩参素与足量氢气加成后,连有氧原子的碳原子中有个手性碳原子
已知为二元弱酸。常温下,往的溶液中通入或加入固体调节溶液的忽略体积变化,溶液中随变化的曲线如图。下列说法正确的是( )
A. 水的电离程度:
B. 之间离子方程式:
C. 点溶液中存在:
D. 点溶液中存在:
国内外学者近年来对金属有机框架作为催化剂光解制氢和还原等方面的研究取得了丰硕的成果。其中等人利用、、等原料制备了催化剂。回答下列问题:
的电子排布式为,则在元素周期表中的位置是 ______,处于 ______区。
的结构是,键与键的数目比是 ______,其中原子的杂化方式是 ______。
已知,的小于,从分子组成与性质之间的关系解释原因 ______。
一定条件下,分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个分子紧邻的分子共有 ______个。若阿伏加德罗常数为,干冰的密度为,则晶胞体对角线长度是 ______。
某小组在实验室用溶液和反应制备,并进行相关的性质探究实验。
Ⅰ制备
仪器的名称是 ______。
装置中盛放的试剂是 ______。装置的作用是 ______。
制备的离子方程式为 ______。
Ⅱ测定产品中水合肼的含量
称取产品,加入适量固体滴定过程中,调节溶液的保持在左右,加水配成溶液,移取置于锥形瓶中,并滴加滴淀粉溶液,用的碘标准溶液滴定已知:。
滴定到达终点的现象是 ______。
实验测得消耗碘标准溶液的平均值为,计算产品中水合腓的质量分数 ______。
铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏主要成分为、,还有少量、、制备的流程如图:
回答下列问题:
步骤将废铅膏研磨过筛的目的是 ______。
向废铅膏粉中加入溶液可将转化为,反应的离子方程式是 ______。
溶液中主要含有的阴离子有、______。
为使完全沉淀并获得纯净的,需向溶液Ⅱ中分两次加入溶液。第一次加入的目的是 ______,过滤后,第二次加入溶液调节溶液的至少为 ______已知:,,。
是主要的温室气体之一,可利用和的反应生成,减少温室气体排放的同时提供能量物质。
Ⅰ
Ⅱ
和的反应生成的热化学方程式Ⅲ为______。
下列描述能说明反应Ⅰ在密闭恒压容器中达到平衡状态的是______。填选项序号
体系压强不变
混合气体密度不变
质量保持不变
温度为时向容积为的密闭容器中投入和发生反应Ⅲ反应达到平衡时,测得各组分的休积分数如表。
______,的转化率为______。
时反应Ⅲ的平衡常数______。
若要增大甲醇的产率,可采取的措施为______。任写两点
反应Ⅰ、Ⅱ、Ⅲ共存的体系中,升高温度的体积分数并未发生明显变化,原因是______。
将反应Ⅲ设计成如图所示的原电池,气体为______,写出原电池正极的电极反应式______。
化合物是制备药物洛索洛芬钠的关键中间体,其一种合成路线如图:
的分子式 ______;的反应类型 ______。
的含氧官能团名称 ______;中氮的杂化方式 ______。
的结构简式 ______。
反应中乙醇可能发生的副反应方程式 ______。
的一种同分异构体同时满足下列条件,写出任意一种该同分异构体的结构简式 ______。
分子中含有苯环;
不能与反应生成;
含有手性碳原子。
答案和解析
1.【答案】
【解析】解:聚酯纤维在碱性环境下易发生水解反应,所以市面上的防晒衣通常采用聚酯纤维材料制作,忌长期用肥皂洗涤,故A正确;
B.氮化硼陶瓷基复合材料,属于新型无机非金属材料,故B正确;
C.制作“嫦娥”太空飞行器使用的碳纤维复合材料是一种新型无机非金属材料,故C错误;
D.依据“南风大起,则一宵结成”可知,该过程通过蒸发水分得到固体,为蒸发结晶的操作,故D正确;
故选:。
A.聚酯纤维在碱性环境下易发生水解反应;
B.氮化硼陶瓷基复合材料,属于新型无机非金属材料;
C.碳纤维属于碳的单质,为无机物;
D.依据“南风大起,则一宵结成”判断。
本题考查了化学与生活有关知识,熟悉相关物质的组成和性质是解题关键,题目难度中等,注意对相关知识的积累。
2.【答案】
【解析】解:.是的一种,质子数为,电子数为,核外电子分层排布,其结构示意图为,故A错误;
B.水晶的主要成分是二氧化硅,由硅、氧原子直接构成,不存在分子,化学式为,故B错误;
C.甲基的结构简式为,碳原子和氢原子共用对电子,碳原子最外层电子数为,其电子式为,故C错误;
D.石炭酸是苯酚的俗名,结构简式为,分子式和最简式均为,故D正确;
故选:。
A.的的质子数是,不是;
B.水晶的主要成分是二氧化硅,不存在分子;
C.甲基含有个单电子,最外层电子数为;
D.石炭酸是苯酚的俗名,结构简式为。
本题考查了常见化学用语的表示方法,涉及最简式、电子式、化学式及分子式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力,题目难度不大。
3.【答案】
【解析】解:泡沫灭火器工作原理的离子方程式为:,故A错误;
B.用纯碱溶液富集离子方程式为:,故B错误;
C.往锅炉注入溶液浸泡,将水垢中的转化为,同时生成硫酸钠,则反应的离子方程式为,故C正确;
D.溶液中逐滴滴入至溶液呈中性,离子方程式为:,故D错误;
故选:。
A.铝离子与碳酸氢根离子发生双水解反应;
B.纯碱是碳酸钠;
C.往锅炉注入溶液浸泡,将水垢中的转化为,同时生成硫酸钠;
D.二者物质的量之比为:。
本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大。
4.【答案】
【解析】解:硝酸铵溶液中存在物料守恒:,故A正确;
B.在的乙醇溶液中,乙醇含有的原子的物质的量,而乙醇溶液中除了乙醇外,水也含原子,则水中含有的原子的物质的量,故此溶液中共含原子为,即个,故B错误;
C.个新戊烷含有个非极性共价键,新戊烷含有非极性共价键数目为,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,故浓盐酸不能反应完全,则转移的电子数小于个,故D错误;
故选:。
A.依据物料守恒判断;
B.乙醇水溶液中,乙醇分子中、水分子中都含有氧原子;
C.个新戊烷含有个非极性共价键;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应。
本题考查了物质的量和阿伏加德罗常数的有关计算,难度不大,掌握公式的运用和物质的结构是解题关键。
5.【答案】
【解析】解:与都表示甲酸甲酯,是同一种物质,不互为同分异构体,故A错误;
B.乙醇和甘油都含有羟基,属于醇类,故B正确;
C.为烯烃,被氢气加成生成烷烃,主碳链个碳,离取代基近的一端编号得到名称:甲基戊烷,故C正确;
D.苯和乙烯的所有原子都在同一平面上,苯环也是平面结构,故苯和乙烯的所有原子都在同一平面上,故D正确;
故选:。
A.分子式相同,结构不同的物质互为同分异构体;
B.含有羟基的有机物属于醇类;
C.为烯烃,被氢气加成生成烷烃,主碳链个碳,离取代基近的一端编号得到名称;
D.苯和乙烯的所有原子都在同一平面上,苯环也是平面结构。
本题综合考查物质的分类、同分异构体及有机基本反应,为高频考点,侧重考查学生的分析能力和双基的掌握,注重相关概念的辨识,题目难度不大。
6.【答案】
【解析】解;由上述分析可知,为、为、为、为、为;
A.第一电离能:,即,故A正确;
B.电子层越多、原子半径越大,同周期,从左向右原子半径减小,则原子半径:,即,故B错误;
C.元素非金属性越强气态氢化物的稳定性越强,非金属性,则气态氢化物的稳定性:,故C正确;
D.分子即中含有极性共价键和非极性共价键,故D正确;
故选:。
元素是宇宙中含量最多的元素,为;元素、乙、原子序数依次增大,且均位于的下一周期,即位于第二周期,由化合物中化学键可知,为、为、为;元素的原子比原子多个质子,的质子数为,为。
本题考查原子结构与元素周期律,结合原子序数、物质结构来推断元素为解答关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
7.【答案】
【解析】解:中阴离子是,其中心原子价层电子对数是,原子上无孤对电子,因此的空间构型为正四面体形,故A错误;
B.配离子为,配位体是和,配位数为,故B错误;
C.铁时号元素,价层电子排布式是,故C错误;
D.分子中原子与个原子形成对共用电子对,但由于原子上还存在对孤电子对,所以的模型为四面球型空间结构为形,故D正确;
故选:。
A.该配合物中阴离子是,其中心原子价层电子对数是,原子上无孤对电子;
B.配离子为,配位体是和;
C.价层电子排布式是;
D.分子中原子与个原子形成对共用电子对。
本题考查配合物、微粒空间构型判断等知识点,侧重考查基础知识的掌握和灵活运用能力,明确配合物中配位数的判断方法、微粒空间结构判断方法是解本题关键,题目难度不大。
8.【答案】
【解析】解:为正反应的活化能,不是反应物储藏的总能量,故A错误;
B.催化剂可以降低反应的活化能,则若可使用催化剂,则、都减小,故B正确;
C.该反应反应物的总能量高于产物的总能量,所以该反应为放热反应,但是放热反应在常温常压下不一定就能进行,故C错误;
D.热化学方程式表明物质的聚集状态,不同状态不同能量,故D错误;
故选:。
A.为正反应的活化能;
B.催化剂可以降低反应的活化能;
C.反应条件与反应中能量变化无关;
D.物质的聚集状态未知。
本题考查反应热与焓变,为高频考点,把握反应中能量变化、热化学方程式为解答的关键,侧重分析与应用能力的考查,注意物质的聚集状态,题目难度不大。
9.【答案】
【解析】解:氯水能使试纸褪色,所以不能用试纸检验氯水的,可用计测定,故A错误;
B.向悬浊液中滴加滴稀溶液,产生黑色沉淀,反应向溶解度更小的沉淀方向进行,证明的溶解度大于,故B正确;
C.缓慢倒入盛有等量盐酸的烧杯中,导致热量散失,不能测定中和热,故C错误;
D.溴水与苯酚反应生成的三溴苯酚,能溶解在过量的苯酚中,不能证明苯酚已经变质,故D错误;
故选:。
A.氯水具有漂白性;
B.向悬浊液中滴加滴稀溶液,产生黑色沉淀;
C.稍过量,可保证盐酸完全反应,缓慢混合可使热量散失;
D.溴水与苯酚反应生成的三溴苯酚,能溶解在过量的苯酚中。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、难溶电解质、中和热测定、测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
10.【答案】
【解析】解:该反应的,反应正向气体分子数减小,,时反应自发,故该反应低温时自发,故A错误;
B.反应达平衡后再通入,平衡正向移动,三氧化硫的物质的量增加,当氧气通入较少时,三氧化硫的体积分数增大,当氧气通过过多时,混合气的总物质的量增加程度更大,三氧化硫的的体积分数减小,故B错误;
C.反应正向放热,升温,平衡逆向移动,二氧化硫的转化率变小,加入催化剂,平衡不移动,二氧化硫的平衡转化率不变,故C错误;
D.反应正向放热,和所含键能总和比所含键能小,故D正确;
故选:。
A.时反应自发;
B.体系种物质体积分数由物质自身的物质的量和混合气的总物质的量决定;
C.由外界条件改变对平衡的影响判断;
D.放热反应中反应物的总键能小于生成物的总键能。
本题考查反应中的热量变化和化学平衡,题目难度中等,掌握外界条件改变对化学平衡的影响是解题的关键。
11.【答案】
【解析】解:
A.该装置工作时,实现了光能转化为电能,电能转化为化学能,化学能转化为热能等,故A错误;
B.电解池中,左侧消耗生成,发生氧化反应是阳极,消耗了,右侧水中得电子生成,发生还原反应,是阴极,电极反应中生成,故从右向左移动,由极区向极区迁移,故B正确;
C.是阴极,电极反应中生成,电解时极区溶液中不变,故C错误;
D.阳极是失电子发生氧化反应生成,则电极反应式为,电解过程中参与反应,失去个电子,故D错误;
故选:。
本题考查了电解原理、电极反应、离子移向和电子守恒的计算应用,主要是电解池和能量变化的分析判断,题目难度不大。
12.【答案】
【解析】解:海水约为,说明呈碱性,则应含有,发生,水解呈碱性,故A正确;
B.吸收塔中涉及二氧化硫和水反应生成亚硫酸、亚硫酸与的反应,则存在,故B正确;
C.、、具有还原性,可与氧气发生氧化还原反应,可将、、氧化为,故C正确;
D.二氧化硫与氯化钡溶液不反应,不能用于检验二氧化硫,故D错误。
故选:。
A.海水约为,说明呈碱性,应含有水解呈碱性的阴离子;
B.吸收塔中涉及二氧化硫和水反应生成亚硫酸、亚硫酸与的反应;
C.、、具有还原性,可与氧气发生氧化还原反应;
D.二氧化硫与氯化钡溶液不反应。
本题考查了海水资源的综合利用、物质的分离与提纯等知识,为高考常见题型和高频考点,试题综合性较强,侧重分析能力、知识迁移应用能力的考查,题目难度中等。
13.【答案】
【解析】解:与浓硫酸常温下不反应,图中缺少酒精灯,故A错误;
B.乙炔是密度比空气密度小,不能选图中向下排空气法收集,故B错误;
C.不能与氧化铝发生反应,点燃镁条时可与氧化铁发生铝热反应,故C错误;
D.乙醇、冰醋酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,图中装置可制备乙酸乙酯,故D正确;
故选:。
A.与浓硫酸常温下不反应;
B.乙炔是密度比空气密度小;
C.不能与氧化铝发生反应;
D.乙醇、冰醋酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
14.【答案】
【解析】解:如图,黄芩素分子中含有种原子,其核磁共振氢谱显示有八组峰,故A正确;
B.黄芩素分子中含有种官能团,分别为酚羟基、酮羰基、醚键和碳碳双键,故B错误;
C.该有机物分子含有的官能团中,只有酚羟基与氢氧化钠溶液反应,黄芩素最多能够消耗的,故C错误;
D.如图,黄芩参素与足量氢气加成后,连有氧原子的碳原子中有个手性碳原子,故D错误;
故选:。
结合图示结构简式可知,黄芩素分子中含有酚羟基、酮羰基、醚键和碳碳双键,具有酚、烯烃、醚、酮的性质,能够发生加成反应、取代反应、氧化反应,以此分析解答。
本题考查有机物结构与性质,为高频考点,明确有机物分子中含有官能团类型为解答关键,注意掌握常见有机物组成、结构与性质,试题侧重考查学生灵活应用基础知识的能力,题目难度不大。
15.【答案】
【解析】解:根据图知,点向左溶液的值减小,应该是通入,点向右为加入固体,溶液的值增大,点为的溶液,点溶液,溶液呈酸性,说明电离程度大于水解程度;
A.酸抑制水电离,酸中越大,水电离程度越小,中性溶液不影响水电离,、、点溶液都呈酸性,且是酸电离导致溶液呈酸性,这三点都抑制水电离,:,点溶液呈中性,不影响水电离,所以水电离程度:,故A正确;
B.之间是向溶液中通入,和反应生成弱电解质,即发生离子反应方程式为,故B错误;
C.点溶液,溶液呈酸性,说明电离程度大于水解程度,但其电离和水解程度都较小,所以存在,故C错误;
D.点溶液,溶液呈中性,,溶液中存在电荷守恒,则存在,故D错误;
故选:。
根据图知,点向左溶液的值减小,应该是通入,点向右为加入固体,溶液的值增大,点为的溶液,点溶液,溶液呈酸性,说明电离程度大于水解程度;
A.酸抑制水电离,酸中越大,水电离程度越小,中性溶液不影响水电离;
B.之间是向溶液中通入,和反应生成弱电解质;
C.点溶液,溶液呈酸性,说明电离程度大于水解程度;
D.点溶液,溶液呈中性,,溶液中存在电荷守恒。
本题考查酸碱混合溶液定性判断,侧重考查图象分析判断及知识综合运用能力,明确图中曲线变化原因、水电离影响因素、溶液中溶质成分及其性质等知识点是解本题关键,注意中易忽略而导致错误判断。
16.【答案】第六周期第Ⅷ族 : 吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于
【解析】解:的电子排布式为,可知在位于周期表中第六周期第Ⅷ族,位于区,
故答案为:第六周期第Ⅷ族;;
的结构是,该分子中含有个键、个键、个中含有个键和个键,所以键与键的数目比是:,原子价层电子对个数是且含有个孤电子对,则原子的杂化方式是,
故答案为::;;
吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于,则的小于,
故答案为:吸引电子能力:,的极性大于的极性,则的极性大于,导致电离出氢离子程度:前者大于后者,则酸性:的酸性大于;
在干冰中,与一个分子紧邻的分子个数;该晶胞中分子个数,该晶胞中个数是,晶体密度,,晶胞棱长,晶胞体对角线长度是晶胞棱长的倍,
故答案为:;。
根据的电子排布式为推断在周期表中的位置和分区;
共价单键为键,共价双键中含有个键和个键;原子价层电子对个数是且含有个孤电子对;
卤原子吸引电子能力越强,极性越强,越易电离出氢离子,其酸性越强,电离平衡常数越大,则越小;
在干冰中,与一个分子紧邻的分子个数;该晶胞中分子个数,该晶胞中个数是,晶体密度,,晶胞棱长,晶胞体对角线长度是晶胞棱长的倍。
本题考查物质结构和性质,侧重考查分析、判断及计算能力,明确原子结构、元素周期表结构、原子杂化类型方法、晶胞计算方法是解本题关键,难点是晶胞密度的计算,题目难度中等。
17.【答案】圆底烧瓶 溶液 平衡气压,收集多余氯气 当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色
【解析】解:分析图示可知,仪器的名称是圆底烧瓶,
故答案为:圆底烧瓶;
由以上分析可知,装置中盛放的试剂是溶液;装置的作用是平衡气压,收集多余氯气,
故答案为:溶液;平衡气压,收集多余氯气;
与反应生成、和,离子方程式为:,
故答案为:;
实验中使用淀粉和碘标准溶液,故滴定到达终点的现象是当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色,
故答案为:当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色,且半分钟内不褪色;
由化学反应方程式可知,,故产品中水合腓的质量分数为,
故答案为:。
二氧化锰和浓盐酸反应生成氯气,通入中与反应生成,中氯化铵与氢氧化钙反应生成氨气,与中反应生成,
分析图示可知,仪器的名称是圆底烧瓶;
由以上分析可知,装置中盛放的试剂是溶液;装置的作用是平衡气压;
与反应生成、和;
实验中使用淀粉和碘标准溶液,故滴定到达终点的现象是当加入最后一滴或半滴碘标准溶液时,溶液恰好变为蓝色;
由化学反应方程式可知,,据此计算。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据实验目的及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
18.【答案】增大反应物接触面积,提高反应速率 、 除去多余的并将转为沉淀除去
【解析】解:步骤将废铅膏研磨过筛的目的是增大反应物接触面积,提高反应速率,
故答案为:增大反应物接触面积,提高反应速率;
加入溶液可将转化为,反应的离子方程式是,
故答案为:;
与反应生成和水,溶液Ⅰ中主要含有的阴离子有、、,
故答案为:、;
加入溶液与发生氧化还原反应生成,与溶液和反应转化为,则转化为的化学方程式是,
故答案为:;
杂质与醋酸反应生成,第一次加入溶液的目的是除去多余的并将转为沉淀除去;过滤除去沉淀后,第二次加入溶液调节溶液的恰好开始沉淀,由溶解平衡:,此时,则,时,调节溶液的至少为,
故答案为:除去多余的并将转为沉淀除去;。
利用废铅蓄电池的铅膏主要成分为、,还有少量、、制备,铅膏研磨过筛,加入可将转化为,反应的离子方程式是,溶液与杂质中反应生成和水,溶液Ⅰ中主要含有的阴离子有、、,加入溶液和溶液可将转化为,化学方程式是,杂质与醋酸反应生成,第一次加入溶液除去杂质铁离子,第二次使完全沉淀并获得纯净的,据此分析解答。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据反应流程及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
19.【答案】 增大压强,降低温度或分离水蒸气 温度变化时,反应和反应平衡移动方向相反,程度相同
【解析】解:和的反应生成的化学方程式,
ⅠⅡ
根据盖斯定律:反应反应计算的焓变,热化学方程式Ⅲ为,
故答案为:;
恒压体系中,体系的压强始终不变,即不能判断反应是否达到平衡,故错误;
反应是气体体积不变的反应,容器的体积不变,各物质均为气体,所以混合气体密度始终不变,即不能判断反应是否达到平衡,故错误;
反应无论是否达到平衡状态,始终有,即不能判断反应是否达到平衡,故错误;
质量保持不变的状态是平衡状态的本质特征,故正确;
故答案为:;
反应:是放热反应,反应三行式为,
起始量
变化量
平衡量
平衡时的休积分数为,则,解得,平衡时,,,
的休积分数,的转化率,
故答案为:;;
平衡常数,
故答案为:;
反应:正向是气体体积减少的放热反应,增大压强、降低温度、分离水蒸气等措施均可使平衡正向移动,提高甲醇的产率,
故答案为:增大压强,降低温度或分离水蒸气;
反应正向吸热,反应正向放热,升高温度时,反应正向进行,反应逆向进行,当二者进行的程度相当时,的体积分数会基本不变,
故答案为:温度变化时,反应和反应平衡移动方向相反,程度相同;
反应:中,发生得电子的还原反应,发生失电子的氧化反应,则通入的电极为正极,通入的电极为负极,结合装置图中电子的流向可知,气体为,气体为,在正极上得电子生成,电极反应式为,
故答案为:;。
和的反应生成的化学方程式,根据盖斯定律:反应反应计算的焓变;
反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到不变时,说明可逆反应到达平衡状态;
反应:是放热反应,反应三行式为,
起始量
变化量
平衡量
平衡时的休积分数为,则,解得,结合休积分数、转化率、平衡常数的公式和化学平衡影响因素解答;
反应正向吸热,反应正向放热,升高温度时,反应正向进行的程度和反应逆向进行的程度相当,导致的体积分数并未发生明显变化;
反应:中,发生得电子的还原反应,发生失电子的氧化反应,则通入的电极为正极,通入的电极为负极,结合装置图中电子的流向可知,气体为,气体为,结合电子和电荷守恒写出正极电极反应式。
本题考查盖斯定律的计算应用、化学平衡的计算、化学平衡状态的判断、化学平衡影响因素和原电池原理的应用等知识,侧重考查分析、计算和运用能力,把握化学平衡的计算、化学平衡影响因素和原电池原理是解题关键,注意三行式格式在化学平衡计算中的应用、结合电解质条件书写书写电极反应式,题目难度中等。
20.【答案】 取代反应 羟基
【解析】解:的分子式;的反应类型取代反应,
故答案为:;取代反应;
的含氧官能团名称羟基;中氮原子价层电子对数是,则原子的杂化方式为,
故答案为:羟基;;
的结构简式为,
故答案为:;
反应中乙醇可能发生的副反应方程式,
故答案为:;
的一种同分异构体同时满足下列条件:
分子中含有苯环;
不能与反应生成,说明不含;
含有手性碳原子,其中一个符合条件的同分异构体结构简式为,
故答案为:。
中羰基发生还原反应生成中醇羟基,中醇羟基发生取代反应生成,发生取代反应生成,发生水解反应然后酸化得到,发生取代反应生成,和乙醇发生酯化反应生成为,中溴原子被取代生成。
本题考查有机推断和有机合成,侧重考查学生分析推理及知识综合应用能力,注意对题目给予信息的理解,熟练掌握官能团的性质与衍变,采用知识迁移、逆向思维方法进行合成路线设计,题目难度中等。
第2页,共2页
第1页,共1页
同课章节目录
