化学人教版(2019)选择性必修1 3.3.2 盐类的水解(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.2 盐类的水解(共24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 998.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 18:19:28 | ||
图片预览




文档简介
(共24张PPT)
3.3.2 盐类的水解
1.写出下列溶液中存在的化学平衡:
(1)FeCl3溶液:
。
(2)NaHCO3溶液:
。
2.根据生活常识我们知道,热的纯碱溶液去污能力更强,这说明加热后Na2CO3溶液的碱性 。
3.Na2CO3发生水解后,溶液中粒子数目比水解前 (填“增多”“减少”或“不变”)。
4.水解呈酸性的盐溶液与水解呈碱性的盐溶液混合后,两种盐的水解程度会 (填“增大”“减小”或“不变”)。
增强
增多
增大
知识回顾
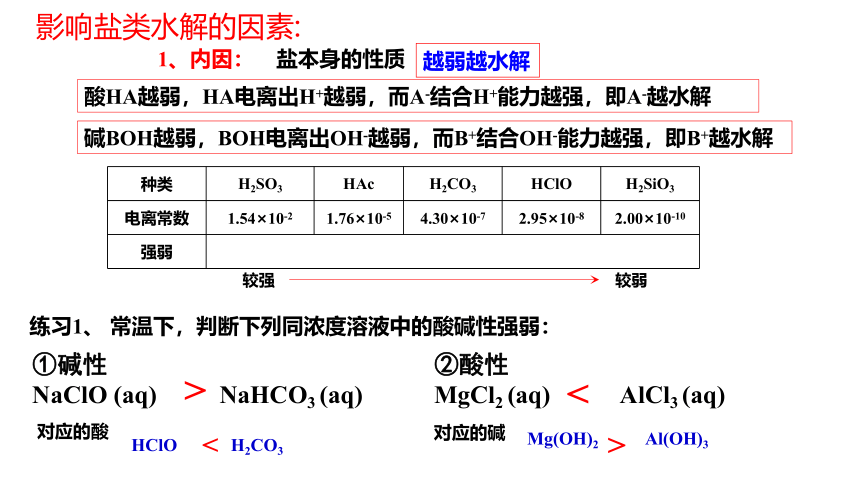
1、内因:
盐本身的性质
越弱越水解
酸HA越弱,HA电离出H+越弱,而A-结合H+能力越强,即A-越水解
碱BOH越弱,BOH电离出OH-越弱,而B+结合OH-能力越强,即B+越水解
种类 H2SO3 HAc H2CO3 HClO H2SiO3
电离常数 1.54×10-2 1.76×10-5 4.30×10-7 2.95×10-8 2.00×10-10
强弱
较强 较弱
练习1、 常温下,判断下列同浓度溶液中的酸碱性强弱:
①碱性
NaClO (aq) NaHCO3 (aq)
②酸性
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
对应的碱
Mg(OH)2 Al(OH)3
>
<
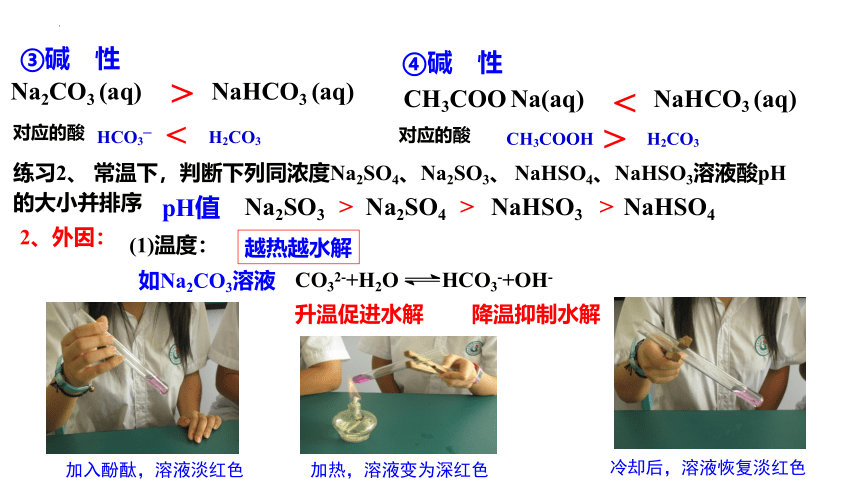
影响盐类水解的因素:
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
③碱 性
>
练习2、 常温下,判断下列同浓度Na2SO4、Na2SO3、 NaHSO4、NaHSO3溶液酸pH的大小并排序
pH值
Na2SO3 Na2SO4 NaHSO3 NaHSO4
> > >
CH3COO Na(aq) NaHCO3 (aq)
对应的酸
CH3COOH H2CO3
④碱 性
<
>
2、外因:
(1)温度:
越热越水解
如Na2CO3溶液
CO32-+H2O HCO3-+OH-
升温促进水解
降温抑制水解
加入酚酞,溶液淡红色
加热,溶液变为深红色
冷却后,溶液恢复淡红色
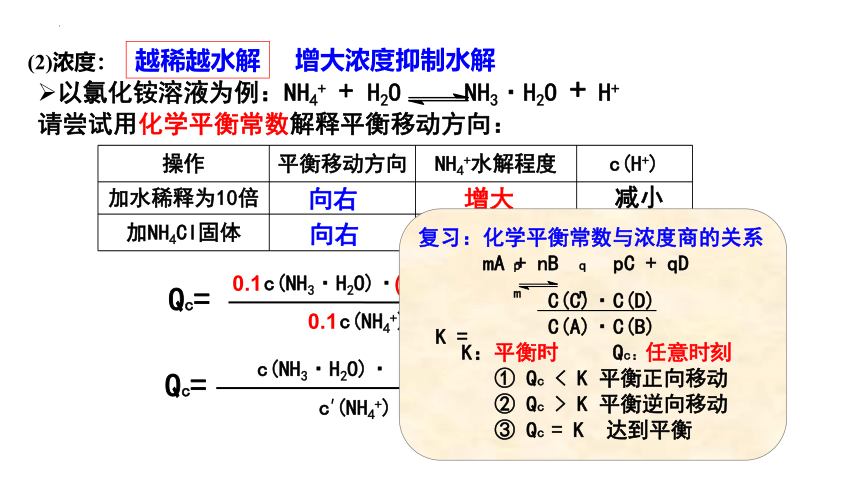
以氯化铵溶液为例:NH4+ + H2O NH3·H2O + H+
请尝试用化学平衡常数解释平衡移动方向:
c(NH3·H2O)· c(H+)
c(NH4+)
K=
0.1
(0.1)
0.1
=0.1K
越稀越水解
Qc=
< K
操作 平衡移动方向 NH4+水解程度 c(H+)
加水稀释为10倍
加NH4Cl固体
向右
向右
增大
减小
减小
增大
c(NH3·H2O)· c(H+)
c′(NH4+)
Qc=
< K
增大浓度抑制水解
复习:化学平衡常数与浓度商的关系
mA + nB pC + qD
C(C)·C(D)
C(A)·C(B)
K:平衡时 Qc:任意时刻
① Qc < K 平衡正向移动
② Qc > K 平衡逆向移动
③ Qc = K 达到平衡
p q
m n
K =
(2)浓度:
(3)酸碱性:
水解呈酸性的溶液中加入酸抑制水解
水解呈碱性的溶液中加入碱抑制水解
探究:在稀FeCl3溶液中已知存在如下水解平衡,填写下列表格Fe3++3H2O Fe(OH)3+3H+
条件 平衡移动方向 c(H+) pH值 Fe3+的水解
程度
加浓HCl
减小
左移
增大
减小
现象:溶液黄色加深!
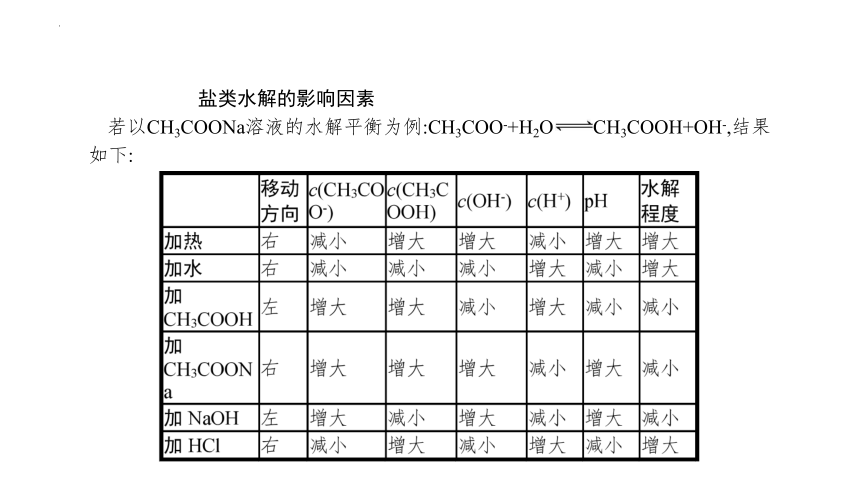
盐类水解的影响因素
若以CH3COONa溶液的水解平衡为例:CH3COO-+H2O CH3COOH+OH-,结果如下:
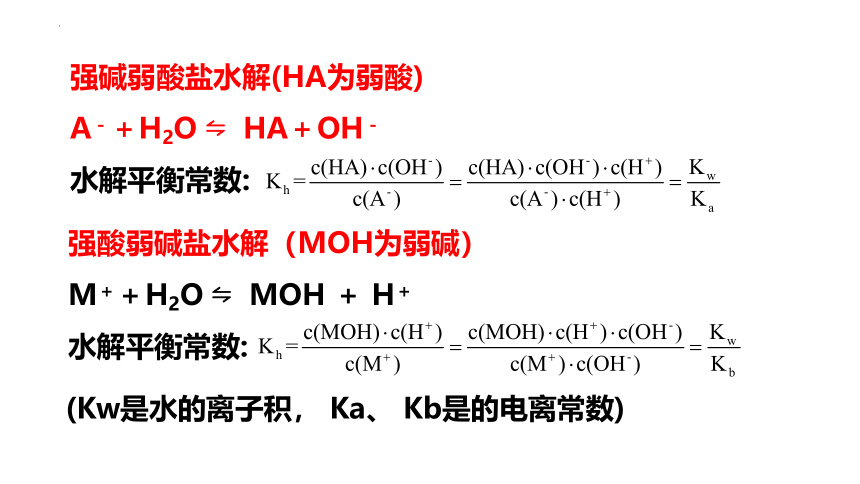
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)的浓度之比是一个常数,该常数称为水解平衡常数。
水解平衡常数Kh
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
强碱弱酸盐水解(HA为弱酸)
A-+H2O HA+OH-
水解平衡常数:
强酸弱碱盐水解(MOH为弱碱)
M++H2O MOH + H+
水解平衡常数:
(Kw是水的离子积, Ka、 Kb是的电离常数)
【思考】用平衡常数解释: NaHS溶液呈弱碱性, Na2S呈强碱性;
NaHS溶液: HS-+H2O H2S+OH-
Na2S溶液: S2-+H2O HS- +OH-
Na2S:
故:NaHS呈弱酸性,而Na2S呈碱性
25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh= mol/L
随堂小练
(1)设计物质水溶液的配制方法。
凡配制能水解的盐溶液时,通常需采取防水解措施。
①配制强酸弱碱盐溶液:滴几滴相应的强酸,可使水解平衡向左移动,抑制弱碱阳离子的水解。如配制FeCl3的水溶液:FeCl3溶于水时会发生水解反应Fe3++3H2O Fe(OH)3+3H+,因有Fe(OH)3的生成易使溶液变浑浊,通常先将FeCl3溶于较浓盐酸中,抑制Fe3+的水解,使溶液保持澄清,再加水稀释至所需浓度。
②配制强碱弱酸盐溶液:加入少量相应的强碱,可抑制弱酸根离子水解。如配制硫化钠的水溶液时,可加入少量氢氧化钠,抑制S2-的水解。
盐类水解的应用
(2)选择试剂的保存方法。
某些实验试剂贮存时要考虑到盐的水解。如Na2SO3溶液因水解使溶液呈碱性,OH-与玻璃的主要成分SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带磨口玻璃塞的试剂瓶贮存,可用带橡胶塞或软木塞的试剂瓶保存。
(3)解决离子能否大量共存问题。
在水溶液中水解相互促进的离子:
(5)利用盐的水解去除杂质。
如果两种离子的水解程度不一样,可通过调控溶液的pH将其中一种离子转化为氢氧化物沉淀而除去。
例如:MgCl2溶液中混有少量FeCl3杂质,因Fe3+水解程度比Mg2+水解程度大,可加入MgO或Mg(OH)2、MgCO3等,使Fe3+的水解平衡正向移动,生成Fe(OH)3沉淀而除去Fe3+。
(6)选择制备物质的方法。
①制备Fe(OH)3胶体。将FeCl3溶液滴入沸水中,在加热条件下,促进Fe3+的水解生成Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+。
②因Al3+和S2-在溶液中水解相互促进,故不能在水溶液中制取Al2S3,只能在固态无水条件下制取。
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)明矾[KAl(SO4)2·12H2O]既可以作净水剂也可以作消毒剂。( )
(2)实验室保存Na2S溶液用带有玻璃塞的试剂瓶。( )
(3)将Cu(NO3)2固体溶于稀硝酸配制Cu(NO3)2溶液。( )
(4)在FeCl3溶液中加入镁粉既有气体产生又有红褐色沉淀产生。( )
(5)把镁粉投入到NH4Cl溶液中,有两种气体产生。( )
(6)水解平衡右移,弱离子的水解程度一定增大。( )
(7)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用。( )
(8)热的纯碱溶液去油污效果好。( )
答案(1)× (2)× (3)√ (4)√ (5)√ (6)× (7)√ (8)√
(1)电荷守恒:电解质溶液中无论存在多少种离子溶液总是呈电中性,即 电荷总数= 电荷总数。
应用:如Na2CO3,溶液中存在的阳离子有Na+、H+,存在的阴离子有OH-、CO32-、HCO3-。
根据电荷守恒有n(Na+) + n(H+)= 。
或c(Na+) + c(H+)= 。
阳离子所带的正
阴离子所带的负
n(OH-) + n(HCO3-)+2n(CO32-)
c(OH-) + c(HCO3-)+2c(CO32-)
电解质溶液中的三个守恒
(2)元素质量守恒(物料守恒):在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。就该离子所含的某种元素来说,其质量在变化前后是守恒的,即元素质量守恒。
应用:如Na2CO3溶液中Na+和CO32-的原始浓度之间的关系为c(Na+)=2c(CO32-),由于CO32-发生水解,其在溶液中的存在形式除了CO32,还有HCO3-、H2CO3。
根据电荷守恒有c(Na+) = 。
2c(CO32-)+c(HCO3-)+c(H2CO3)
(3)质子守恒
如纯碱溶液中c(H+)水=c(OH-)水,c(H+)水=c(HCO3-)+2c(H2CO3)+c(H+),所以c(OH-)水=c(HCO3-)+2c(H2CO3)+c(H+)。
现分别以Na2CO3和NaHCO3溶液为例,用以下图示帮助我们来理解质子守恒:
所以c(OH-)=c(HCO3-)+2c(H2CO3)+c(H3O+),即 ;
所以
c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+)
(1)考虑水解因素:如Na2CO3溶液。
CO32-+H2O HCO3-+OH- HCO3-+H2O H2CO3+OH-
所以 (2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的a.NH4Cl、b.CH3COONH4、c.NH4HSO4三种溶液中c(NH4+)由大到小的顺序是 。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素,如相同浓度的NH4Cl和氨水混合液中,因NH3·H2O的电离>NH4+的水解,故离子浓度顺序为 。
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
c>a>b
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
溶液中粒子浓度大小的比较
1.在0.1mol/L的H2S溶液中,下列关系错误的是
A.c(H+)=c(HS-)+c(S2-)+c(OH-)
B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]
D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
( A )
练习
2.在氯化铵溶液中,下列关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)> c(H+) > c(OH-)
C. c(NH4+) =c(Cl-)> c(H+) = c(OH-)
D.c(Cl-)= c(NH4+) > c(H+) > c(OH-)
( A )
3.在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c( HS-) +2c(S2-) +c(H2S)
B. c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C. c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
( AD )
4.草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是
A.c(K+) +c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B. c(HC2O4-) + c(C2O42-) =0.1mol/L
C. c(C2O42-) >c(H2C2O4)
D. c(K+) = c(H2C2O4)+ c(HC2O4-) + c(C2O42-)
( CD )
电离为主显酸性:NaHSO3、NaH2PO4溶液
水解为主显碱性:NaHCO3、Na2HPO4、NaHS溶液
3.3.2 盐类的水解
1.写出下列溶液中存在的化学平衡:
(1)FeCl3溶液:
。
(2)NaHCO3溶液:
。
2.根据生活常识我们知道,热的纯碱溶液去污能力更强,这说明加热后Na2CO3溶液的碱性 。
3.Na2CO3发生水解后,溶液中粒子数目比水解前 (填“增多”“减少”或“不变”)。
4.水解呈酸性的盐溶液与水解呈碱性的盐溶液混合后,两种盐的水解程度会 (填“增大”“减小”或“不变”)。
增强
增多
增大
知识回顾
1、内因:
盐本身的性质
越弱越水解
酸HA越弱,HA电离出H+越弱,而A-结合H+能力越强,即A-越水解
碱BOH越弱,BOH电离出OH-越弱,而B+结合OH-能力越强,即B+越水解
种类 H2SO3 HAc H2CO3 HClO H2SiO3
电离常数 1.54×10-2 1.76×10-5 4.30×10-7 2.95×10-8 2.00×10-10
强弱
较强 较弱
练习1、 常温下,判断下列同浓度溶液中的酸碱性强弱:
①碱性
NaClO (aq) NaHCO3 (aq)
②酸性
MgCl2 (aq) AlCl3 (aq)
对应的酸
HClO H2CO3
<
>
对应的碱
Mg(OH)2 Al(OH)3
>
<
影响盐类水解的因素:
Na2CO3 (aq) NaHCO3 (aq)
对应的酸
HCO3– H2CO3
<
③碱 性
>
练习2、 常温下,判断下列同浓度Na2SO4、Na2SO3、 NaHSO4、NaHSO3溶液酸pH的大小并排序
pH值
Na2SO3 Na2SO4 NaHSO3 NaHSO4
> > >
CH3COO Na(aq) NaHCO3 (aq)
对应的酸
CH3COOH H2CO3
④碱 性
<
>
2、外因:
(1)温度:
越热越水解
如Na2CO3溶液
CO32-+H2O HCO3-+OH-
升温促进水解
降温抑制水解
加入酚酞,溶液淡红色
加热,溶液变为深红色
冷却后,溶液恢复淡红色
以氯化铵溶液为例:NH4+ + H2O NH3·H2O + H+
请尝试用化学平衡常数解释平衡移动方向:
c(NH3·H2O)· c(H+)
c(NH4+)
K=
0.1
(0.1)
0.1
=0.1K
越稀越水解
Qc=
< K
操作 平衡移动方向 NH4+水解程度 c(H+)
加水稀释为10倍
加NH4Cl固体
向右
向右
增大
减小
减小
增大
c(NH3·H2O)· c(H+)
c′(NH4+)
Qc=
< K
增大浓度抑制水解
复习:化学平衡常数与浓度商的关系
mA + nB pC + qD
C(C)·C(D)
C(A)·C(B)
K:平衡时 Qc:任意时刻
① Qc < K 平衡正向移动
② Qc > K 平衡逆向移动
③ Qc = K 达到平衡
p q
m n
K =
(2)浓度:
(3)酸碱性:
水解呈酸性的溶液中加入酸抑制水解
水解呈碱性的溶液中加入碱抑制水解
探究:在稀FeCl3溶液中已知存在如下水解平衡,填写下列表格Fe3++3H2O Fe(OH)3+3H+
条件 平衡移动方向 c(H+) pH值 Fe3+的水解
程度
加浓HCl
减小
左移
增大
减小
现象:溶液黄色加深!
盐类水解的影响因素
若以CH3COONa溶液的水解平衡为例:CH3COO-+H2O CH3COOH+OH-,结果如下:
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱的阳离子)的浓度之比是一个常数,该常数称为水解平衡常数。
水解平衡常数Kh
水解平衡常数是描述能水解的盐水解平衡的主要参数。
它只受温度影响,因水解过程是吸热过程,故它随温度的升高而增大。
强碱弱酸盐水解(HA为弱酸)
A-+H2O HA+OH-
水解平衡常数:
强酸弱碱盐水解(MOH为弱碱)
M++H2O MOH + H+
水解平衡常数:
(Kw是水的离子积, Ka、 Kb是的电离常数)
【思考】用平衡常数解释: NaHS溶液呈弱碱性, Na2S呈强碱性;
NaHS溶液: HS-+H2O H2S+OH-
Na2S溶液: S2-+H2O HS- +OH-
Na2S:
故:NaHS呈弱酸性,而Na2S呈碱性
25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2molL,则该温度下NaHSO3的水解平衡常数Kh= mol/L
随堂小练
(1)设计物质水溶液的配制方法。
凡配制能水解的盐溶液时,通常需采取防水解措施。
①配制强酸弱碱盐溶液:滴几滴相应的强酸,可使水解平衡向左移动,抑制弱碱阳离子的水解。如配制FeCl3的水溶液:FeCl3溶于水时会发生水解反应Fe3++3H2O Fe(OH)3+3H+,因有Fe(OH)3的生成易使溶液变浑浊,通常先将FeCl3溶于较浓盐酸中,抑制Fe3+的水解,使溶液保持澄清,再加水稀释至所需浓度。
②配制强碱弱酸盐溶液:加入少量相应的强碱,可抑制弱酸根离子水解。如配制硫化钠的水溶液时,可加入少量氢氧化钠,抑制S2-的水解。
盐类水解的应用
(2)选择试剂的保存方法。
某些实验试剂贮存时要考虑到盐的水解。如Na2SO3溶液因水解使溶液呈碱性,OH-与玻璃的主要成分SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带磨口玻璃塞的试剂瓶贮存,可用带橡胶塞或软木塞的试剂瓶保存。
(3)解决离子能否大量共存问题。
在水溶液中水解相互促进的离子:
(5)利用盐的水解去除杂质。
如果两种离子的水解程度不一样,可通过调控溶液的pH将其中一种离子转化为氢氧化物沉淀而除去。
例如:MgCl2溶液中混有少量FeCl3杂质,因Fe3+水解程度比Mg2+水解程度大,可加入MgO或Mg(OH)2、MgCO3等,使Fe3+的水解平衡正向移动,生成Fe(OH)3沉淀而除去Fe3+。
(6)选择制备物质的方法。
①制备Fe(OH)3胶体。将FeCl3溶液滴入沸水中,在加热条件下,促进Fe3+的水解生成Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+。
②因Al3+和S2-在溶液中水解相互促进,故不能在水溶液中制取Al2S3,只能在固态无水条件下制取。
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)明矾[KAl(SO4)2·12H2O]既可以作净水剂也可以作消毒剂。( )
(2)实验室保存Na2S溶液用带有玻璃塞的试剂瓶。( )
(3)将Cu(NO3)2固体溶于稀硝酸配制Cu(NO3)2溶液。( )
(4)在FeCl3溶液中加入镁粉既有气体产生又有红褐色沉淀产生。( )
(5)把镁粉投入到NH4Cl溶液中,有两种气体产生。( )
(6)水解平衡右移,弱离子的水解程度一定增大。( )
(7)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用。( )
(8)热的纯碱溶液去油污效果好。( )
答案(1)× (2)× (3)√ (4)√ (5)√ (6)× (7)√ (8)√
(1)电荷守恒:电解质溶液中无论存在多少种离子溶液总是呈电中性,即 电荷总数= 电荷总数。
应用:如Na2CO3,溶液中存在的阳离子有Na+、H+,存在的阴离子有OH-、CO32-、HCO3-。
根据电荷守恒有n(Na+) + n(H+)= 。
或c(Na+) + c(H+)= 。
阳离子所带的正
阴离子所带的负
n(OH-) + n(HCO3-)+2n(CO32-)
c(OH-) + c(HCO3-)+2c(CO32-)
电解质溶液中的三个守恒
(2)元素质量守恒(物料守恒):在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。就该离子所含的某种元素来说,其质量在变化前后是守恒的,即元素质量守恒。
应用:如Na2CO3溶液中Na+和CO32-的原始浓度之间的关系为c(Na+)=2c(CO32-),由于CO32-发生水解,其在溶液中的存在形式除了CO32,还有HCO3-、H2CO3。
根据电荷守恒有c(Na+) = 。
2c(CO32-)+c(HCO3-)+c(H2CO3)
(3)质子守恒
如纯碱溶液中c(H+)水=c(OH-)水,c(H+)水=c(HCO3-)+2c(H2CO3)+c(H+),所以c(OH-)水=c(HCO3-)+2c(H2CO3)+c(H+)。
现分别以Na2CO3和NaHCO3溶液为例,用以下图示帮助我们来理解质子守恒:
所以c(OH-)=c(HCO3-)+2c(H2CO3)+c(H3O+),即 ;
所以
c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+)
(1)考虑水解因素:如Na2CO3溶液。
CO32-+H2O HCO3-+OH- HCO3-+H2O H2CO3+OH-
所以 (2)不同溶液中同一离子浓度的比较要看溶液中其他离子对它的影响。如相同浓度的a.NH4Cl、b.CH3COONH4、c.NH4HSO4三种溶液中c(NH4+)由大到小的顺序是 。
(3)混合液中各离子浓度的比较要综合分析水解因素、电离因素,如相同浓度的NH4Cl和氨水混合液中,因NH3·H2O的电离>NH4+的水解,故离子浓度顺序为 。
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
c>a>b
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
溶液中粒子浓度大小的比较
1.在0.1mol/L的H2S溶液中,下列关系错误的是
A.c(H+)=c(HS-)+c(S2-)+c(OH-)
B.c(H+)=c(HS-)+2c(S2-)+c(OH-)
C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]
D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L
( A )
练习
2.在氯化铵溶液中,下列关系正确的是
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)> c(H+) > c(OH-)
C. c(NH4+) =c(Cl-)> c(H+) = c(OH-)
D.c(Cl-)= c(NH4+) > c(H+) > c(OH-)
( A )
3.在Na2S溶液中下列关系不正确的是
A.c(Na+) =2c( HS-) +2c(S2-) +c(H2S)
B. c(Na+) +c(H+)=c(OH-)+c(HS-)+ 2c(S2-)
C. c(Na+) > c(S2-) >c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+ c(H2S)
( AD )
4.草酸是二元弱酸,草酸氢钾溶液呈酸性,在0.1mol/LKHC2O4溶液中,下列关系正确的是
A.c(K+) +c(H+)=c(HC2O4-)+c(OH-)+ c(C2O42-)
B. c(HC2O4-) + c(C2O42-) =0.1mol/L
C. c(C2O42-) >c(H2C2O4)
D. c(K+) = c(H2C2O4)+ c(HC2O4-) + c(C2O42-)
( CD )
电离为主显酸性:NaHSO3、NaH2PO4溶液
水解为主显碱性:NaHCO3、Na2HPO4、NaHS溶液
