化学人教版(2019)选择性必修1 1.2.1.盖斯定律(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.2.1.盖斯定律(共23张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 365.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-24 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
反应热的计算
盖斯定律
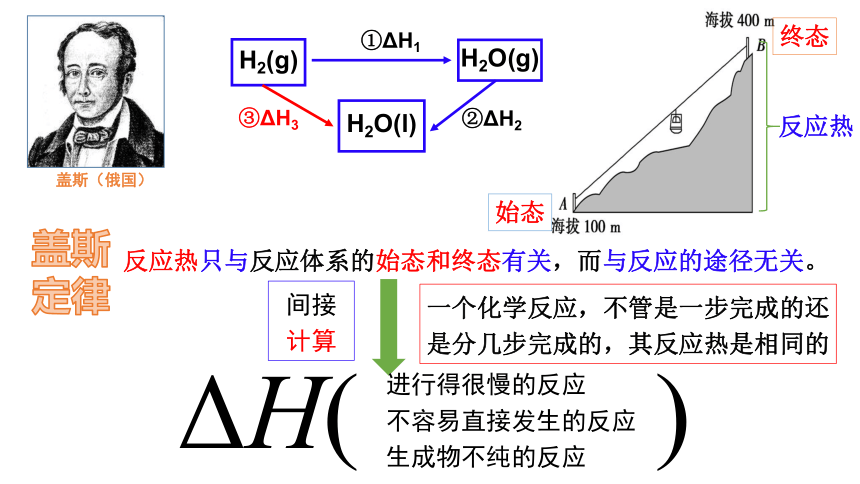
数据△H1表示H2燃烧热吗?
H2(g)+1/2O2(g)==H2O(g) △H1= -241.8kJ/mol
??H2的燃烧热△H究竟是多少?如何计算?
已知:H2O(g)==H2O(l) △H2= -44kJ/mol
①
②
H2燃烧热的热化学方程式:
H2(g)+1/2O2(g)==H2O(l)
③
③=①+②
△H3=△H1+△H2= -285.8kJ/mol
△H3
ΔH( )
H2O(g)
①ΔH1
H2(g)
H2O(l)
③ΔH3
②ΔH2
盖斯(俄国)
反应热只与反应体系的始态和终态有关,而与反应的途径无关。
盖斯
定律
终态
始态
反应热
一个化学反应,不管是一步完成的还
是分几步完成的,其反应热是相同的
间接计算
进行得很慢的反应
不容易直接发生的反应
生成物不纯的反应
查阅资料,已知:
②CO(g)+1/2O2(g)== CO2(g) ΔH2= -283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3= -393.5kJ/mol
①C(s)+1/2O2(g)==CO(g) ΔH1=
① + ② = ③ ,即① =③-②
则 ΔH1 = ΔH3 - ΔH2= -393.5kJ/mol+283.0kJ/mol
= -110.5kJ/mol
?不能很好地控制反应的程度,故无法直接通过实验测得△H1
①与目标方程式中同一物质同侧:+
②与目标方程式中同一物质异侧:-
★盖斯定律的应用技巧★
思路:运用“四则运算”构建目标方程式,有时需要结合消元法
操作步骤:①确定目标热化学方程式
②找出已知方程式中的关键物质(即:与目标方程式相同的物质,在所有已知方程式中只出现一次)
③根据“关键物质”的位置和系数,运用“四则运算”构建目标方程式,计算△H
根据目标方程式中各物质的化学计量数通过×、÷来调整已知反应的化学计量数
=
P19第4
例:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) △H3 =?
△H3=2△H2 - △H1= -1135.2kJ/mol
2
-
【练习】写出石墨变成金刚石的热化学方程式(25℃,101kPa)
查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g) △H1= -393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g) △H2= -395.0kJ/mol
③C(石墨,s) = C(金刚石,s)
-
③= ①- ②
△H3= △H1 - △H2
= + 1.5 kJ/mol
【练习】已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s) △H2= -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变
④= ②+③-①
-
△H4 = △H2+△H3-△H1 =+ 178.2 kJ/mol
【练习】已知:
①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;
②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,
则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1
C.-746 kJ·mol-1 D.+746 kJ·mol-1
【解析】 利用盖斯定律可知①-②即可得,故该反应的ΔH=-566 kJ·mol-1-180 kJ·mol-1=-746 kJ·mol-1。
C
-
【练习】已知
① CO(g) + 1/2 O2(g) = CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l) ΔH3= -1370 kJ/mol
试计算: ④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
根据④=①×2 + ②×4 - ③
则ΔH=2ΔH1 +4ΔH2 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2
4
-
FeO(s)+CO(g)=Fe(s)+CO2(g)
△H= 1/2△H1 -1/6△H2-1/3△H3
例:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
-1/3
1/2
-1/6
“消元法”消去中间产物
①
②
③
④
④=1/2①-1/6②-1/3③
【练习】已知:
2Zn(s)+O2(g)=2ZnO(s) ΔH= -701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH= -181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
C
1/2①-1/2②
①
②
1/2
-1/2
【练习】已知:
①H2O(g)===H2O(l) ΔH1=Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=Q3 kJ·mol-1
则反应C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)的反应热ΔH为
A.(Q1+Q2+Q3) kJ·mol-1 B.(3Q1+Q2+Q3) kJ·mol-1
C.(Q1-3Q2+Q3) kJ·mol-1 D.(3Q1-Q2+Q3) kJ·mol-1
D
①×3+③-②
3
【练习】已知:
Al 2O 3(s)+3C(s) = 2Al(s)+3CO(g) Δ H 1=+1 344.1 kJ· mol -1
2AlCl 3(g) = 2Al(s)+3Cl 2(g) Δ H 2=+1 169.2 kJ· mol -1
由Al 2O 3、C和Cl 2反应生成AlCl 3的热化学方程式为______________________________________
Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)
ΔH=+174.9 kJ/mol
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s、白)+2HCl(aq)=SnCl 2(aq)+H 2(g) △H 1
②Sn(s、灰)+2HCl(aq)=SnCl 2(aq)+H 2(g) △H 2
③Sn(s、灰) Sn(s、白) △H 3=+2.1kJ/mol
下列说法正确的是( )
A、△H1>△H2
B、锡在常温下以灰锡状态存在
C、灰锡转化为白锡的反应是放热反应
D、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D
【2015全国卷Ⅱ 27(1)】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) =CH3OH(g) △H1
②CO2(g)+3H2(g) =CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)= CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
化学键 H—H C—O C O H—O C—H
E/(kJ.mol-1) 436 343 1076 465 413
由此计算△H1= kJ·mol-1,
已知△H2=-58 kJ·mol-1,则△H3= kJ·mol-1
-99
+41
【2017全国卷Ⅲ 28(3)】已知:
As(s)+3/2 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ 1/2 O2(g)=H2O(l) ΔH2
2As(s)+ 2/5 O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的
ΔH =_________
2△H1-3△H2-△H3
【2017全国卷Ⅰ 28(2)】下图是通过热化学循环在较低温度
下由水或硫化氢分解制备H2的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方
程式分别为_______________________________、
________________________________________,
制得等量H2所需能量较少的是_____________。
H2O(l)=H2(g)+1/2 O2(g)ΔH=+286 kJ/mol
H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol
系统(II)
(2018·全国卷Ⅰ)已知:
2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+1/2O2(g)的ΔH= kJ·mol-1。
+53.1
1/2①-②
(2018·课标全国Ⅱ)CH4 CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4 CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH= kJ·mol-1。
+247
③×2-①-②
(2019·全国卷Ⅲ)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。Deacon直接氧化法可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1=83 kJ·mol-1
Ⅱ.CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2=-20 kJ·mol-1
Ⅲ.CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
-116
(①+②+③)×2
(2020·全国卷Ⅰ)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:
SO2(g)+1/2O2(g)????SO3(g) ΔH=-98 kJ·mol-1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:____________________________
由图知:
V2O4(s)+SO3(g)=V2O5(s)+SO2(g)
ΔH2=-24 kJ·mol-1①,
V2O4(s)+2SO3(g)=2VOSO4(s)
ΔH1=-399 kJ·mol-1②。
根据盖斯定律,由②-①×2得:2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s)
2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
作业:①P19第1-3,5,6,
②P22第6、8、9、10
(2021广东卷,19)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) H1
b)CO2(g)+H2(g) CO(g)+H2O(g) H2
c)CH4(g) C(s)+2H2(g) H3
d)2CO(g) CO2(g)+C(s) H4
e)CO(g)+H2(g) H2O(g)+C(s) H5
(1)根据盖斯定律,反应a的 H1=________________________(写出一个代数式即可)。
H3- H4或 H2+ H3- H5
反应热的计算
盖斯定律
数据△H1表示H2燃烧热吗?
H2(g)+1/2O2(g)==H2O(g) △H1= -241.8kJ/mol
??H2的燃烧热△H究竟是多少?如何计算?
已知:H2O(g)==H2O(l) △H2= -44kJ/mol
①
②
H2燃烧热的热化学方程式:
H2(g)+1/2O2(g)==H2O(l)
③
③=①+②
△H3=△H1+△H2= -285.8kJ/mol
△H3
ΔH( )
H2O(g)
①ΔH1
H2(g)
H2O(l)
③ΔH3
②ΔH2
盖斯(俄国)
反应热只与反应体系的始态和终态有关,而与反应的途径无关。
盖斯
定律
终态
始态
反应热
一个化学反应,不管是一步完成的还
是分几步完成的,其反应热是相同的
间接计算
进行得很慢的反应
不容易直接发生的反应
生成物不纯的反应
查阅资料,已知:
②CO(g)+1/2O2(g)== CO2(g) ΔH2= -283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3= -393.5kJ/mol
①C(s)+1/2O2(g)==CO(g) ΔH1=
① + ② = ③ ,即① =③-②
则 ΔH1 = ΔH3 - ΔH2= -393.5kJ/mol+283.0kJ/mol
= -110.5kJ/mol
?不能很好地控制反应的程度,故无法直接通过实验测得△H1
①与目标方程式中同一物质同侧:+
②与目标方程式中同一物质异侧:-
★盖斯定律的应用技巧★
思路:运用“四则运算”构建目标方程式,有时需要结合消元法
操作步骤:①确定目标热化学方程式
②找出已知方程式中的关键物质(即:与目标方程式相同的物质,在所有已知方程式中只出现一次)
③根据“关键物质”的位置和系数,运用“四则运算”构建目标方程式,计算△H
根据目标方程式中各物质的化学计量数通过×、÷来调整已知反应的化学计量数
=
P19第4
例:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
2 N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) △H3 =?
△H3=2△H2 - △H1= -1135.2kJ/mol
2
-
【练习】写出石墨变成金刚石的热化学方程式(25℃,101kPa)
查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g) △H1= -393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g) △H2= -395.0kJ/mol
③C(石墨,s) = C(金刚石,s)
-
③= ①- ②
△H3= △H1 - △H2
= + 1.5 kJ/mol
【练习】已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s) △H1 = -1206.8 kJ/mol
②Ca(s)+1/2O2(g)=CaO(s) △H2= -635.1 kJ/mol
③C(s,石墨)+O2(g)=CO2(g) △H3 = -393.5 kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变
④= ②+③-①
-
△H4 = △H2+△H3-△H1 =+ 178.2 kJ/mol
【练习】已知:
①2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;
②N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1,
则2CO(g)+2NO(g)===N2(g)+2CO2(g)的ΔH是( )
A.-386 kJ·mol-1 B.+386 kJ·mol-1
C.-746 kJ·mol-1 D.+746 kJ·mol-1
【解析】 利用盖斯定律可知①-②即可得,故该反应的ΔH=-566 kJ·mol-1-180 kJ·mol-1=-746 kJ·mol-1。
C
-
【练习】已知
① CO(g) + 1/2 O2(g) = CO2(g) ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l) ΔH3= -1370 kJ/mol
试计算: ④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
根据④=①×2 + ②×4 - ③
则ΔH=2ΔH1 +4ΔH2 -ΔH3
=-283.2×2 -285.8×4 +1370 =-339.2 kJ/mol
2
4
-
FeO(s)+CO(g)=Fe(s)+CO2(g)
△H= 1/2△H1 -1/6△H2-1/3△H3
例:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
-1/3
1/2
-1/6
“消元法”消去中间产物
①
②
③
④
④=1/2①-1/6②-1/3③
【练习】已知:
2Zn(s)+O2(g)=2ZnO(s) ΔH= -701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH= -181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
C
1/2①-1/2②
①
②
1/2
-1/2
【练习】已知:
①H2O(g)===H2O(l) ΔH1=Q1 kJ·mol-1
②C2H5OH(g)===C2H5OH(l) ΔH2=Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=Q3 kJ·mol-1
则反应C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l)的反应热ΔH为
A.(Q1+Q2+Q3) kJ·mol-1 B.(3Q1+Q2+Q3) kJ·mol-1
C.(Q1-3Q2+Q3) kJ·mol-1 D.(3Q1-Q2+Q3) kJ·mol-1
D
①×3+③-②
3
【练习】已知:
Al 2O 3(s)+3C(s) = 2Al(s)+3CO(g) Δ H 1=+1 344.1 kJ· mol -1
2AlCl 3(g) = 2Al(s)+3Cl 2(g) Δ H 2=+1 169.2 kJ· mol -1
由Al 2O 3、C和Cl 2反应生成AlCl 3的热化学方程式为______________________________________
Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)
ΔH=+174.9 kJ/mol
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s、白)+2HCl(aq)=SnCl 2(aq)+H 2(g) △H 1
②Sn(s、灰)+2HCl(aq)=SnCl 2(aq)+H 2(g) △H 2
③Sn(s、灰) Sn(s、白) △H 3=+2.1kJ/mol
下列说法正确的是( )
A、△H1>△H2
B、锡在常温下以灰锡状态存在
C、灰锡转化为白锡的反应是放热反应
D、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
D
【2015全国卷Ⅱ 27(1)】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) =CH3OH(g) △H1
②CO2(g)+3H2(g) =CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)= CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
化学键 H—H C—O C O H—O C—H
E/(kJ.mol-1) 436 343 1076 465 413
由此计算△H1= kJ·mol-1,
已知△H2=-58 kJ·mol-1,则△H3= kJ·mol-1
-99
+41
【2017全国卷Ⅲ 28(3)】已知:
As(s)+3/2 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+ 1/2 O2(g)=H2O(l) ΔH2
2As(s)+ 2/5 O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的
ΔH =_________
2△H1-3△H2-△H3
【2017全国卷Ⅰ 28(2)】下图是通过热化学循环在较低温度
下由水或硫化氢分解制备H2的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方
程式分别为_______________________________、
________________________________________,
制得等量H2所需能量较少的是_____________。
H2O(l)=H2(g)+1/2 O2(g)ΔH=+286 kJ/mol
H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol
系统(II)
(2018·全国卷Ⅰ)已知:
2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+1/2O2(g)的ΔH= kJ·mol-1。
+53.1
1/2①-②
(2018·课标全国Ⅱ)CH4 CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4 CO2催化重整反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g)。
已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-394 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH=-111 kJ·mol-1
该催化重整反应的ΔH= kJ·mol-1。
+247
③×2-①-②
(2019·全国卷Ⅲ)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。Deacon直接氧化法可按下列催化过程进行:
Ⅰ.CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1=83 kJ·mol-1
Ⅱ.CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2=-20 kJ·mol-1
Ⅲ.CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。
-116
(①+②+③)×2
(2020·全国卷Ⅰ)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:
SO2(g)+1/2O2(g)????SO3(g) ΔH=-98 kJ·mol-1。
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:____________________________
由图知:
V2O4(s)+SO3(g)=V2O5(s)+SO2(g)
ΔH2=-24 kJ·mol-1①,
V2O4(s)+2SO3(g)=2VOSO4(s)
ΔH1=-399 kJ·mol-1②。
根据盖斯定律,由②-①×2得:2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s)
2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
作业:①P19第1-3,5,6,
②P22第6、8、9、10
(2021广东卷,19)我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) H1
b)CO2(g)+H2(g) CO(g)+H2O(g) H2
c)CH4(g) C(s)+2H2(g) H3
d)2CO(g) CO2(g)+C(s) H4
e)CO(g)+H2(g) H2O(g)+C(s) H5
(1)根据盖斯定律,反应a的 H1=________________________(写出一个代数式即可)。
H3- H4或 H2+ H3- H5
