【备考2023】浙教版科学中考第一轮复习--化学模块(五):水和溶液【word,含答案解析】
文档属性
| 名称 | 【备考2023】浙教版科学中考第一轮复习--化学模块(五):水和溶液【word,含答案解析】 |

|
|
| 格式 | doc | ||
| 文件大小 | 489.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-25 16:19:04 | ||
图片预览




文档简介
一、水与水资源
1.水的组成:水是由氢元素和氧元素组成的化合物。
2.水的性质:水的密度为1.0×103kg/m3,4℃水的密度最大。在标准大气压下,沸点是100℃,凝固点是0℃。
3.水的电解:水在通电时会分解,负极(阴极)和正极(阳极)分别产生氢气和氧气。产生的氢气和氧气的体积比约为2∶1,质量比为1∶8。水的电解实验说明了水是由氢和氧(两种元素)组成的。
4.水的净化:工、农业废水和生活污水等都会引起水体污染。水的净化处理方法有:①吸附法;②沉淀法;③过滤法;④蒸馏法等。
【知识拓展】
1.水电解的口诀:“阳氧阴氢”。水的电解实验结论“水是由氢和氧(两种元素)组成的”不能说成是“水是由氢气和氧气组成的”或“水是由氢和氧构成的”。
2.水的四种净化处理方法中,沉淀法最简单,但效果最差,只能除去易沉降的物质。过滤法只能除去难溶性杂质。蒸馏法成本最高,能除去可溶性杂质。
3.沉淀法中,常用加入少量明矾、活性炭作为凝聚剂。活性炭是常用的吸附剂,可物理性吸附色素和异味。
二、物质在水中的分散情况
1.溶液由溶质和溶剂组成。质量关系:溶液质量=溶质质量+溶剂质量。溶液的特点是均一、稳定,静置后不分层。固、液、气态物质都可作为溶质。
2.浊液特征:不均一、不稳定的混合物,静置一段时间后会出现分层现象。
①悬浊液:固体小颗粒悬浮在液体里形成的不均一、不稳定的混合物;
②乳浊液:小液滴分散到液体里形成的不均一、不稳定的混合物。
3.饱和溶液和不饱和溶液
①饱和溶液:是指在一定温度下,在一定量的溶剂里不能继续溶解同种溶质的溶液。
理解饱和溶液与不饱和溶液应注意前提条件是“一定温度、一定量的溶剂”。
②相互转化:饱和溶液和不饱和溶液可以相互转化;对大多数固体物质而言:
eq \x(\a\al(不饱和, 溶液))eq \o(,\s\up11(加溶质、蒸发溶剂、降温),\s\do4(加溶剂、升温))eq \x(\a\al(饱和,溶液))
【知识拓展】
1.对于极少数溶解度随温度升高而降低的物质而言,如熟石灰,采用改变温度的方法使不饱和溶液变为饱和溶液时应升高温度。
2.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
三、固体物质的溶解度
1.某种物质的溶解度是指在一定的温度下,某物质在100g溶剂中达到饱和状态时所溶解的质量。
2.溶解度的影响因素有:溶质的性质、溶剂的性质、温度。
①大多数固体的溶解度随温度的升高而升高,如KNO3;
②少数固体的溶解度受温度影响不大,如NaCl;
③极少数固体的溶解度随温度的升高而降低,如熟石灰。
3.溶解度曲线:用来表示物质溶解度随温度改变而变化的曲线。曲线上的点表示该物质在相应温度下的溶解度。
【知识拓展】
1.溶解性是一个定性的概念,溶解度是一个定量的概念。
2.理解溶解度的概念应注意四个要点:一定温度、100g溶剂、饱和状态、溶质的质量(单位:g)。
3.由于溶解度规定了一定温度下100g溶剂里达到饱和状态时所能溶解的溶质质量,因此溶解度的大小与溶质、溶剂的多少无关。
四、物质的结晶
1.结晶方法一:蒸发溶剂,适用于溶解度受温度影响变化较小的固体溶质的溶液,如海水晒盐。
2.结晶方法二:冷却热饱和溶液,适用于溶解度受温度影响变化较大的固体溶质的溶液,如培养硫酸铜大晶体、提纯硝酸钾等。
3.某些物质结晶后形成的晶体带有结晶水,如CuSO4·5H2O、Na2CO3·10H2O等,失去结晶水的过程称为风化。
五、溶质质量分数与溶液配制
1.计算公式:a%=×100%
状态:计算时溶液不一定饱和。
2.稀释:进行有关溶液的稀释(或浓缩)的计算时,分析的关键是稀释(或浓缩)前后溶质质量不变。
3.溶液配制
器材:天平、量筒、烧杯、玻璃棒、药匙、胶头滴管。
步骤:①计算;②称量;③溶解;④装瓶贴标签(或转移)。
【知识拓展】
溶质的质量分数是溶质质量占溶液质量的百分比,当已知溶液体积时,应根据密度公式转化为质量。
例1、下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都发生变化的是( )
A.将一定量硝酸钾不饱和溶液升温10℃
B.将一定量饱和石灰水升温10℃
C.取一定量蔗糖不饱和溶液向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液向其中加入少量水
例2、“超临界水”因具有许多优良特质而被科学家追捧,它是指当气压和温度达到一定值时,水的液态和气态完全交融在一起的流体。下列有关“超临界水”的说法正确的是( )
A.它是混合物
B.它是一种不同于水的物质
C.它的分子之间有间隔
D.它的一个分子由4个氢原子和2个氧原子构成
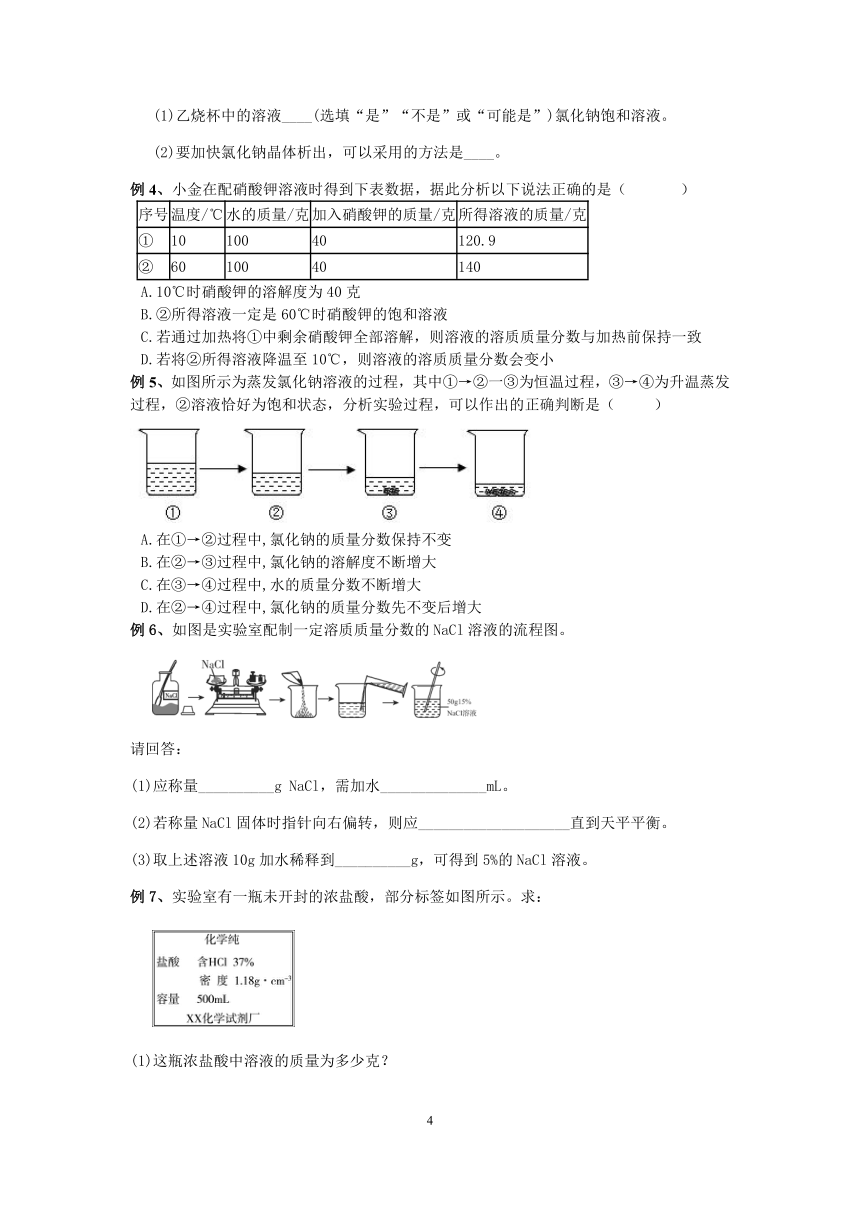
例3、海水晒盐是海水在常温下蒸发得到氯化钠的过程。小柯用氯化钠溶液模拟该过程,如图:
(1)乙烧杯中的溶液____(选填“是”“不是”或“可能是”)氯化钠饱和溶液。
(2)要加快氯化钠晶体析出,可以采用的方法是____。
例4、小金在配硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
例5、如图所示为蒸发氯化钠溶液的过程,其中①→②一③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
例6、如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量__________g NaCl,需加水______________mL。
(2)若称量NaCl固体时指针向右偏转,则应____________________直到天平平衡。
(3)取上述溶液10g加水稀释到__________g,可得到5%的NaCl溶液。
例7、实验室有一瓶未开封的浓盐酸,部分标签如图所示。求:
(1)这瓶浓盐酸中溶液的质量为多少克?
(2)若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少毫升?水的体积是多少毫升?
1.下列有关溶液的说法正确的是( )
A.形成溶液的溶质都是固态物质
B.饱和溶液的溶质质量分数一定比不饱和溶液的溶质质量分数大
C.溶液具有均一性和稳定性
D.所有物质溶于水形成溶液都要吸收热量
2.20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是 ( )
A.所得溶液可能都是饱和溶液 B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙 D.升高温度,溶液溶质的质量分数一定变大
3.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度 B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少 D.①溶液中溶质的质量分数大于②溶液
4.台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于________。
(2)渣汁的分离与图中的________(选填“A”、“B”或“C”)实验原理相同。
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化
5.2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。
(1)次氯酸钠中钠、氯、氧元素的原子个数比为________。
(2)制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是________。
(3)市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?
1.中医药在治疗新冠肺炎中,为全球抗击疫情贡献了中国智慧。下列中药煎制步骤与实验室过滤操作原理相同的是( )
A.冷水浸泡 B.加热煎制
C.取液弃渣 D.装袋保存
2.如图是A、B两物质的溶解度曲线,下列信息中正确的是( )
A.图中阴影部分表明A、B两溶液都是饱和溶液
B.t1℃时,A、B两饱和溶液的溶质质量分数相等
C.t2℃时,B物质的溶解度大于A物质的溶解度
D.t2℃时,等质量的A、B两饱和溶液降温到t1℃时析出溶质的质量相等
3.50℃的饱和石灰水400克平均分成两份,将一份降温至20℃;另一份加入生石灰0.5克,温度仍保持50℃。在这两种情况下,下列说法正确的是( )
A.溶质质量相同 B.都会变浑浊 C.溶质质量分数相同 D.溶质的溶解度相同
4.下表是A、B、C三种固体物质在不同温度下(t1温度(℃) t1 t2 t3
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1)________℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为________(选填“甲”或“乙”)。
(3)t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为________。
5.在“探究稀盐酸和稀硫酸的化学性质”实验中,小科发现镁带与稀盐酸反应后的试管内出现了灰白沉淀。
【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】
(1)从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的________(填“饱和”或“不饱和”)溶液。
(2)从步骤三可知,该沉淀中没有________。
(3)步骤四中将滤渣用蒸馏水充分洗涤是为了________。
(4)根据实验探究可知,该反应产生的灰白色沉淀中一定含有________。
答案及解析
例1、B
【解析】温度升高,硝酸钾的溶解度升高,但其不饱和溶液的质量分数不变;氢氧化钙的溶解度随温度的升高而降低,升温后溶解度和溶质质量分数都发生变化;溶解度与溶质或溶剂的量无关,加入溶质溶剂都不会改变溶解度。
例2、“C
【解析】“超临界水”中的液态水和气态水都是由水分子构成的,属于纯净物。“超临界水”与普通水的物理性质不同,但化学性质相同。无论是气态、液态还是固态的水,其水分子之间都存在间隔。每个水分子都是由一个氧原子和两个氢原子构成。
例3、可能是 加快液面空气流速
【解析】(1)甲一定是不饱和溶液,乙可能是饱和溶液,丙、丁一定是饱和溶液。(2)氯化钠的溶解度受温度变化很小,不能用改变温度的方法使氯化钠结晶析出。要加快氯化钠晶体析出,可以采用的方法是加快液面空气流速,加快水的蒸发。
例4、D
【解析】A.根据①可知,硝酸钾溶解的质量为:120.9g-100g=20.9g,因此10℃时,100g水中最多溶解硝酸钾20.9g,因此此时它的溶解度为20.9g,故A错误;
B.根据②中数据可知,此时硝酸钾全部溶解,没有任何信息能够说明此时溶液不能再继续溶解硝酸钾,因此无法确定溶液是否饱和,故B错误;
C.若通过加热将①中剩余硝酸钾全部溶解,那么溶液中溶质的质量增大了,根据可知,溶液的溶质质量分数比加热前变大了,故C错误;
D.若将②所得溶液降温至10℃,溶质的质量会由40g变为20.9g,根据可知,溶液的溶质质量分数会变小,故D正确。
例5、D
【解析】根据蒸发原理分析,蒸发溶剂有恒温蒸发和升温蒸发,无论哪一种,溶剂都会减小,但溶质质量分数和溶解度可能不变。
在①→②过程为恒温蒸发,氯化钠的质量分数会增大,错误;
B、在②→③过程中,加热时氯化钠的溶解度增大,蒸发过程保持温度不变,则溶解度也保持不变,错误;
C、在③→④过程中,水的质量分数不断减小,错误;
D、在②→④过程中,氯化钠的质量分数先不变后增大,正确。
例6、7.5 42.5 继续向左盘添加氯化钠 30
【解析】(1)溶质质量=溶液质量×溶质的质量分数,配制50g 15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7.5g=42.5g(合42.5mL)。(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加氯化钠固体;若发现指针向右偏转,说明氯化钠的质量小于砝码和游码显示的质量和,故应继续向左盘添加氯化钠,直至天平平衡。(3)溶液具有均一性,取出的溶液溶质质量分数为15%,设稀释后溶液的质量为x,根据溶液稀释前后溶质质量不变,则10g×15%=x×5%,x=30g。
例7、590g 45.8mL 146mL
【解析】(1)这瓶浓盐酸中溶液的质量:m=ρV=1.18g/mL×500mL=590g。
(2)稀释溶液时,溶质质量不变。则m浓×37%=200g×10%,
m浓≈54g,m水=200g-54g=146g,
需取浓盐酸的体积:V浓==≈45.8mL,需加水的体积:V水=146mL。
1.C
【解析】形成溶液的溶质既可以是固态物质,也可以是气态、液态物质。有些饱和溶液是很稀的溶液,有时较高温度的不饱和溶液会比较低温度的饱和溶液的溶质质量分数要大。有些物质溶于水形成溶液要吸收热量,但有些物质溶于水则要放出热量。
2.A
【解析】图所示,甲剩余最多,乙全部溶解,丙有较少剩余,所以甲、丙的溶液一定饱和,乙的溶液可能饱和也可能不饱和。其中乙的溶液的溶质质量最大,甲的最小。溶液的溶质质量分数:乙>丙>甲。未明确甲、乙、丙的溶解度与温度的关系,无法确定升温后溶液的溶质质量分数的变化。
3.C
【解析】A、比较溶解度时,要规定一定温度,且这里所给信息不足无法判断甲、乙溶解度的大小,A错误;
B、 ①②两溶液 ,原来均有少量未溶解的固体,所以判断为饱和溶液,升高温度后,甲溶解度增大,乙溶解度减小,所以乙肯定仍是饱和溶液,而甲无法判断,B错误;
C、升高温度后, ① 甲溶解度增大,所以固体会继续溶解,溶液质量增加, ② 乙溶解度减小,晶体会析出,溶液质量减少,C正确;
D、因为题中信息不足,无法比较出 ①溶液 和 ②溶液 质量分数的大小,D错误。
4.(1)物理变化 (2)B (3)变大(或“先变大后不变”)
【解析】(1)甘蔗在压榨过程中,只是它的形状和存在状态发生改变,而没有新物质生成,因此属于物理变化;
(2)渣汁的分离其实就是将液态的糖汁和固态的渣子分离,因此与过滤操作原理相同,故选图B;
(3)糖汁在蒸发浓缩过程中,当没有饱和时,没有晶体析出,溶质质量不变但溶剂质量减少,根据可知,溶液的溶质质量分数增大。当达到饱和后,会不断析出晶体,但是溶质的质量分数保持不变。
5.(1)1:1:1
(2)H2O
(3)设需要该消毒液的质量为m
2000千克×0.2%=m×25%
m=16千克
加水质量=2000千克-16千克=1984千克
【解析】(1)由次氯酸钠的化学式可知, 次氯酸钠中钠、氯、氧元素的原子个数比为 1:1:1;
(2)化学反应前后原子种类和个数都不变,由方程式可知,反应前原子种类和个数为:氯2、钠2、氢2、氧2,反应后为:氯2、钠2、氧1,则X中含2个氢原子和1个氧原子,化学式为 H2O ;
1.C
【解析】在冷水浸泡、加热煎制、取液弃渣和装袋保存四个环节中,取液弃渣是将药液和不溶于药液的残渣进行分离,与过滤操作相同,故C正确,而A、B、D错误。
2.B
【解析】图中阴影部分表明A溶液是饱和溶液,B溶液是不饱和溶液。t1℃时,A、B两物质的溶解度相等,所以饱和溶液的溶质质量分数相等。通过分析溶解度曲线可知,t2℃时,A物质的溶解度大于B物质的溶解度,t1℃时,A、B两物质的溶解度相等,所以等质量的A、B两饱和溶液降温到t1℃时析出溶质的质量A大于B。
3.C
【解析】(1)氢氧化钙的溶解度随温度的升高而减小,随温度的降低而增大;
(2)当温度不变时,同种物质饱和溶液的溶质质量分数相同。
50℃时将等质量的两份饱和石灰水,其中一份冷却到20℃,由于氢氧化钙的溶解度增大,所以不会析出,即溶质和溶剂的质量保持不变,也就是溶质的质量分数不变;
另一份加入生石灰0.5g,生石灰与水反应生成氢氧化钙,由于溶剂减少,因此氢氧化钙会析出,从而导致溶质质量减小,溶液的质量也会减小。由于温度仍然保持50℃,而石灰水又是饱和溶液,所以溶质的质量分数保持不变。
A.前一份石灰水的溶质质量不变,后一份石灰水的溶质质量减小,故A错误;
B.前一份石灰水为不饱和溶液,没有氢氧化钙析出;而后一份则为饱和溶液,有氢氧化钙析出,会变浑浊,故B错误;
C.两份溶液的溶质质量分数相同,故C正确;
D.两份溶液的温度不变,因此溶质的溶解度不同,故D错误。
4.(1)t2 (2)甲 (3)20%
【解析】溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。溶液中溶质的质量分数是溶质质量与溶液质量之比。
【解答】(1)由表格中可知,A、B在 t2 ℃时,溶解度都是36.2g;
(2)由表格中的数据可知,物质B的溶解度随着温度的升高而增大,物质C的溶解度随着温度的升高而降低;硝酸铵溶于水吸收热量,溶液温度降低,B物质的溶解度降低,所以试管甲中有物质析出;
(3)t2℃时,A物质的溶解度为36.0g,所以40g溶剂可以溶解A的质量为:所以10gA能够完全溶解在40g水中;其溶质质量分数为;
5.(1)不饱和
(2)Mg
(3)洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验
(4)Mg(OH)Cl
【解析】(1)由步骤二加入氯化镁粉末,粉末全部溶解可知,所得滤液是氯化镁的不饱和溶液;
(2)步骤三中 加入适量稀盐酸,沉淀全部溶解 ,而镁与盐酸反应会产生氢气,由此可知沉淀中没有镁;
(3)滤渣上会附着有氯化镁,步骤四中将滤渣用蒸馏水充分洗涤是为了 洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验 ;
(4)滤渣中加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生,说明含有氯离子,由此可知该反应产生的灰白色沉淀中一定含有 Mg(OH)Cl ;
2023浙教版科学中考第一轮复习--化学模块(五)
水和溶液
1.水的组成:水是由氢元素和氧元素组成的化合物。
2.水的性质:水的密度为1.0×103kg/m3,4℃水的密度最大。在标准大气压下,沸点是100℃,凝固点是0℃。
3.水的电解:水在通电时会分解,负极(阴极)和正极(阳极)分别产生氢气和氧气。产生的氢气和氧气的体积比约为2∶1,质量比为1∶8。水的电解实验说明了水是由氢和氧(两种元素)组成的。
4.水的净化:工、农业废水和生活污水等都会引起水体污染。水的净化处理方法有:①吸附法;②沉淀法;③过滤法;④蒸馏法等。
【知识拓展】
1.水电解的口诀:“阳氧阴氢”。水的电解实验结论“水是由氢和氧(两种元素)组成的”不能说成是“水是由氢气和氧气组成的”或“水是由氢和氧构成的”。
2.水的四种净化处理方法中,沉淀法最简单,但效果最差,只能除去易沉降的物质。过滤法只能除去难溶性杂质。蒸馏法成本最高,能除去可溶性杂质。
3.沉淀法中,常用加入少量明矾、活性炭作为凝聚剂。活性炭是常用的吸附剂,可物理性吸附色素和异味。
二、物质在水中的分散情况
1.溶液由溶质和溶剂组成。质量关系:溶液质量=溶质质量+溶剂质量。溶液的特点是均一、稳定,静置后不分层。固、液、气态物质都可作为溶质。
2.浊液特征:不均一、不稳定的混合物,静置一段时间后会出现分层现象。
①悬浊液:固体小颗粒悬浮在液体里形成的不均一、不稳定的混合物;
②乳浊液:小液滴分散到液体里形成的不均一、不稳定的混合物。
3.饱和溶液和不饱和溶液
①饱和溶液:是指在一定温度下,在一定量的溶剂里不能继续溶解同种溶质的溶液。
理解饱和溶液与不饱和溶液应注意前提条件是“一定温度、一定量的溶剂”。
②相互转化:饱和溶液和不饱和溶液可以相互转化;对大多数固体物质而言:
eq \x(\a\al(不饱和, 溶液))eq \o(,\s\up11(加溶质、蒸发溶剂、降温),\s\do4(加溶剂、升温))eq \x(\a\al(饱和,溶液))
【知识拓展】
1.对于极少数溶解度随温度升高而降低的物质而言,如熟石灰,采用改变温度的方法使不饱和溶液变为饱和溶液时应升高温度。
2.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。
三、固体物质的溶解度
1.某种物质的溶解度是指在一定的温度下,某物质在100g溶剂中达到饱和状态时所溶解的质量。
2.溶解度的影响因素有:溶质的性质、溶剂的性质、温度。
①大多数固体的溶解度随温度的升高而升高,如KNO3;
②少数固体的溶解度受温度影响不大,如NaCl;
③极少数固体的溶解度随温度的升高而降低,如熟石灰。
3.溶解度曲线:用来表示物质溶解度随温度改变而变化的曲线。曲线上的点表示该物质在相应温度下的溶解度。
【知识拓展】
1.溶解性是一个定性的概念,溶解度是一个定量的概念。
2.理解溶解度的概念应注意四个要点:一定温度、100g溶剂、饱和状态、溶质的质量(单位:g)。
3.由于溶解度规定了一定温度下100g溶剂里达到饱和状态时所能溶解的溶质质量,因此溶解度的大小与溶质、溶剂的多少无关。
四、物质的结晶
1.结晶方法一:蒸发溶剂,适用于溶解度受温度影响变化较小的固体溶质的溶液,如海水晒盐。
2.结晶方法二:冷却热饱和溶液,适用于溶解度受温度影响变化较大的固体溶质的溶液,如培养硫酸铜大晶体、提纯硝酸钾等。
3.某些物质结晶后形成的晶体带有结晶水,如CuSO4·5H2O、Na2CO3·10H2O等,失去结晶水的过程称为风化。
五、溶质质量分数与溶液配制
1.计算公式:a%=×100%
状态:计算时溶液不一定饱和。
2.稀释:进行有关溶液的稀释(或浓缩)的计算时,分析的关键是稀释(或浓缩)前后溶质质量不变。
3.溶液配制
器材:天平、量筒、烧杯、玻璃棒、药匙、胶头滴管。
步骤:①计算;②称量;③溶解;④装瓶贴标签(或转移)。
【知识拓展】
溶质的质量分数是溶质质量占溶液质量的百分比,当已知溶液体积时,应根据密度公式转化为质量。
例1、下列操作均在室温下进行,且不考虑水分的蒸发。则溶液中溶质的溶解度和溶质质量分数都发生变化的是( )
A.将一定量硝酸钾不饱和溶液升温10℃
B.将一定量饱和石灰水升温10℃
C.取一定量蔗糖不饱和溶液向其中加入少量蔗糖
D.取一定量氯化钠饱和溶液向其中加入少量水
例2、“超临界水”因具有许多优良特质而被科学家追捧,它是指当气压和温度达到一定值时,水的液态和气态完全交融在一起的流体。下列有关“超临界水”的说法正确的是( )
A.它是混合物
B.它是一种不同于水的物质
C.它的分子之间有间隔
D.它的一个分子由4个氢原子和2个氧原子构成
例3、海水晒盐是海水在常温下蒸发得到氯化钠的过程。小柯用氯化钠溶液模拟该过程,如图:
(1)乙烧杯中的溶液____(选填“是”“不是”或“可能是”)氯化钠饱和溶液。
(2)要加快氯化钠晶体析出,可以采用的方法是____。
例4、小金在配硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
例5、如图所示为蒸发氯化钠溶液的过程,其中①→②一③为恒温过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A.在①→②过程中,氯化钠的质量分数保持不变
B.在②→③过程中,氯化钠的溶解度不断增大
C.在③→④过程中,水的质量分数不断增大
D.在②→④过程中,氯化钠的质量分数先不变后增大
例6、如图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
请回答:
(1)应称量__________g NaCl,需加水______________mL。
(2)若称量NaCl固体时指针向右偏转,则应____________________直到天平平衡。
(3)取上述溶液10g加水稀释到__________g,可得到5%的NaCl溶液。
例7、实验室有一瓶未开封的浓盐酸,部分标签如图所示。求:
(1)这瓶浓盐酸中溶液的质量为多少克?
(2)若用这瓶浓盐酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸的体积是多少毫升?水的体积是多少毫升?
1.下列有关溶液的说法正确的是( )
A.形成溶液的溶质都是固态物质
B.饱和溶液的溶质质量分数一定比不饱和溶液的溶质质量分数大
C.溶液具有均一性和稳定性
D.所有物质溶于水形成溶液都要吸收热量
2.20℃时,在各盛有100g水的烧杯中,分别加入10g甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是 ( )
A.所得溶液可能都是饱和溶液 B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙 D.升高温度,溶液溶质的质量分数一定变大
3.甲、乙两种固体的溶解度曲线如图所示。将①②两支试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里,升高温度后,下列有关说法正确的是( )
A.甲的溶解度大于乙的溶解度 B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少 D.①溶液中溶质的质量分数大于②溶液
4.台州甘蔗制糖有着悠久的历史。甘蔗制糖的部分环节为:清洗甘蔗→压榨甘蔗→分离渣汁→蒸发浓缩→……
(1)甘蔗在压榨过程中发生的变化属于________。
(2)渣汁的分离与图中的________(选填“A”、“B”或“C”)实验原理相同。
(3)糖汁在蒸发浓缩过程中,溶液的溶质质量分数将怎么变化
5.2020年的新春出现了新冠肺炎疫情,全国人民众志成城、抗击疫情。我国多地采用一天两次高空雾炮进行杀菌消毒(如图),所用的主要消毒液是84消毒液。它是由氯气通入氢氧化钠溶液中制得,有效成分是次氯酸钠(NaClO)。
(1)次氯酸钠中钠、氯、氧元素的原子个数比为________。
(2)制备次氯酸钠的化学方程式为:Cl2+2NaOH=NaCl+NaClO+X,则X的化学式是________。
(3)市售的84消毒液必须经过稀释才能使用,其标签如图所示。现需配制0.2%浓度的消毒液2000kg,需要该消毒液多少千克?加水多少千克?
1.中医药在治疗新冠肺炎中,为全球抗击疫情贡献了中国智慧。下列中药煎制步骤与实验室过滤操作原理相同的是( )
A.冷水浸泡 B.加热煎制
C.取液弃渣 D.装袋保存
2.如图是A、B两物质的溶解度曲线,下列信息中正确的是( )
A.图中阴影部分表明A、B两溶液都是饱和溶液
B.t1℃时,A、B两饱和溶液的溶质质量分数相等
C.t2℃时,B物质的溶解度大于A物质的溶解度
D.t2℃时,等质量的A、B两饱和溶液降温到t1℃时析出溶质的质量相等
3.50℃的饱和石灰水400克平均分成两份,将一份降温至20℃;另一份加入生石灰0.5克,温度仍保持50℃。在这两种情况下,下列说法正确的是( )
A.溶质质量相同 B.都会变浑浊 C.溶质质量分数相同 D.溶质的溶解度相同
4.下表是A、B、C三种固体物质在不同温度下(t1
物质A(克) 36.0 36.2 37.3
物质B(克) 31.6 36.2 110.0
物质C(克) 0.165 0.135 0.076
(1)________℃时,A、B两种物质的溶解度相同。
(2)t1℃时,分别取等量的B、C饱和溶液于试管甲、乙中(如图)。将试管放入盛有水的烧杯中,向烧杯中加入一定量硝酸铵(不考虑试管中水的变化),有固体析出的试管为________(选填“甲”或“乙”)。
(3)t2℃时,将10克A固体放入40克水中,充分搅拌后,所得溶液中溶质的质量分数为________。
5.在“探究稀盐酸和稀硫酸的化学性质”实验中,小科发现镁带与稀盐酸反应后的试管内出现了灰白沉淀。
【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】
(1)从步骤二可知,灰白色沉淀不可能是氯化镁,因为滤液是氯化镁的________(填“饱和”或“不饱和”)溶液。
(2)从步骤三可知,该沉淀中没有________。
(3)步骤四中将滤渣用蒸馏水充分洗涤是为了________。
(4)根据实验探究可知,该反应产生的灰白色沉淀中一定含有________。
答案及解析
例1、B
【解析】温度升高,硝酸钾的溶解度升高,但其不饱和溶液的质量分数不变;氢氧化钙的溶解度随温度的升高而降低,升温后溶解度和溶质质量分数都发生变化;溶解度与溶质或溶剂的量无关,加入溶质溶剂都不会改变溶解度。
例2、“C
【解析】“超临界水”中的液态水和气态水都是由水分子构成的,属于纯净物。“超临界水”与普通水的物理性质不同,但化学性质相同。无论是气态、液态还是固态的水,其水分子之间都存在间隔。每个水分子都是由一个氧原子和两个氢原子构成。
例3、可能是 加快液面空气流速
【解析】(1)甲一定是不饱和溶液,乙可能是饱和溶液,丙、丁一定是饱和溶液。(2)氯化钠的溶解度受温度变化很小,不能用改变温度的方法使氯化钠结晶析出。要加快氯化钠晶体析出,可以采用的方法是加快液面空气流速,加快水的蒸发。
例4、D
【解析】A.根据①可知,硝酸钾溶解的质量为:120.9g-100g=20.9g,因此10℃时,100g水中最多溶解硝酸钾20.9g,因此此时它的溶解度为20.9g,故A错误;
B.根据②中数据可知,此时硝酸钾全部溶解,没有任何信息能够说明此时溶液不能再继续溶解硝酸钾,因此无法确定溶液是否饱和,故B错误;
C.若通过加热将①中剩余硝酸钾全部溶解,那么溶液中溶质的质量增大了,根据可知,溶液的溶质质量分数比加热前变大了,故C错误;
D.若将②所得溶液降温至10℃,溶质的质量会由40g变为20.9g,根据可知,溶液的溶质质量分数会变小,故D正确。
例5、D
【解析】根据蒸发原理分析,蒸发溶剂有恒温蒸发和升温蒸发,无论哪一种,溶剂都会减小,但溶质质量分数和溶解度可能不变。
在①→②过程为恒温蒸发,氯化钠的质量分数会增大,错误;
B、在②→③过程中,加热时氯化钠的溶解度增大,蒸发过程保持温度不变,则溶解度也保持不变,错误;
C、在③→④过程中,水的质量分数不断减小,错误;
D、在②→④过程中,氯化钠的质量分数先不变后增大,正确。
例6、7.5 42.5 继续向左盘添加氯化钠 30
【解析】(1)溶质质量=溶液质量×溶质的质量分数,配制50g 15%的氯化钠溶液,需氯化钠的质量=50g×15%=7.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-7.5g=42.5g(合42.5mL)。(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加氯化钠固体;若发现指针向右偏转,说明氯化钠的质量小于砝码和游码显示的质量和,故应继续向左盘添加氯化钠,直至天平平衡。(3)溶液具有均一性,取出的溶液溶质质量分数为15%,设稀释后溶液的质量为x,根据溶液稀释前后溶质质量不变,则10g×15%=x×5%,x=30g。
例7、590g 45.8mL 146mL
【解析】(1)这瓶浓盐酸中溶液的质量:m=ρV=1.18g/mL×500mL=590g。
(2)稀释溶液时,溶质质量不变。则m浓×37%=200g×10%,
m浓≈54g,m水=200g-54g=146g,
需取浓盐酸的体积:V浓==≈45.8mL,需加水的体积:V水=146mL。
1.C
【解析】形成溶液的溶质既可以是固态物质,也可以是气态、液态物质。有些饱和溶液是很稀的溶液,有时较高温度的不饱和溶液会比较低温度的饱和溶液的溶质质量分数要大。有些物质溶于水形成溶液要吸收热量,但有些物质溶于水则要放出热量。
2.A
【解析】图所示,甲剩余最多,乙全部溶解,丙有较少剩余,所以甲、丙的溶液一定饱和,乙的溶液可能饱和也可能不饱和。其中乙的溶液的溶质质量最大,甲的最小。溶液的溶质质量分数:乙>丙>甲。未明确甲、乙、丙的溶解度与温度的关系,无法确定升温后溶液的溶质质量分数的变化。
3.C
【解析】A、比较溶解度时,要规定一定温度,且这里所给信息不足无法判断甲、乙溶解度的大小,A错误;
B、 ①②两溶液 ,原来均有少量未溶解的固体,所以判断为饱和溶液,升高温度后,甲溶解度增大,乙溶解度减小,所以乙肯定仍是饱和溶液,而甲无法判断,B错误;
C、升高温度后, ① 甲溶解度增大,所以固体会继续溶解,溶液质量增加, ② 乙溶解度减小,晶体会析出,溶液质量减少,C正确;
D、因为题中信息不足,无法比较出 ①溶液 和 ②溶液 质量分数的大小,D错误。
4.(1)物理变化 (2)B (3)变大(或“先变大后不变”)
【解析】(1)甘蔗在压榨过程中,只是它的形状和存在状态发生改变,而没有新物质生成,因此属于物理变化;
(2)渣汁的分离其实就是将液态的糖汁和固态的渣子分离,因此与过滤操作原理相同,故选图B;
(3)糖汁在蒸发浓缩过程中,当没有饱和时,没有晶体析出,溶质质量不变但溶剂质量减少,根据可知,溶液的溶质质量分数增大。当达到饱和后,会不断析出晶体,但是溶质的质量分数保持不变。
5.(1)1:1:1
(2)H2O
(3)设需要该消毒液的质量为m
2000千克×0.2%=m×25%
m=16千克
加水质量=2000千克-16千克=1984千克
【解析】(1)由次氯酸钠的化学式可知, 次氯酸钠中钠、氯、氧元素的原子个数比为 1:1:1;
(2)化学反应前后原子种类和个数都不变,由方程式可知,反应前原子种类和个数为:氯2、钠2、氢2、氧2,反应后为:氯2、钠2、氧1,则X中含2个氢原子和1个氧原子,化学式为 H2O ;
1.C
【解析】在冷水浸泡、加热煎制、取液弃渣和装袋保存四个环节中,取液弃渣是将药液和不溶于药液的残渣进行分离,与过滤操作相同,故C正确,而A、B、D错误。
2.B
【解析】图中阴影部分表明A溶液是饱和溶液,B溶液是不饱和溶液。t1℃时,A、B两物质的溶解度相等,所以饱和溶液的溶质质量分数相等。通过分析溶解度曲线可知,t2℃时,A物质的溶解度大于B物质的溶解度,t1℃时,A、B两物质的溶解度相等,所以等质量的A、B两饱和溶液降温到t1℃时析出溶质的质量A大于B。
3.C
【解析】(1)氢氧化钙的溶解度随温度的升高而减小,随温度的降低而增大;
(2)当温度不变时,同种物质饱和溶液的溶质质量分数相同。
50℃时将等质量的两份饱和石灰水,其中一份冷却到20℃,由于氢氧化钙的溶解度增大,所以不会析出,即溶质和溶剂的质量保持不变,也就是溶质的质量分数不变;
另一份加入生石灰0.5g,生石灰与水反应生成氢氧化钙,由于溶剂减少,因此氢氧化钙会析出,从而导致溶质质量减小,溶液的质量也会减小。由于温度仍然保持50℃,而石灰水又是饱和溶液,所以溶质的质量分数保持不变。
A.前一份石灰水的溶质质量不变,后一份石灰水的溶质质量减小,故A错误;
B.前一份石灰水为不饱和溶液,没有氢氧化钙析出;而后一份则为饱和溶液,有氢氧化钙析出,会变浑浊,故B错误;
C.两份溶液的溶质质量分数相同,故C正确;
D.两份溶液的温度不变,因此溶质的溶解度不同,故D错误。
4.(1)t2 (2)甲 (3)20%
【解析】溶解度,符号S,在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度。溶液中溶质的质量分数是溶质质量与溶液质量之比。
【解答】(1)由表格中可知,A、B在 t2 ℃时,溶解度都是36.2g;
(2)由表格中的数据可知,物质B的溶解度随着温度的升高而增大,物质C的溶解度随着温度的升高而降低;硝酸铵溶于水吸收热量,溶液温度降低,B物质的溶解度降低,所以试管甲中有物质析出;
(3)t2℃时,A物质的溶解度为36.0g,所以40g溶剂可以溶解A的质量为:所以10gA能够完全溶解在40g水中;其溶质质量分数为;
5.(1)不饱和
(2)Mg
(3)洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验
(4)Mg(OH)Cl
【解析】(1)由步骤二加入氯化镁粉末,粉末全部溶解可知,所得滤液是氯化镁的不饱和溶液;
(2)步骤三中 加入适量稀盐酸,沉淀全部溶解 ,而镁与盐酸反应会产生氢气,由此可知沉淀中没有镁;
(3)滤渣上会附着有氯化镁,步骤四中将滤渣用蒸馏水充分洗涤是为了 洗去滤渣表面的氯化镁,防止氯化镁干扰后续实验 ;
(4)滤渣中加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生,说明含有氯离子,由此可知该反应产生的灰白色沉淀中一定含有 Mg(OH)Cl ;
2023浙教版科学中考第一轮复习--化学模块(五)
水和溶液
同课章节目录
