【备考2023】浙教版科学中考第一轮复习--化学模块(十四):化学计算【word,含答案解析】
文档属性
| 名称 | 【备考2023】浙教版科学中考第一轮复习--化学模块(十四):化学计算【word,含答案解析】 |  | |
| 格式 | doc | ||
| 文件大小 | 371.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-25 16:23:37 | ||
图片预览




文档简介
一、有关化学方程式的计算
1.有关化学方程式计算的注意点
认真细心:化学方程式书写正确;相对分子质量要准确;代入化学方程式中计算的相关量必须是纯净物质的质量。
要注意反应中的条件,如“充分反应”“完全反应”“恰好反应”“足量”“过量”等关键性词语,以作出正确判断。
2.有关反应物和生成物的计算
化学方程式能表达出多种量的关系,这些关系都是解答相关化学方程式问题中隐含的已知条件,这些条件都可以作为计算时的“桥梁”,是整个计算题的基础和依据。
3.不纯物的计算
化学方程式中所表示的反应物和生成物都是指纯净物,不纯物质不能代入方程式进行计算。遇到不纯物质时,需要将不纯物质换算成纯净物质的量,才能代入方程式,按质量比进行计算。计算关系为:纯净物的质量=不纯物的质量×纯净物的质量分数。
4.有关无数据计算题
计算题需要数据,但有许多化学计算题缺少数据甚至无数据,这就需要假设数据。假设数据也有技巧,否则会使计算变得复杂。巧解方法:(1)如果题目中只有百分含量的数据,则应该假设百分数分母代表的物质为100g;(2)如果题目中什么数据都没有,则应该根据某一物质的相对分子质量来假设数据。
二、有关化学式的计算
(一)根据化学式的计算
1.求相对分子质量
相对分子质量是指化学式中各原子相对原子质量的总和。在计算的过程中应注意化学式前面的数字(系数)与相对分子质量及元素符号右下角的数字与相对原子质量之间的关系是“相乘”不是“相加”;若计算结晶水合物的相对分子质量时,化学式中间的“·”表示的是“相加”不是“相乘”。例:CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=160+5×18=250。
2.求化合物中各元素的质量比
以化合物AmBn为例。A、B元素的质量比:。
例:计算氧化铁Fe2O3中铁元素和氧元素的质量比。Fe∶O=(56×2)∶(16×3)=112∶48=7∶3。
3.求化合物中某元素的质量分数
化合物中任一元素的质量分数可以用下式计算:
某元素的质量分数=×100%。
混合物中某物质的质量分数=×100%。
(二)确定化学式的计算
1.根据化合物中各元素的质量比求化学式
将各元素的质量分别除以其相对原子质量,得到的商之比即为相应的原子个数之比,继而确定其化学式。
例:某硫的氧化物中S、O元素的质量比为2∶3,确定硫的氧化物的化学式。
S、O原子个数比为∶=1∶3,所以化学式为SO3。
2.根据化合物中某元素的质量分数求化学式
已知某化合物中某元素的质量分数和相对分子质量,可确定该化合物中各原子个数之比,进而确定其化学式。
例:某铁的氧化物中Fe%=70%,确定其化学式。可设该氧化物化学式为FexOy,则Fe%=×100%=70%,解得x∶y=2∶3,则其化学式为Fe2O3。
3.根据化合价确定化学式
化合物中各元素的化合价代数和为0,利用这一点可确定化合物中各元素原子个数比。
三、有关溶液的计算
有关溶液的计算中要准确分析溶质、溶剂、溶液的质量,最基本的质量关系是:溶质质量+溶剂质量=溶液质量。
1.溶质质量分数的公式
溶质质量分数=×100% 溶质质量=溶液质量×溶质质量分数
溶液质量= 溶液质量=溶液体积×溶液密度
【知识拓展】
1.计算时溶质必须全部溶于溶剂中且不与溶剂发生反应。若溶质没有全部溶解,则溶质的质量只计算溶解部分。
2.若溶质与水发生反应,则须计算出反应后溶解在水中的产物质量,如6.2g Na2O溶解在水中,其溶质应为NaOH而不是Na2O。
3.若溶质带有结晶水,其结晶水应作为溶剂水的质量计算,如25g CuSO4·5H2O溶解于一定量水中时,溶质质量为16g而不是25g。
2.有关溶液浓缩与稀释的计算
溶液稀释
稀溶液的溶质质量的和
溶液浓缩
稀溶液的溶质质量的和
3.有关溶液与化学方程式的综合计算
在根据化学方程式进行化学计算时,各反应物、生成物之间,要以溶质质量列比例,而不能直接用溶液质量或体积列比例。
例1、N(NO2)3是科学家近年发现的一种新型火箭燃料。下列关于N(NO2)3的说法正确的是( )
A.N(NO2)3的相对分子质量为152
B.N(NO2)3中氮元素与氧元素的质量比是2∶3
C.N(NO2)3中总共有3个N原子和6个O原子
D.N(NO2)3中氮元素的质量分数为×100%
例2、有一种高效安全灭菌消毒剂可以给饮用水消毒,该消毒剂可表示为RO2。实验测得该氧化物中R与O的质量比为71∶64,则RO2的化学式为( )
A.CO2 B.NO2 C.SO2 D.ClO2
例3、有5.85g NaCl样品(其中含少量下列一种盐),已知氯元素的质量为3.59g,则可能混入的盐是( )
A.KCl B.FeCl2
C.MgCl2·6H2O D.AlCl3
例4、据报道,“火星快车”号探测器在火星大气层中发现了一种二氧化碳分子,它的化学式可表示为:C16O18O(元素符号左上角的数字代表该原子中质子数和中子数之和)
(1)18O中的质子数是________中子数是________
(2)相同分子数的C16O2和C16O18O.分别与足量CaO化合全部转化为CaCO3,生成CaCO3的质量前者________后者(选填“大于”“小于”或“等于”)
例5、如图所示是浓盐酸试剂瓶标签的部分内容。请回答下列问题:
(1)配制10%的稀盐酸200g,需要这种浓盐酸的体积约为____mL(精确到1mL)。
(2)某固体氢氧化钠在空气中敞口放置一段时间后部分变质,取该固体10g,加入质量分数为10%的盐酸至恰好不再产生气泡为止,生成气体的质量为2.2g,试通过计算说明:该固体中未变质的氢氧化钠的质量是多少克?
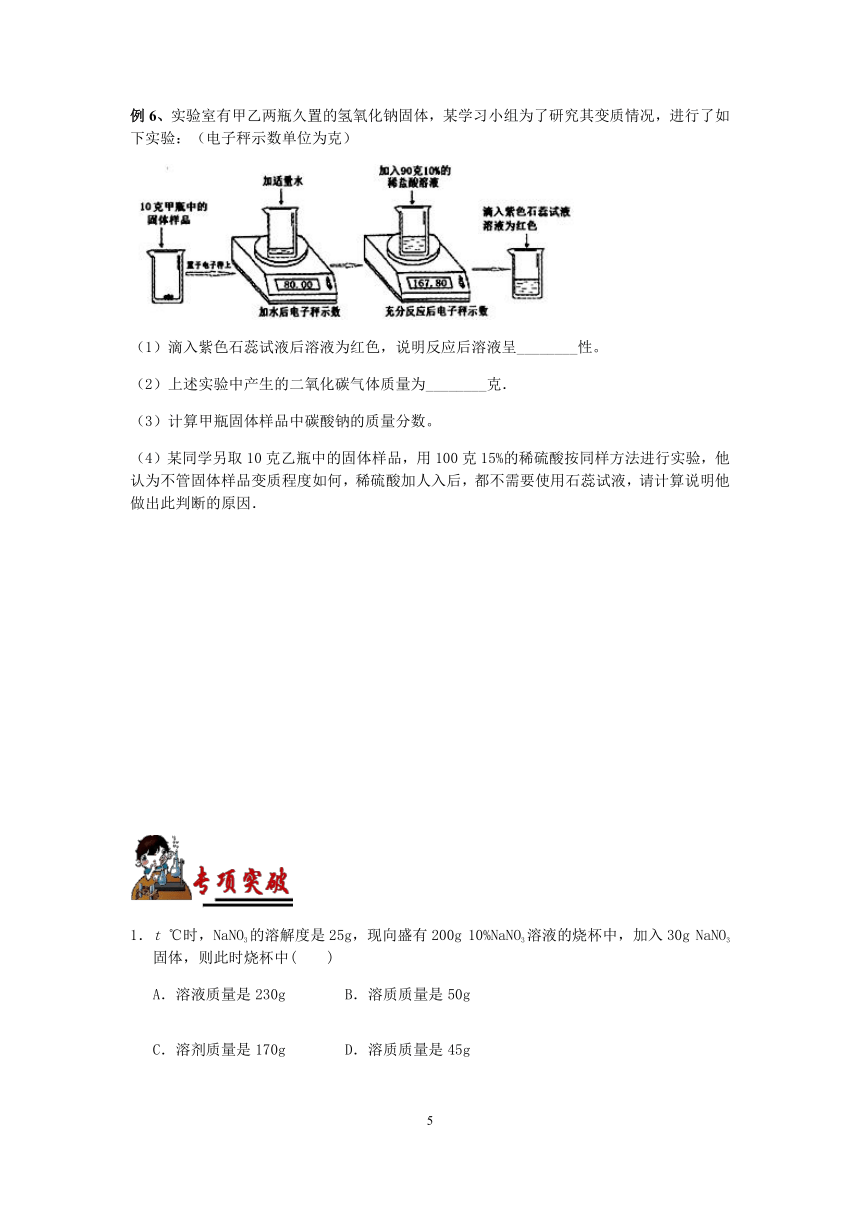
例6、实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈________性。
(2)上述实验中产生的二氧化碳气体质量为________克.
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.
1.t ℃时,NaNO3的溶解度是25g,现向盛有200g 10%NaNO3溶液的烧杯中,加入30g NaNO3固体,则此时烧杯中( )
A.溶液质量是230g B.溶质质量是50g
C.溶剂质量是170g D.溶质质量是45g
2.我国科学家发现用含硒(Se)化合物亚硒酸钠能消除掉加速人体衰老的活性氧。亚硒酸钠中的硒元素为+4价,氧元素为-2价,则亚硒酸钠的化学式为( )
A.Na2SeO3 B.Na2SeO4 C.NaSeO3 D.Na2SeO2
3.由硫化亚铁(FeS)和溴化亚铁(FeBr2)组成的混合物中铁元素的质量分数为46.2%,则溴元素的质量分数为( )
A.72.6% B.27.4%
C.34.3% D.36.3%
4.在一定质量的某NaCl溶液中加入足量AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液质量的1/4。则原NaCl溶液中溶质的质量分数约为( )
A.40% B.30% C.20% D.10%
5.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是( )
A.10% B.25% C.30% D.35%
6.溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是()
A.a点对应溶液中溶质是MgCl2 B.Ba(OH)2溶液的溶质质量分数为17.1%
C.b-c段是MgSO4与Ba(OH)2反应 D.0-a段产生的沉淀是BaSO4与Mg(OH)2
7.A、B、C为三种元素的符号,A、B2-、C+三种微粒都具有10个核外电子,A的元素符号为____,C2B的化学式为____,B元素与氢元素组成的化合物的化学式为____(写出一种即可)。
8.设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。
【实验目的】检验氢氧化钠溶液中是否含有氢氧化钙。
从组成上看,氢氧化钙和氢氧化钠都属于碱,所以具有相似的化学性质。如果在它们的水溶液中滴加酚酞溶液,都能看到的现象是________;但由于电离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能电离出CO32﹣的试剂,利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。
实验操作 现象 结论
方案一 取少量待测溶液于试管中,通入CO2 出现白色沉淀 氢氧化钠溶液中含有氢氧化钙
方案二 取少量待测溶液于试管中,滴加Na2CO3溶液 出现白色沉淀
(2)【设计方案并实验】写出方案二中出现白色沉淀反应的化学方程式________。
【方法感悟】在检验物质时,要分析物质的组成和性质,据此选择加入恰当的试剂,最后根据不同现象得出结论。
(3)【定量研究】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取10g该样品,加入54g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH,当pH=7时,刚好用去10%的稀盐酸73g。计算:
①将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水多少?
②样品中氢氧化钠的质量分数。
(4)反应后所得溶液中溶质的质量分数。
1.由NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为32%,则该混合物中氧元素的质量分数为( )
A.32% B.64% C.44% D.84%
2.一定质量的某有机化合物完全燃烧,生成2.2g CO2和1.8g H2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8g O2,该有机化合物的化学式可能是( )
A.C2H4 B.CH4O C.CH4 D.C2H4O
3.将100g 10%的某固体物质M溶液,分别进行下列操作,所得溶液中溶质质量分数最大的是( )
A.蒸发掉10g水,无晶体析出 B.加入10g 10%的M溶液
C.加入10g固体M,并使之完全溶解 D.加入10g水
4.我国科学家屠呦呦由于成功提取出青蒿素,获得了 2015年诺贝尔生理学或医学奖。青蒿 素的化学式为 C15H22O5。试计算:
(1)青蒿素的相对分子质量为____。
(2)青蒿素中,各元素质量的最简整数比为 m(C)∶m(H)∶m(O)=____。
5.有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种。为了确定其组成,小明称取了9.3克粉末,向其中加人100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为________。
(2)这包白色粉末的成分为________。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
6.某有机物样品一定含C、H元素,可能含O元素,如图是用燃烧法来确定其组成的实验装置:在电炉加热时用纯净氧气氧化管内样品,并用氧化铜将有机物中的碳元素全部转化为二氧化碳,最后根据产物的质量确定有机物的组成。请回答下列问题:
(1)a中盛放的试剂是________;
(2)F装置的作用是________;
(3)若去掉B装置,对________元素的测量结果无影响;
(4)准确称取1.12g样品,经充分燃烧后,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为________ 。
答案及解析
例1、A
【解析】N(NO2)3的相对分子质量=14×4+16×6=152。N(NO2)3中氮元素和氧元素的质量比为(14×4)∶(16×6)=7∶12。N(NO2)3由分子构成,而不是由原子直接构成的,每个N(NO2)3分子中含有4个N原子和6个O原子。N(NO2)3中氮元素的质量分数为×100%。
例2、D
【解析】根据元素质量比例可算出R的相对原子质量为35.5,从而推出R为Cl元素。
例3、D
【解析】5.85g纯净的NaCl含氯元素的质量为3.55g,故样品中的杂质所含氯元素的质量分数应大于NaCl中氯元素的质量分数。通过计算,KCl、FeCl2、MgCl2·6H2O和AlCl3所含氯元素的质量分数分别为48%、56%、34%和80%,NaCl所含氯元素的质量分数为60.7%。只有AlCl3所含氯元素的质量分数大于NaCl。
例4、(1)8;10 (2)小于
【解析】根据氧原子质量数分析,根据左上角数字为相对原子质量,相对原子质量大则原子实际质量大。
(1)18O为氧原子,质子数是8,中子数为16-8=10;
(2)C16O18O 中氧原子质量大于 C16O2 ,所以分别与足量CaO化合全部转化为CaCO3,生成CaCO3的质量 C16O2小于C16O18O 。
例5、47
(2)固体氢氧化钠在空气中敞口放置会吸收空气中的CO2而变质为Na2CO3。设10g样品中碳酸钠的质量为x,
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2g
=,x=5.3g,
固体中未变质的氢氧化钠的质量为10g-5.3g=4.7g。
【解析】 (1)溶液稀释过程中溶质质量不变,则m浓×36%=m稀×10%,ρ浓V浓×36%=m稀×10%,1.18g/cm3×V浓×36%=200g×10%,V浓≈47cm3=47mL。
例6、(1)酸(2)2.2
(3)设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
x 2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%
(4)假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+ H2SO4=Na2SO4+2H2O
80 98
10克 y×15%
80:10克=98:(y×15%)
y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+ H2SO4===Na2SO4+H2O+CO2↑
106 98
10克 z×15
106:10克=98:(z×15%)
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
【解析】该题主要是结合NaOH变质情况的探究实验,综合考查了化学反应之后溶液的分析与计算;
【解答】(1)紫色石蕊试剂遇酸变红色,遇碱变蓝色;而题目中石蕊变红色,说明是酸性溶液;故答案为:酸;(2)由图可知,实验过程中使用电子天平,而气体的质量则是反应前后变化的质量;所以反应前的总质量为:80g+90g=170g;而反应后总质量为:167.8g;所以气体质量为:170g-167.8g=2.2g;故答案为:2.2;(3)实验中产生的二氧化碳都是来自变质产生的碳酸钠,知道二氧化碳气体的质量,然后根据化学方程式计算即可;故答案为:设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
x 2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%;
⑷该题是为了验证不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液;采取极限情况分析即可;即固体样品没有变质只有NaOH和完全变质只有碳酸钠,计算100克15%的稀硫酸是否过量,如果两种情况均过量则该同学的观点是对的,反之是错误的;故答案为:假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+ H2SO4=Na2SO4+2H2O
80 98
10克 y×15%
80:10克=98:(y×15%) y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+ H2SO4===Na2SO4+H2O+CO2↑
106 98
10克 z×15
106:10克=98:(z×15%)
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
1.D
【解析】 t ℃时原NaNO3溶液中m(NaNO3)=200g×10%=20g,m溶剂=200g×90%=180g。设溶液达到饱和时,需加入NaNO3的质量为x,=,解得x=25g。此时NaNO3饱和溶液中溶质的质量为45g,溶剂的质量仍为 180g,溶液总质量为225g。
2.A
【解析】 亚硒酸钠中的硒元素为+4价,氧元素为-2价,钠为+1价。根据化学式中各元素的化合价代数和为零的原则,把三种元素的化合价代入公式中,等于零的即正确。
3.C
【解析】 利用相对原子质量间的数量关系,以5个S代替2个Br完成转化:FeBr2―→FeS·4S。因FeS的质量分数为46.2%÷=72.6%,则4S的质量分数为1-72.6%=27.4%,故Br的质量分数为27.4%×≈34.3%。
4.D
【解析】 根据题意可知,AgCl沉淀质量×4=原NaCl溶液质量,假设AgCl沉淀质量为一定值,根据反应的化学方程式中的质量比即可计算出NaCl的质量。设生成AgCl的质量为a,设NaCl的质量为x,
NaCl+AgNO3===AgCl↓+NaNO3
58.5 143.5
x a
=,x=,
原NaCl溶液中溶质的质量分数:×100%≈10%。
5.B
【解析】假设混合物共100g,设混合物中只有FeO和CaCO3,则含Fe 56g,则与Fe结合的O质量为16g,CaCO3的质量为100g-56g-16g=28g,故CaCO3质量分数为28%;同理若混合物中只有Fe2O3和CaCO3,则含Fe 56g,与Fe结合的O质量为56g×=24g,CaCO3的质量为100g-56g-24g=20g,CaCO3的质量分数为20%,所以CaCO3的质量分数介于20%~28%之间。
6.B
【解析】向其中逐滴滴加Ba(OH) 2 溶液, 因为碱和酸先进行反应,所以开始一段时间内应该是HCl与 Ba(OH) 2 反应生成BaSO4沉淀;当HCl完全反应后, MgSO4与Ba(OH) 2反应生成BaSO4和Mg(OH) 2沉淀;当 MgSO 4完全反应后,溶液中的MgCl2再与 Ba(OH) 2 反应生成 Mg(OH) 2沉淀,据此进行解答。
【解答】A.在0~a阶段,反应如下:
Ba(OH) 2+2HCl=BaCl2+2H2O,
BaCl2+MgSO4=BaSO4↓+MgCl2;
因此a点对应的溶液中的溶质是MgCl2和Ba(OH)2,故A错误;
B.根据图像可知,当加入100gBa(OH)2溶液时产生BaSO4沉淀23.3g,
设Ba(OH)2溶液中溶质质量为x,
根据:Ba(OH)2→BaSO4↓
171 233
x 23.3g
那么:x=17.1g;
Ba(OH)2溶液中溶质质量分数为: ,故B正确;
C.b-c段 的反应为: ,故C错误;
D.0~a段产生的沉淀是 BaSO4 ,故D错误。
7.Ne Na2O H2O(或H2O2)
【解析】A不带电荷,所以A为原子,核外有10个电子,则A为10号元素氖(Ne)。B2-是B得到2个电子后形成的离子,该离子核外电子数也为10,所以B为8号元素氧(O)。C失去一个电子后形成C+,其核外电子也为10,所以C为11号元素钠(Na)。
8.(1)溶液由无色变红色
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(3)①m浓×A%=m稀×a%
200g×38%=(200g+m水)×10%
m水=560g
②设氢氧化钠的质量为x,
NaOH + HCl = NaCl+H2O
40 36.5 58.5
x 73g×10% y
40:x=36.5:(73g×10%)
x=8g
NaOH%=8g/10g×100%=80%
(4)设生成氯化钠的质量为y
36.5:(73g×10%)=58.5:y
y=11.7g
NaCl%=(11.7g+10g-8g)/(10g+54g+73g)×100%=10%
【解析】(1)根据碱性溶液能使酚酞溶液变红分析;
(2)根据氢氧化钙与碳酸钠反应可生成碳酸钙沉淀和氢氧化钠分析;
(3)根据溶液稀释前后溶质质量不变及方程式计算方法分析,由反应的盐酸的质量代入方程式中计算出氢氧化钠质量,从而计算氢氧化钠质量分数;
(4)由反应的盐酸的质量代入方程式中计算生成氯化钠,再计算出混合物中氯化钠,最后由溶质质量分数=溶质质量/溶液质量计算生成溶液溶质质量分数分析;
【解答】(1)碱的溶液都呈碱性,能使酚酞溶液变红;
(2)方案二中氢氧化钙与碳酸钠反应可生成碳酸钙沉淀和氢氧化钠,反应方程式为 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ;
1.C
【解析】 用相对原子质量间的数量关系,以1个Mg代替1个Na和1个H完成转化:NaHS→ MgS、NaHSO3→MgSO3。从MgS、MgSO4、MgSO3三种化合物的化学式看,它们有共同的部分“MgS”,并且都有如下对应关系:Mg~S,其质量对应关系为24~32,即当S%=32%时,Mg%=24%。所以该混合物中氧元素的质量分数为1-32%-24%=44%。
2.B
【解析】由有机化合物燃烧生成2.2g CO2和1.8g H2O可求得有机化合物中C原子和H原子的个数比为1∶4。若为C选项,3.2g 的CH4完全燃烧消耗的氧显然大于4.8g,不符合题意。3.2g 的CH4O完全燃烧恰好消耗4.8g的O2。
3.C
【解析】 100g 10%的某固体物质M溶液蒸发掉10g水(无晶体析出),其质量分数为10g/90g≈11.1%;加入10g 10%的M溶液后溶质质量分数仍为10%;加入10g固体M,并使之完全溶解后的质量分数为20g/110g≈18.2%;加入10g水后其溶质质量分数变小。
4.282 90∶11∶40
【解析】(1)青蒿素的相对分子质量为12×15+1×22+16×5=282。(2)青蒿素中碳、氢、氧三种元素的质量比为:(12×15)∶(1×22)∶(16×5)=90∶11∶40。
5.(1)2HCl+Na2CO3=2NaCl+CO2↑+H2O
(2)氢氧化钠和碳酸钠
(3)解:设固体粉末中含碳酸钠x克,与碳酸钠反应消耗HCl y克, 同时生成NaCl z克:
2HCl+ Na2CO3= 2NaCl+ CO2↑+H2O
36.5×2 106 58.5×2 44
y x z 100+9.3-107.1
解得:x=5.3(克)
y=3.65(克)
z=5.85(克)
设固体粉末中含氢氧化钠a克,与盐酸反应后生成NaCl b克
HCl+ NaOH= NaCl+H2O
36.5 40 58.5
100×7.3%-3.65 a b
解得:a=4(克)
b=5.85(克)
因为固体总质量为9.3克,等于碳酸钠与氢氧化钠的质量和,所以固体中无氯化钠。所以,所得溶液中溶质的质量分数= ×100%=10.9%
【解析】(1)根据碳酸钠与盐酸反应会产生二氧化碳气体分析;
(2)根据溶液呈中性,说明盐酸全部反应,再由方程式计算出若盐酸全部与碳酸钠反应消耗碳酸钠质量,由固体总质量判断氢氧化钠的存在分析;
(3)根据碳酸钠和氢氧化钠都能与盐酸反应生成氯化钠,通过方程式计算出氯化钠质量,再计算氯化钠的溶质质量分数分析。
【解答】(1)碳酸钠与盐酸反应会产生二氧化碳、氯化钠和水,所以产生二氧化碳气体的方程式为 2HCl+Na2CO3=2NaCl+CO2↑+H2O ;
(2) 加人100克7.3%的稀盐酸充分反应, 所得溶液呈中性,盐酸中溶质质量为7.3克,设盐酸全部与碳酸钠反应时消耗碳酸钠质量为x
2HCl+Na2CO3=2NaCl+CO2↑+H2O
73 106
7.3g x
73:106=7.3g:x
x=10.6g,而固体总质量为9.3克,说明还含有其它与盐酸反应的氢氧化钠,白色粉末的成分为碳酸钠和氢氧化钠;
6.(1)H2O2
(2)防止空气中的CO2在E被吸收从而干扰实验
(3)C
(4)C、H
【解析】1、由题意可知,此实验主要通过A产生的氧气与样品反应,全部生成水和二氧化碳,D装置吸收水蒸气,E装置吸收二氧化碳,根据D、E装置得到水和二氧化碳的质量来确定有机物的组成;
2、实验中空气中的成分不能进入干扰水和二氧化碳质量的测定;
3、B装置的浓硫酸主要是吸收A装置中带出的水蒸气的,去掉后水蒸气的质量偏大,引起H元素质量偏大,不影响C元素的测量;
4、计算出水中含有的H元素和二氧化碳中C元素的质量,与样品质量比较可确定有机物中含有的元素。
【解答】(1)实验中样品要于氧气反应,所以A装置是制取氧气的装置,用液体和固体混合制取氧气的,液体应该是H2O2;
(2)F装置接NaOH溶液,NaOH溶液易于空气中的二氧化碳反应,所以接F装置的作用是 防止空气中的CO2在E被吸收从而干扰实验 ;
(3)B装置的浓硫酸主要是吸收A装置中带出的水蒸气的,去掉后水蒸气的质量偏大,引起H元素质量偏大,不影响C元素的测量;
(4)D装置吸收生成的水蒸气质量为1.44g,E装置吸收生成的二氧化碳质量为3.52g
有机物中H元素的质量为:
有机物中C元素的质量为:
C和H元素的总质量为:0.16g+0.96g=1.12g,所以样品只含C、H元素,不含O元素。
2023浙教版科学中考第一轮复习--化学模块(十四)
化学计算
1.有关化学方程式计算的注意点
认真细心:化学方程式书写正确;相对分子质量要准确;代入化学方程式中计算的相关量必须是纯净物质的质量。
要注意反应中的条件,如“充分反应”“完全反应”“恰好反应”“足量”“过量”等关键性词语,以作出正确判断。
2.有关反应物和生成物的计算
化学方程式能表达出多种量的关系,这些关系都是解答相关化学方程式问题中隐含的已知条件,这些条件都可以作为计算时的“桥梁”,是整个计算题的基础和依据。
3.不纯物的计算
化学方程式中所表示的反应物和生成物都是指纯净物,不纯物质不能代入方程式进行计算。遇到不纯物质时,需要将不纯物质换算成纯净物质的量,才能代入方程式,按质量比进行计算。计算关系为:纯净物的质量=不纯物的质量×纯净物的质量分数。
4.有关无数据计算题
计算题需要数据,但有许多化学计算题缺少数据甚至无数据,这就需要假设数据。假设数据也有技巧,否则会使计算变得复杂。巧解方法:(1)如果题目中只有百分含量的数据,则应该假设百分数分母代表的物质为100g;(2)如果题目中什么数据都没有,则应该根据某一物质的相对分子质量来假设数据。
二、有关化学式的计算
(一)根据化学式的计算
1.求相对分子质量
相对分子质量是指化学式中各原子相对原子质量的总和。在计算的过程中应注意化学式前面的数字(系数)与相对分子质量及元素符号右下角的数字与相对原子质量之间的关系是“相乘”不是“相加”;若计算结晶水合物的相对分子质量时,化学式中间的“·”表示的是“相加”不是“相乘”。例:CuSO4·5H2O的相对分子质量=64+32+16×4+5×(1×2+16)=160+5×18=250。
2.求化合物中各元素的质量比
以化合物AmBn为例。A、B元素的质量比:。
例:计算氧化铁Fe2O3中铁元素和氧元素的质量比。Fe∶O=(56×2)∶(16×3)=112∶48=7∶3。
3.求化合物中某元素的质量分数
化合物中任一元素的质量分数可以用下式计算:
某元素的质量分数=×100%。
混合物中某物质的质量分数=×100%。
(二)确定化学式的计算
1.根据化合物中各元素的质量比求化学式
将各元素的质量分别除以其相对原子质量,得到的商之比即为相应的原子个数之比,继而确定其化学式。
例:某硫的氧化物中S、O元素的质量比为2∶3,确定硫的氧化物的化学式。
S、O原子个数比为∶=1∶3,所以化学式为SO3。
2.根据化合物中某元素的质量分数求化学式
已知某化合物中某元素的质量分数和相对分子质量,可确定该化合物中各原子个数之比,进而确定其化学式。
例:某铁的氧化物中Fe%=70%,确定其化学式。可设该氧化物化学式为FexOy,则Fe%=×100%=70%,解得x∶y=2∶3,则其化学式为Fe2O3。
3.根据化合价确定化学式
化合物中各元素的化合价代数和为0,利用这一点可确定化合物中各元素原子个数比。
三、有关溶液的计算
有关溶液的计算中要准确分析溶质、溶剂、溶液的质量,最基本的质量关系是:溶质质量+溶剂质量=溶液质量。
1.溶质质量分数的公式
溶质质量分数=×100% 溶质质量=溶液质量×溶质质量分数
溶液质量= 溶液质量=溶液体积×溶液密度
【知识拓展】
1.计算时溶质必须全部溶于溶剂中且不与溶剂发生反应。若溶质没有全部溶解,则溶质的质量只计算溶解部分。
2.若溶质与水发生反应,则须计算出反应后溶解在水中的产物质量,如6.2g Na2O溶解在水中,其溶质应为NaOH而不是Na2O。
3.若溶质带有结晶水,其结晶水应作为溶剂水的质量计算,如25g CuSO4·5H2O溶解于一定量水中时,溶质质量为16g而不是25g。
2.有关溶液浓缩与稀释的计算
溶液稀释
稀溶液的溶质质量的和
溶液浓缩
稀溶液的溶质质量的和
3.有关溶液与化学方程式的综合计算
在根据化学方程式进行化学计算时,各反应物、生成物之间,要以溶质质量列比例,而不能直接用溶液质量或体积列比例。
例1、N(NO2)3是科学家近年发现的一种新型火箭燃料。下列关于N(NO2)3的说法正确的是( )
A.N(NO2)3的相对分子质量为152
B.N(NO2)3中氮元素与氧元素的质量比是2∶3
C.N(NO2)3中总共有3个N原子和6个O原子
D.N(NO2)3中氮元素的质量分数为×100%
例2、有一种高效安全灭菌消毒剂可以给饮用水消毒,该消毒剂可表示为RO2。实验测得该氧化物中R与O的质量比为71∶64,则RO2的化学式为( )
A.CO2 B.NO2 C.SO2 D.ClO2
例3、有5.85g NaCl样品(其中含少量下列一种盐),已知氯元素的质量为3.59g,则可能混入的盐是( )
A.KCl B.FeCl2
C.MgCl2·6H2O D.AlCl3
例4、据报道,“火星快车”号探测器在火星大气层中发现了一种二氧化碳分子,它的化学式可表示为:C16O18O(元素符号左上角的数字代表该原子中质子数和中子数之和)
(1)18O中的质子数是________中子数是________
(2)相同分子数的C16O2和C16O18O.分别与足量CaO化合全部转化为CaCO3,生成CaCO3的质量前者________后者(选填“大于”“小于”或“等于”)
例5、如图所示是浓盐酸试剂瓶标签的部分内容。请回答下列问题:
(1)配制10%的稀盐酸200g,需要这种浓盐酸的体积约为____mL(精确到1mL)。
(2)某固体氢氧化钠在空气中敞口放置一段时间后部分变质,取该固体10g,加入质量分数为10%的盐酸至恰好不再产生气泡为止,生成气体的质量为2.2g,试通过计算说明:该固体中未变质的氢氧化钠的质量是多少克?
例6、实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
(1)滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈________性。
(2)上述实验中产生的二氧化碳气体质量为________克.
(3)计算甲瓶固体样品中碳酸钠的质量分数。
(4)某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.
1.t ℃时,NaNO3的溶解度是25g,现向盛有200g 10%NaNO3溶液的烧杯中,加入30g NaNO3固体,则此时烧杯中( )
A.溶液质量是230g B.溶质质量是50g
C.溶剂质量是170g D.溶质质量是45g
2.我国科学家发现用含硒(Se)化合物亚硒酸钠能消除掉加速人体衰老的活性氧。亚硒酸钠中的硒元素为+4价,氧元素为-2价,则亚硒酸钠的化学式为( )
A.Na2SeO3 B.Na2SeO4 C.NaSeO3 D.Na2SeO2
3.由硫化亚铁(FeS)和溴化亚铁(FeBr2)组成的混合物中铁元素的质量分数为46.2%,则溴元素的质量分数为( )
A.72.6% B.27.4%
C.34.3% D.36.3%
4.在一定质量的某NaCl溶液中加入足量AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液质量的1/4。则原NaCl溶液中溶质的质量分数约为( )
A.40% B.30% C.20% D.10%
5.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是( )
A.10% B.25% C.30% D.35%
6.溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是()
A.a点对应溶液中溶质是MgCl2 B.Ba(OH)2溶液的溶质质量分数为17.1%
C.b-c段是MgSO4与Ba(OH)2反应 D.0-a段产生的沉淀是BaSO4与Mg(OH)2
7.A、B、C为三种元素的符号,A、B2-、C+三种微粒都具有10个核外电子,A的元素符号为____,C2B的化学式为____,B元素与氢元素组成的化合物的化学式为____(写出一种即可)。
8.设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。
【实验目的】检验氢氧化钠溶液中是否含有氢氧化钙。
从组成上看,氢氧化钙和氢氧化钠都属于碱,所以具有相似的化学性质。如果在它们的水溶液中滴加酚酞溶液,都能看到的现象是________;但由于电离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能电离出CO32﹣的试剂,利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。
实验操作 现象 结论
方案一 取少量待测溶液于试管中,通入CO2 出现白色沉淀 氢氧化钠溶液中含有氢氧化钙
方案二 取少量待测溶液于试管中,滴加Na2CO3溶液 出现白色沉淀
(2)【设计方案并实验】写出方案二中出现白色沉淀反应的化学方程式________。
【方法感悟】在检验物质时,要分析物质的组成和性质,据此选择加入恰当的试剂,最后根据不同现象得出结论。
(3)【定量研究】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取10g该样品,加入54g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH,当pH=7时,刚好用去10%的稀盐酸73g。计算:
①将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水多少?
②样品中氢氧化钠的质量分数。
(4)反应后所得溶液中溶质的质量分数。
1.由NaHS、MgSO4、NaHSO3组成的混合物中,硫元素的质量分数为32%,则该混合物中氧元素的质量分数为( )
A.32% B.64% C.44% D.84%
2.一定质量的某有机化合物完全燃烧,生成2.2g CO2和1.8g H2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8g O2,该有机化合物的化学式可能是( )
A.C2H4 B.CH4O C.CH4 D.C2H4O
3.将100g 10%的某固体物质M溶液,分别进行下列操作,所得溶液中溶质质量分数最大的是( )
A.蒸发掉10g水,无晶体析出 B.加入10g 10%的M溶液
C.加入10g固体M,并使之完全溶解 D.加入10g水
4.我国科学家屠呦呦由于成功提取出青蒿素,获得了 2015年诺贝尔生理学或医学奖。青蒿 素的化学式为 C15H22O5。试计算:
(1)青蒿素的相对分子质量为____。
(2)青蒿素中,各元素质量的最简整数比为 m(C)∶m(H)∶m(O)=____。
5.有一包白色粉末,可能含氯化钠、氢氧化钠、碳酸钠中的一种或几种。为了确定其组成,小明称取了9.3克粉末,向其中加人100克7.3%的稀盐酸充分反应,生成的二氧化碳气体完全逸出(忽略其他物质逸出),所得溶液的质量为107.1克。用pH试纸检测溶液呈中性。
(1)产生二氧化碳气体的化学反应方程式为________。
(2)这包白色粉末的成分为________。
(3)求所得溶液中溶质的质量分数。(写出计算过程,结果保留一位小数)
6.某有机物样品一定含C、H元素,可能含O元素,如图是用燃烧法来确定其组成的实验装置:在电炉加热时用纯净氧气氧化管内样品,并用氧化铜将有机物中的碳元素全部转化为二氧化碳,最后根据产物的质量确定有机物的组成。请回答下列问题:
(1)a中盛放的试剂是________;
(2)F装置的作用是________;
(3)若去掉B装置,对________元素的测量结果无影响;
(4)准确称取1.12g样品,经充分燃烧后,D装置增重1.44g,E装置增重3.52g,则该有机物样品中所含的元素为________ 。
答案及解析
例1、A
【解析】N(NO2)3的相对分子质量=14×4+16×6=152。N(NO2)3中氮元素和氧元素的质量比为(14×4)∶(16×6)=7∶12。N(NO2)3由分子构成,而不是由原子直接构成的,每个N(NO2)3分子中含有4个N原子和6个O原子。N(NO2)3中氮元素的质量分数为×100%。
例2、D
【解析】根据元素质量比例可算出R的相对原子质量为35.5,从而推出R为Cl元素。
例3、D
【解析】5.85g纯净的NaCl含氯元素的质量为3.55g,故样品中的杂质所含氯元素的质量分数应大于NaCl中氯元素的质量分数。通过计算,KCl、FeCl2、MgCl2·6H2O和AlCl3所含氯元素的质量分数分别为48%、56%、34%和80%,NaCl所含氯元素的质量分数为60.7%。只有AlCl3所含氯元素的质量分数大于NaCl。
例4、(1)8;10 (2)小于
【解析】根据氧原子质量数分析,根据左上角数字为相对原子质量,相对原子质量大则原子实际质量大。
(1)18O为氧原子,质子数是8,中子数为16-8=10;
(2)C16O18O 中氧原子质量大于 C16O2 ,所以分别与足量CaO化合全部转化为CaCO3,生成CaCO3的质量 C16O2小于C16O18O 。
例5、47
(2)固体氢氧化钠在空气中敞口放置会吸收空气中的CO2而变质为Na2CO3。设10g样品中碳酸钠的质量为x,
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 2.2g
=,x=5.3g,
固体中未变质的氢氧化钠的质量为10g-5.3g=4.7g。
【解析】 (1)溶液稀释过程中溶质质量不变,则m浓×36%=m稀×10%,ρ浓V浓×36%=m稀×10%,1.18g/cm3×V浓×36%=200g×10%,V浓≈47cm3=47mL。
例6、(1)酸(2)2.2
(3)设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
x 2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%
(4)假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+ H2SO4=Na2SO4+2H2O
80 98
10克 y×15%
80:10克=98:(y×15%)
y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+ H2SO4===Na2SO4+H2O+CO2↑
106 98
10克 z×15
106:10克=98:(z×15%)
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
【解析】该题主要是结合NaOH变质情况的探究实验,综合考查了化学反应之后溶液的分析与计算;
【解答】(1)紫色石蕊试剂遇酸变红色,遇碱变蓝色;而题目中石蕊变红色,说明是酸性溶液;故答案为:酸;(2)由图可知,实验过程中使用电子天平,而气体的质量则是反应前后变化的质量;所以反应前的总质量为:80g+90g=170g;而反应后总质量为:167.8g;所以气体质量为:170g-167.8g=2.2g;故答案为:2.2;(3)实验中产生的二氧化碳都是来自变质产生的碳酸钠,知道二氧化碳气体的质量,然后根据化学方程式计算即可;故答案为:设该样品中碳酸钠的质量为x,则
Na2CO3+2HCl=2NaCl+H2O+ CO2↑
106 44
x 2.2克
106:x=44:2.2克,x=5.3克
Na2CO3%=5.3克/10克=53%;
⑷该题是为了验证不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液;采取极限情况分析即可;即固体样品没有变质只有NaOH和完全变质只有碳酸钠,计算100克15%的稀硫酸是否过量,如果两种情况均过量则该同学的观点是对的,反之是错误的;故答案为:假设10克固体样品全部为氢氧化钠,则需要消耗的稀硫酸质量为y
2NaOH+ H2SO4=Na2SO4+2H2O
80 98
10克 y×15%
80:10克=98:(y×15%) y=81.7克<100克
假设10克固体样品全部变质,则需要消耗的稀硫酸质量为Z
Na2CO3+ H2SO4===Na2SO4+H2O+CO2↑
106 98
10克 z×15
106:10克=98:(z×15%)
z=61.6克<100克
所以用100克15%的稀硫酸进行此实验,稀硫酸一定过量,故稀硫酸加入后不需要加石蕊试液。
1.D
【解析】 t ℃时原NaNO3溶液中m(NaNO3)=200g×10%=20g,m溶剂=200g×90%=180g。设溶液达到饱和时,需加入NaNO3的质量为x,=,解得x=25g。此时NaNO3饱和溶液中溶质的质量为45g,溶剂的质量仍为 180g,溶液总质量为225g。
2.A
【解析】 亚硒酸钠中的硒元素为+4价,氧元素为-2价,钠为+1价。根据化学式中各元素的化合价代数和为零的原则,把三种元素的化合价代入公式中,等于零的即正确。
3.C
【解析】 利用相对原子质量间的数量关系,以5个S代替2个Br完成转化:FeBr2―→FeS·4S。因FeS的质量分数为46.2%÷=72.6%,则4S的质量分数为1-72.6%=27.4%,故Br的质量分数为27.4%×≈34.3%。
4.D
【解析】 根据题意可知,AgCl沉淀质量×4=原NaCl溶液质量,假设AgCl沉淀质量为一定值,根据反应的化学方程式中的质量比即可计算出NaCl的质量。设生成AgCl的质量为a,设NaCl的质量为x,
NaCl+AgNO3===AgCl↓+NaNO3
58.5 143.5
x a
=,x=,
原NaCl溶液中溶质的质量分数:×100%≈10%。
5.B
【解析】假设混合物共100g,设混合物中只有FeO和CaCO3,则含Fe 56g,则与Fe结合的O质量为16g,CaCO3的质量为100g-56g-16g=28g,故CaCO3质量分数为28%;同理若混合物中只有Fe2O3和CaCO3,则含Fe 56g,与Fe结合的O质量为56g×=24g,CaCO3的质量为100g-56g-24g=20g,CaCO3的质量分数为20%,所以CaCO3的质量分数介于20%~28%之间。
6.B
【解析】向其中逐滴滴加Ba(OH) 2 溶液, 因为碱和酸先进行反应,所以开始一段时间内应该是HCl与 Ba(OH) 2 反应生成BaSO4沉淀;当HCl完全反应后, MgSO4与Ba(OH) 2反应生成BaSO4和Mg(OH) 2沉淀;当 MgSO 4完全反应后,溶液中的MgCl2再与 Ba(OH) 2 反应生成 Mg(OH) 2沉淀,据此进行解答。
【解答】A.在0~a阶段,反应如下:
Ba(OH) 2+2HCl=BaCl2+2H2O,
BaCl2+MgSO4=BaSO4↓+MgCl2;
因此a点对应的溶液中的溶质是MgCl2和Ba(OH)2,故A错误;
B.根据图像可知,当加入100gBa(OH)2溶液时产生BaSO4沉淀23.3g,
设Ba(OH)2溶液中溶质质量为x,
根据:Ba(OH)2→BaSO4↓
171 233
x 23.3g
那么:x=17.1g;
Ba(OH)2溶液中溶质质量分数为: ,故B正确;
C.b-c段 的反应为: ,故C错误;
D.0~a段产生的沉淀是 BaSO4 ,故D错误。
7.Ne Na2O H2O(或H2O2)
【解析】A不带电荷,所以A为原子,核外有10个电子,则A为10号元素氖(Ne)。B2-是B得到2个电子后形成的离子,该离子核外电子数也为10,所以B为8号元素氧(O)。C失去一个电子后形成C+,其核外电子也为10,所以C为11号元素钠(Na)。
8.(1)溶液由无色变红色
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(3)①m浓×A%=m稀×a%
200g×38%=(200g+m水)×10%
m水=560g
②设氢氧化钠的质量为x,
NaOH + HCl = NaCl+H2O
40 36.5 58.5
x 73g×10% y
40:x=36.5:(73g×10%)
x=8g
NaOH%=8g/10g×100%=80%
(4)设生成氯化钠的质量为y
36.5:(73g×10%)=58.5:y
y=11.7g
NaCl%=(11.7g+10g-8g)/(10g+54g+73g)×100%=10%
【解析】(1)根据碱性溶液能使酚酞溶液变红分析;
(2)根据氢氧化钙与碳酸钠反应可生成碳酸钙沉淀和氢氧化钠分析;
(3)根据溶液稀释前后溶质质量不变及方程式计算方法分析,由反应的盐酸的质量代入方程式中计算出氢氧化钠质量,从而计算氢氧化钠质量分数;
(4)由反应的盐酸的质量代入方程式中计算生成氯化钠,再计算出混合物中氯化钠,最后由溶质质量分数=溶质质量/溶液质量计算生成溶液溶质质量分数分析;
【解答】(1)碱的溶液都呈碱性,能使酚酞溶液变红;
(2)方案二中氢氧化钙与碳酸钠反应可生成碳酸钙沉淀和氢氧化钠,反应方程式为 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH ;
1.C
【解析】 用相对原子质量间的数量关系,以1个Mg代替1个Na和1个H完成转化:NaHS→ MgS、NaHSO3→MgSO3。从MgS、MgSO4、MgSO3三种化合物的化学式看,它们有共同的部分“MgS”,并且都有如下对应关系:Mg~S,其质量对应关系为24~32,即当S%=32%时,Mg%=24%。所以该混合物中氧元素的质量分数为1-32%-24%=44%。
2.B
【解析】由有机化合物燃烧生成2.2g CO2和1.8g H2O可求得有机化合物中C原子和H原子的个数比为1∶4。若为C选项,3.2g 的CH4完全燃烧消耗的氧显然大于4.8g,不符合题意。3.2g 的CH4O完全燃烧恰好消耗4.8g的O2。
3.C
【解析】 100g 10%的某固体物质M溶液蒸发掉10g水(无晶体析出),其质量分数为10g/90g≈11.1%;加入10g 10%的M溶液后溶质质量分数仍为10%;加入10g固体M,并使之完全溶解后的质量分数为20g/110g≈18.2%;加入10g水后其溶质质量分数变小。
4.282 90∶11∶40
【解析】(1)青蒿素的相对分子质量为12×15+1×22+16×5=282。(2)青蒿素中碳、氢、氧三种元素的质量比为:(12×15)∶(1×22)∶(16×5)=90∶11∶40。
5.(1)2HCl+Na2CO3=2NaCl+CO2↑+H2O
(2)氢氧化钠和碳酸钠
(3)解:设固体粉末中含碳酸钠x克,与碳酸钠反应消耗HCl y克, 同时生成NaCl z克:
2HCl+ Na2CO3= 2NaCl+ CO2↑+H2O
36.5×2 106 58.5×2 44
y x z 100+9.3-107.1
解得:x=5.3(克)
y=3.65(克)
z=5.85(克)
设固体粉末中含氢氧化钠a克,与盐酸反应后生成NaCl b克
HCl+ NaOH= NaCl+H2O
36.5 40 58.5
100×7.3%-3.65 a b
解得:a=4(克)
b=5.85(克)
因为固体总质量为9.3克,等于碳酸钠与氢氧化钠的质量和,所以固体中无氯化钠。所以,所得溶液中溶质的质量分数= ×100%=10.9%
【解析】(1)根据碳酸钠与盐酸反应会产生二氧化碳气体分析;
(2)根据溶液呈中性,说明盐酸全部反应,再由方程式计算出若盐酸全部与碳酸钠反应消耗碳酸钠质量,由固体总质量判断氢氧化钠的存在分析;
(3)根据碳酸钠和氢氧化钠都能与盐酸反应生成氯化钠,通过方程式计算出氯化钠质量,再计算氯化钠的溶质质量分数分析。
【解答】(1)碳酸钠与盐酸反应会产生二氧化碳、氯化钠和水,所以产生二氧化碳气体的方程式为 2HCl+Na2CO3=2NaCl+CO2↑+H2O ;
(2) 加人100克7.3%的稀盐酸充分反应, 所得溶液呈中性,盐酸中溶质质量为7.3克,设盐酸全部与碳酸钠反应时消耗碳酸钠质量为x
2HCl+Na2CO3=2NaCl+CO2↑+H2O
73 106
7.3g x
73:106=7.3g:x
x=10.6g,而固体总质量为9.3克,说明还含有其它与盐酸反应的氢氧化钠,白色粉末的成分为碳酸钠和氢氧化钠;
6.(1)H2O2
(2)防止空气中的CO2在E被吸收从而干扰实验
(3)C
(4)C、H
【解析】1、由题意可知,此实验主要通过A产生的氧气与样品反应,全部生成水和二氧化碳,D装置吸收水蒸气,E装置吸收二氧化碳,根据D、E装置得到水和二氧化碳的质量来确定有机物的组成;
2、实验中空气中的成分不能进入干扰水和二氧化碳质量的测定;
3、B装置的浓硫酸主要是吸收A装置中带出的水蒸气的,去掉后水蒸气的质量偏大,引起H元素质量偏大,不影响C元素的测量;
4、计算出水中含有的H元素和二氧化碳中C元素的质量,与样品质量比较可确定有机物中含有的元素。
【解答】(1)实验中样品要于氧气反应,所以A装置是制取氧气的装置,用液体和固体混合制取氧气的,液体应该是H2O2;
(2)F装置接NaOH溶液,NaOH溶液易于空气中的二氧化碳反应,所以接F装置的作用是 防止空气中的CO2在E被吸收从而干扰实验 ;
(3)B装置的浓硫酸主要是吸收A装置中带出的水蒸气的,去掉后水蒸气的质量偏大,引起H元素质量偏大,不影响C元素的测量;
(4)D装置吸收生成的水蒸气质量为1.44g,E装置吸收生成的二氧化碳质量为3.52g
有机物中H元素的质量为:
有机物中C元素的质量为:
C和H元素的总质量为:0.16g+0.96g=1.12g,所以样品只含C、H元素,不含O元素。
2023浙教版科学中考第一轮复习--化学模块(十四)
化学计算
同课章节目录
