人教版化学4.3化学键 课件(10张ppt)
文档属性
| 名称 | 人教版化学4.3化学键 课件(10张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 25.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-25 14:21:05 | ||
图片预览




文档简介
(共10张PPT)
吴 彦
微粒间的相互作用
——共价键
第四章 物质结构 元素周期律
第三节 化学键(2)
一、宏微对比,感知共价键的存在
大家知道自然界最硬的物质是什么吗?
这种作用力可能是离子键吗,为什么?
可能是类似金属内部的作用力吗,为什么?
作用力极强!
二、证据推理,认识共价键的本质
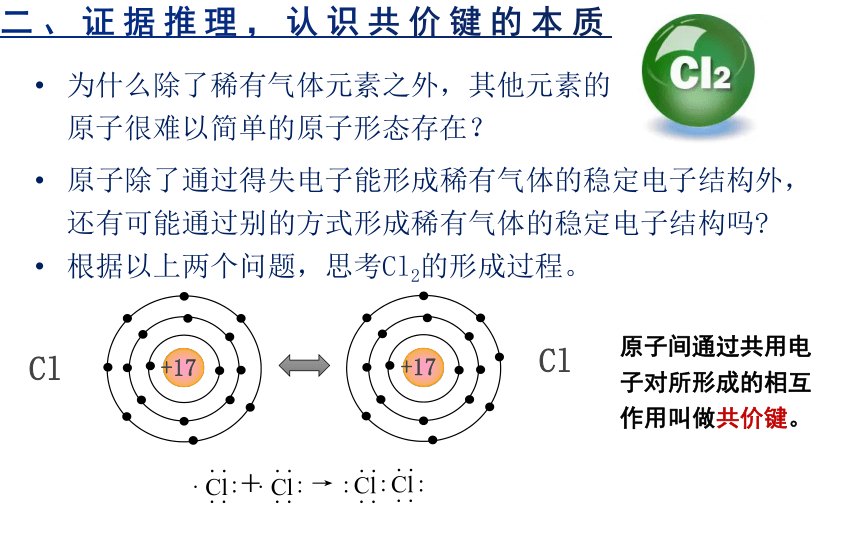
为什么除了稀有气体元素之外,其他元素的原子很难以简单的原子形态存在?
+ →
:
. .
. .
· Cl
:
. .
. .
· Cl
:
. .
. .
Cl
:
. .
. .
Cl
:
原子间通过共用电子对所形成的相互
作用叫做共价键。
原子除了通过得失电子能形成稀有气体的稳定电子结构外,还有可能通过别的方式形成稀有气体的稳定电子结构吗
根据以上两个问题,思考Cl2的形成过程。
Cl
+17
Cl
+17
二、证据推理,认识共价键的本质
根据Cl2的形成过程推测,什么样的元素之间能形成共价键?为什么?
大多数情况下,形成共价键后,原子能达到稀有气体的稳定电子结构。
在大多数情况下,非金属元素因为吸引电子能力相近,易形成共价键。
形成共价键的微粒是原子。
形成共价键的微粒是什么?
形成共价键后,原子的价电子数目发生了怎样的变化?
二、证据推理,认识共价键的本质
在氯气分子中,共用电子对是否偏向其中一个氯原子?
同种原子形成的共价键,不偏向任何一个原子,形成非极性键。
不同种原子形成的共价键,共用电子对偏向吸引电子能力强的一方,所以吸引电子能力强的原子一方显负电性,形成极性键。
在氯化氢分子中,共用电子对是否偏向其中的氯原子?
+ →
:
. .
. .
· Cl
:
. .
. .
Cl
H
H
×
三、符号表征,描述共价键
用电子式表示共价分子应满足哪些要求
讨论用电子式表示共价分子的一般规律。
分子 电子式
H2
HCl
CO2
H2O
CH4
H H
:
. .
. .
H Cl
. .
H O H
. .
H
H C H
H
O C O
. .
. .
在表示共价化合物时,应用元素符号表示原子。
先将成键电子放在两个原子中间,再将未成键价电子成对放在原子的两边。
如果是多原子分子,则成键数目多的原子放在中间,成键数目少的原子放在两边。
尝试写出 H2S、NH3、H2O2、C2H2的电子式。
三、符号表征,描述共价键
讨论用结构式表示共价分子的一般规律。
用一根短线表示1对共用电子对,省略孤对电子,这种图示即为结构式。
分子 电子式 结构式 分子结构模型
H2 H—H
HCl H—Cl
CO2 O=C=O
H2O
CH4
H H
:
. .
. .
H Cl
. .
H O H
. .
H
H C H
H
O
H H
H
H C H
H
O C O
. .
. .
四、实践研究,感知共价键的破坏与生成
在上节课中,我们用水“黏合”了食盐颗粒,因为氯化钠是易溶于水的离子化合物,加入少量水,可以破坏离子键,之后再蒸发水,即可形成新的离子键。那么,我们能否用同样的办法黏合由共价键构成的分子呢
O
H H
H2O分子不能通过共价键“黏合”,因为H原子只能形成一个共价键;
而C2H4可以通过破坏双键,将其变为单键,再用单键将分子连接起来,从而把分子用共价键“黏合”起来。
H C C H
H H
五、类比探究,感知分子间作用力的存在
H2O分子不能通过共价键“黏合”,那么,由H2O分子构成的冰分子之间又是通过什么样的作用力结合的呢?
常压下,冰在0℃时持续受热即可融化成水,但 H2O分子在1000℃都很难分解,这说明分子间作用力与共价键的强度,哪个更大
课堂总结
今日作业
学案【巩固训练】部分;教材习题
Cl
Cl
+ →
:
. .
. .
· Cl
:
. .
. .
· Cl
:
. .
. .
Cl
:
. .
. .
Cl
:
原子间通过共用电子对所形成的相互
作用叫做共价键。
同种原子形成的共价键,不偏向任何一个原子,形成非极性键。
不同种原子形成的共价键,共用电子对偏向吸引电子能力强的一方,所以吸引电子能力强的原子一方显负电性,形成极性键。
用一根短线表示1对共用电子对,省略孤对电子,这种图示即为结构式。
+17
+17
吴 彦
微粒间的相互作用
——共价键
第四章 物质结构 元素周期律
第三节 化学键(2)
一、宏微对比,感知共价键的存在
大家知道自然界最硬的物质是什么吗?
这种作用力可能是离子键吗,为什么?
可能是类似金属内部的作用力吗,为什么?
作用力极强!
二、证据推理,认识共价键的本质
为什么除了稀有气体元素之外,其他元素的原子很难以简单的原子形态存在?
+ →
:
. .
. .
· Cl
:
. .
. .
· Cl
:
. .
. .
Cl
:
. .
. .
Cl
:
原子间通过共用电子对所形成的相互
作用叫做共价键。
原子除了通过得失电子能形成稀有气体的稳定电子结构外,还有可能通过别的方式形成稀有气体的稳定电子结构吗
根据以上两个问题,思考Cl2的形成过程。
Cl
+17
Cl
+17
二、证据推理,认识共价键的本质
根据Cl2的形成过程推测,什么样的元素之间能形成共价键?为什么?
大多数情况下,形成共价键后,原子能达到稀有气体的稳定电子结构。
在大多数情况下,非金属元素因为吸引电子能力相近,易形成共价键。
形成共价键的微粒是原子。
形成共价键的微粒是什么?
形成共价键后,原子的价电子数目发生了怎样的变化?
二、证据推理,认识共价键的本质
在氯气分子中,共用电子对是否偏向其中一个氯原子?
同种原子形成的共价键,不偏向任何一个原子,形成非极性键。
不同种原子形成的共价键,共用电子对偏向吸引电子能力强的一方,所以吸引电子能力强的原子一方显负电性,形成极性键。
在氯化氢分子中,共用电子对是否偏向其中的氯原子?
+ →
:
. .
. .
· Cl
:
. .
. .
Cl
H
H
×
三、符号表征,描述共价键
用电子式表示共价分子应满足哪些要求
讨论用电子式表示共价分子的一般规律。
分子 电子式
H2
HCl
CO2
H2O
CH4
H H
:
. .
. .
H Cl
. .
H O H
. .
H
H C H
H
O C O
. .
. .
在表示共价化合物时,应用元素符号表示原子。
先将成键电子放在两个原子中间,再将未成键价电子成对放在原子的两边。
如果是多原子分子,则成键数目多的原子放在中间,成键数目少的原子放在两边。
尝试写出 H2S、NH3、H2O2、C2H2的电子式。
三、符号表征,描述共价键
讨论用结构式表示共价分子的一般规律。
用一根短线表示1对共用电子对,省略孤对电子,这种图示即为结构式。
分子 电子式 结构式 分子结构模型
H2 H—H
HCl H—Cl
CO2 O=C=O
H2O
CH4
H H
:
. .
. .
H Cl
. .
H O H
. .
H
H C H
H
O
H H
H
H C H
H
O C O
. .
. .
四、实践研究,感知共价键的破坏与生成
在上节课中,我们用水“黏合”了食盐颗粒,因为氯化钠是易溶于水的离子化合物,加入少量水,可以破坏离子键,之后再蒸发水,即可形成新的离子键。那么,我们能否用同样的办法黏合由共价键构成的分子呢
O
H H
H2O分子不能通过共价键“黏合”,因为H原子只能形成一个共价键;
而C2H4可以通过破坏双键,将其变为单键,再用单键将分子连接起来,从而把分子用共价键“黏合”起来。
H C C H
H H
五、类比探究,感知分子间作用力的存在
H2O分子不能通过共价键“黏合”,那么,由H2O分子构成的冰分子之间又是通过什么样的作用力结合的呢?
常压下,冰在0℃时持续受热即可融化成水,但 H2O分子在1000℃都很难分解,这说明分子间作用力与共价键的强度,哪个更大
课堂总结
今日作业
学案【巩固训练】部分;教材习题
Cl
Cl
+ →
:
. .
. .
· Cl
:
. .
. .
· Cl
:
. .
. .
Cl
:
. .
. .
Cl
:
原子间通过共用电子对所形成的相互
作用叫做共价键。
同种原子形成的共价键,不偏向任何一个原子,形成非极性键。
不同种原子形成的共价键,共用电子对偏向吸引电子能力强的一方,所以吸引电子能力强的原子一方显负电性,形成极性键。
用一根短线表示1对共用电子对,省略孤对电子,这种图示即为结构式。
+17
+17
