3.3.2氨气与铵盐 课件(37张ppt)2022-2023学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.3.2氨气与铵盐 课件(37张ppt)2022-2023学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 19.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-25 11:57:01 | ||
图片预览









文档简介
(共37张PPT)
第3节 氮的循环
第2课时 氨和铵盐
学习目标:
1.了解氨气的物理性质,掌握氨气的化学性质和用途,
2.掌握氨气的实验室制备方法和检验方法。
3.认识铵盐的受热分解、铵盐与碱的反应,认识铵态氮肥的使用问题。掌握铵盐的化学性质和用途。
【重点】氨气及铵盐的性质
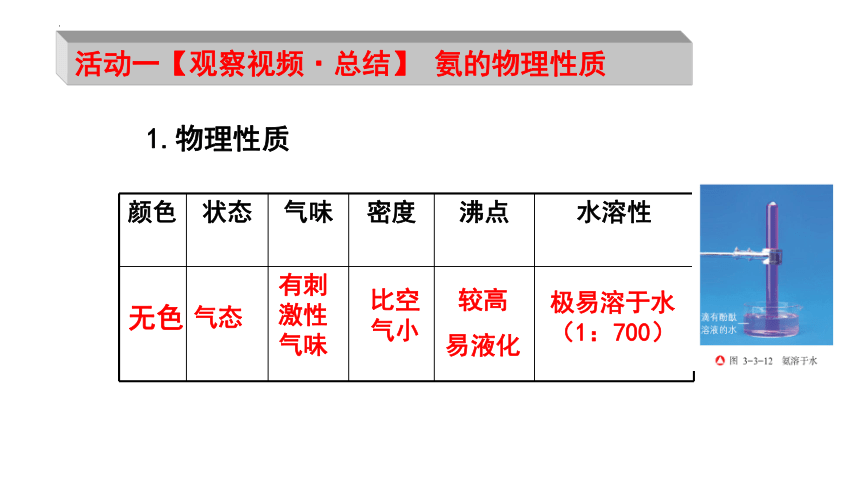
颜色 状态 气味 密度 沸点 水溶性
无色
气态
比空气小
有刺激性气味
极易溶于水(1:700)
1.物理性质
活动一【观察视频·总结】 氨的物理性质
较高
易液化
2.喷泉实验
实现喷泉实验的操作是什么?
实验操作
实验现象
实验结论
打开止水夹,挤压滴管的胶头,使少量水
进入圆底烧瓶。
烧杯中的水会快速进入圆底烧瓶形成喷泉,烧瓶内液体呈现红色
氨气极易溶于水并和水反应,所得溶液显碱性。
活动二[实验·探究]
问题1:喷泉实验的原理是什么?
由于产生压强差而形成喷泉,气体迅速溶于水而使容器内压强小于容器外压强,从而形成喷泉,根据这一原理,只要能够造成容器内气体大量减少就能形成喷泉。
方法 减小内压法 增大外压法
装置
原理 减小烧瓶内气体压强,形成压强差,产生喷泉现象 增大锥形瓶内气体压强,形成压强差,产生喷泉现象
常见组合 NH3(水或盐酸) HCl(水或NaOH溶液) CO2、SO2、Cl2(浓NaOH溶液) NaHCO3(盐酸) CaCO3(盐酸)
问题2:该实验成功的关键是什么?
问题3:是否只有极易溶于水的气体才能形成喷泉?
①装置的气密性要好,②烧瓶要干燥,③气体要收集满。
1、极易溶于水的气体如NH3,HCl等可以形成喷泉
2、气体极易溶于某种液体如CO2,SO2,等极易溶于NaOH等
3、反应迅速产生大量气体,使装置内压强增大如城市喷泉
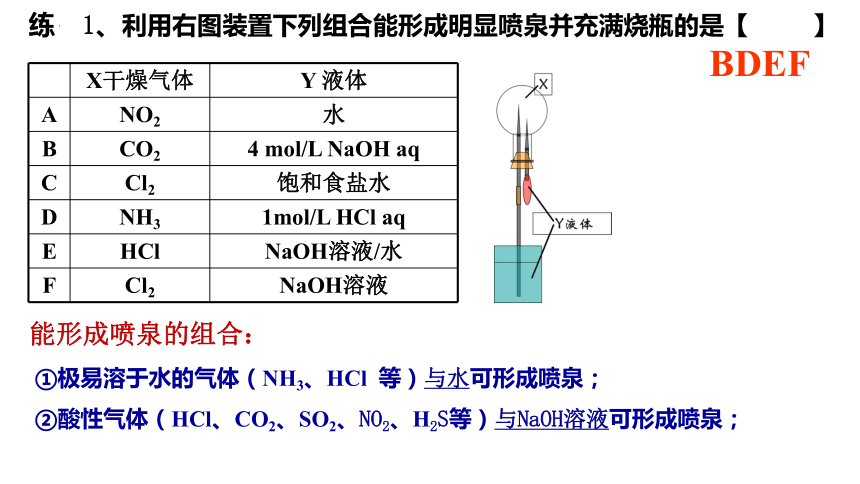
练 1、利用右图装置下列组合能形成明显喷泉并充满烧瓶的是【 】
X干燥气体 Y 液体
A NO2 水
B CO2 4 mol/L NaOH aq
C Cl2 饱和食盐水
D NH3 1mol/L HCl aq
E HCl NaOH溶液/水
F Cl2 NaOH溶液
BDEF
①极易溶于水的气体(NH3、HCl 等)与水可形成喷泉;
②酸性气体(HCl、CO2、SO2、NO2、H2S等)与NaOH溶液可形成喷泉;
能形成喷泉的组合:
(1)氨气与水反应
一水合氨
NH 3+H2O NH 3·H 2O
3、氨气的化学性质
NH3是唯一能使湿润红色石蕊试纸变蓝的碱性气体
氨水的成分:
三分子:NH3、H2O、NH3·H2O
三离子:NH4+、OH-、H+
---氨水显弱碱性
氨水的溶质:NH3
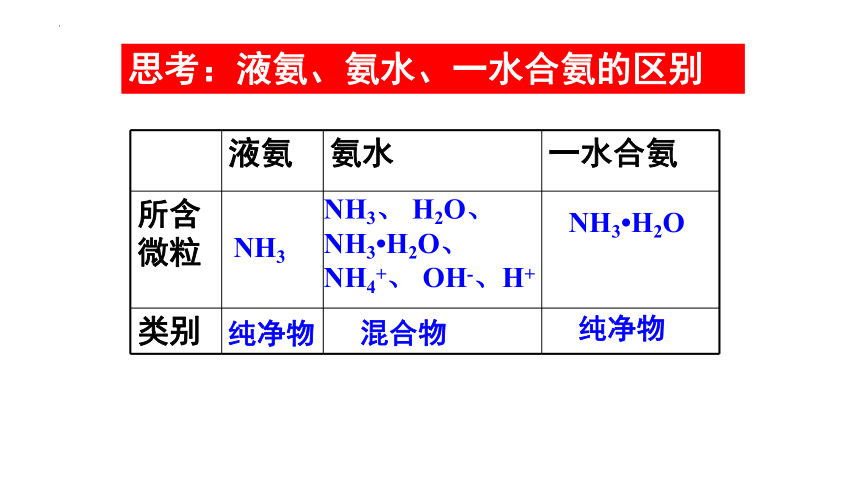
思考:液氨、氨水、一水合氨的区别
液氨 氨水 一水合氨
所含微粒
类别
NH3
NH3、 H2O、NH3 H2O、
NH4+、 OH-、H+
NH3 H2O
纯净物
纯净物
混合物
2.氨气与酸反应------生成铵盐
白烟还是白雾?相关的反应方程式?
实验还可以这样做!
实验 实验现象 结论
NH3与HCl 的反应
产生大量白烟
生成NH4Cl固体
玻璃棒
(2)氨跟酸的反应
NH3+HCl = NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
与挥发性的酸反应冒白烟
NH3的检验方法:
①蘸有浓盐酸的玻璃棒靠近试管口,产生白烟
②湿润的红色石蕊试纸靠近试管口,试纸变蓝
氨气是中学阶段唯一呈碱性的气体
3.氨的催化氧化
氨中氮元素的化合价为最低价-3价,因此氨具有还原性,能与具有氧化性的物质发生反应。
4NH3+5O2 4NO+6H2O
注意:
①反应条件:催化剂、加热
②该反应是工业制硝酸中的关键一步,也叫氨的催化氧化
③说明氨有一定的还原性,可被O2、Cl2、CuO等氧化
8NH3+3Cl2=N2+6NH4Cl (产生白烟--检验氯气管道是否泄露)
拓展:工业制取硝酸
第一步: 4NH3+5O2 4NO+6H2O
第二步:2NO+O2=2NO2
第三步:3NO2+H2O=2HNO3+NO
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
氨的用途
2. 铵盐的物理性质:
铵盐一般为白色或无色晶体,都易溶于水。
NH4Cl
实验操作 实验现象 结论
加热氯化铵固体
加热碳酸氢铵固体
①试管中固体逐渐消失,
②试管口有白色固体生成
氯化铵固体受热易分解,
生成的NH3和HCl在试管口
反应生成NH4Cl
①试管中固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热易分解生成H2O和CO2 ,同时还生成 NH3
加热氯化铵固体的实验
加热碳酸氢铵固体的实验
实验操作 实验现象 结论
氯化铵固体与NaOH 溶液反应
湿润的红色石蕊
试纸变蓝色
氯化铵固体与
NaOH溶液反应
产生NH3
氨气提示:不是所有的铵盐分解都产生氨气,如硝酸铵。
【思考】
1. 从离子反应的角度分析铵盐与强碱溶液反应的实质(写出铵盐和强碱溶液反应的离子方程式)
①铵盐与强碱溶液 常温
②铵盐与浓强碱溶液加热
2. 如何检验某溶液中是否含有NH4+ ?
取溶液少许于试管中,加入浓氢氧化钠溶液,加热,若生成的气体使湿润的红色石蕊试纸变蓝,则说明溶液中含有NH4+
NH4++OH- = NH3·H2O
NH4++OH- NH3↑+H2O
铵根离子检验
(1)实验操作:取少许待测液或晶体于小试管中,加入浓氢氧化钠溶液,微热,将湿润的红色石蕊试纸(或者蘸有浓盐酸的玻璃棒)靠近试管口。
(2)现象、结论:试纸变蓝色(或者冒白烟),说明是铵盐或待测液含有NH4+。
铵盐的性质提示:不是,因为有的铵盐分解不产生氨气,如硝酸铵。2.所有铵盐加热都产生氨气吗
3、施用铵态肥料有哪些注意事项?如何保存铵态肥料?
4、如何除去氯化钠中混有的氯化铵固体?
①铵态氮肥不能与草木灰等碱性物质混合施用,并埋入土层下面,原因是铵态氮肥中的铵根离子与碱性物质中的氢氧根离子能反应生成氨气逸出,降低氮肥肥效。
② 铵态氮肥应密封保存,远离热源,不能和碱性物质混放。
加热法
(二)实验室制氨气
1、反应原理:常用加热氯化铵和氢氧化钙固体混合物的方法制取氨。
2、反应装置:
反应原理和
条件决定
反应装置
复分解反应
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
棉花:防止
空气对流
固 + 固 →气体
(1)、 实验室制氨气时不用氢氧化钠固体来代替氢氧化钙固体?
(2)、图中的反应装置和收集装置,应注意哪些问题?
反应装置:试管口向下倾斜
收集装置:导气管插到试管底部
若将棉花换为一个单孔橡皮塞可以吗?
不能单孔橡胶塞:
空气无法排出,收集的氨气不纯
氢氧化钠易吸水结块,对玻璃的腐蚀性较强。
(3)、装置中收集氨气的试管口的棉花的作用是什么?你在以前学过的哪个实验中也用过棉花?
4、干燥:从反应原理分析,氨气中可能混有的杂质?如何除去?
防止氨气与空气对流,提高氨气的纯度。
混有水蒸气
CaO、NaOH固体、碱石灰等碱性干燥剂来干燥氨气
NaOH固体和CaO的混合物
无水CaCl2不能用来干燥NH3(反应形成CaCl2· 8NH3)
氨气的干燥
氨气的干燥通常使用碱石灰,
装置如下图
粗进细出
(3)氨气的收集方法:
向下排空气法
注意:CaCl2不能用来干燥NH3。反应形成(CaCl2.8NH3)
5、氨气如何验满?
(6)、尾气处理: 多余的氨气如何处理? 常用的尾气处理方法有哪些?
① 用湿润的红色石蕊试纸靠近瓶口,看试纸是否变蓝
② 用玻璃棒一端蘸取浓盐酸靠近瓶口,看是否产生白烟
用水吸收。
氨气尾气吸收常采用的防倒吸装置有:
方 法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
归纳总结
实验室制取氨气的简易方法
1.加热浓氨水
两种快速制取氨气的方法
方 法 化学方程式(或原理) 气体发生装置
浓氨水+ 固体NaOH NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的逸出
浓氨水+ 固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解,NH3逸出。化学方程式为NH3·H2O+CaO==NH3↑+Ca(OH)2 浓氨水+碱石灰
归纳总结
实验室制取氨气的简易方法
2.浓氨水中加固态碱性物质
训练2如图是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①② B.②③ C.①③ D.②④
答案:C
第3节 氮的循环
第2课时 氨和铵盐
学习目标:
1.了解氨气的物理性质,掌握氨气的化学性质和用途,
2.掌握氨气的实验室制备方法和检验方法。
3.认识铵盐的受热分解、铵盐与碱的反应,认识铵态氮肥的使用问题。掌握铵盐的化学性质和用途。
【重点】氨气及铵盐的性质
颜色 状态 气味 密度 沸点 水溶性
无色
气态
比空气小
有刺激性气味
极易溶于水(1:700)
1.物理性质
活动一【观察视频·总结】 氨的物理性质
较高
易液化
2.喷泉实验
实现喷泉实验的操作是什么?
实验操作
实验现象
实验结论
打开止水夹,挤压滴管的胶头,使少量水
进入圆底烧瓶。
烧杯中的水会快速进入圆底烧瓶形成喷泉,烧瓶内液体呈现红色
氨气极易溶于水并和水反应,所得溶液显碱性。
活动二[实验·探究]
问题1:喷泉实验的原理是什么?
由于产生压强差而形成喷泉,气体迅速溶于水而使容器内压强小于容器外压强,从而形成喷泉,根据这一原理,只要能够造成容器内气体大量减少就能形成喷泉。
方法 减小内压法 增大外压法
装置
原理 减小烧瓶内气体压强,形成压强差,产生喷泉现象 增大锥形瓶内气体压强,形成压强差,产生喷泉现象
常见组合 NH3(水或盐酸) HCl(水或NaOH溶液) CO2、SO2、Cl2(浓NaOH溶液) NaHCO3(盐酸) CaCO3(盐酸)
问题2:该实验成功的关键是什么?
问题3:是否只有极易溶于水的气体才能形成喷泉?
①装置的气密性要好,②烧瓶要干燥,③气体要收集满。
1、极易溶于水的气体如NH3,HCl等可以形成喷泉
2、气体极易溶于某种液体如CO2,SO2,等极易溶于NaOH等
3、反应迅速产生大量气体,使装置内压强增大如城市喷泉
练 1、利用右图装置下列组合能形成明显喷泉并充满烧瓶的是【 】
X干燥气体 Y 液体
A NO2 水
B CO2 4 mol/L NaOH aq
C Cl2 饱和食盐水
D NH3 1mol/L HCl aq
E HCl NaOH溶液/水
F Cl2 NaOH溶液
BDEF
①极易溶于水的气体(NH3、HCl 等)与水可形成喷泉;
②酸性气体(HCl、CO2、SO2、NO2、H2S等)与NaOH溶液可形成喷泉;
能形成喷泉的组合:
(1)氨气与水反应
一水合氨
NH 3+H2O NH 3·H 2O
3、氨气的化学性质
NH3是唯一能使湿润红色石蕊试纸变蓝的碱性气体
氨水的成分:
三分子:NH3、H2O、NH3·H2O
三离子:NH4+、OH-、H+
---氨水显弱碱性
氨水的溶质:NH3
思考:液氨、氨水、一水合氨的区别
液氨 氨水 一水合氨
所含微粒
类别
NH3
NH3、 H2O、NH3 H2O、
NH4+、 OH-、H+
NH3 H2O
纯净物
纯净物
混合物
2.氨气与酸反应------生成铵盐
白烟还是白雾?相关的反应方程式?
实验还可以这样做!
实验 实验现象 结论
NH3与HCl 的反应
产生大量白烟
生成NH4Cl固体
玻璃棒
(2)氨跟酸的反应
NH3+HCl = NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
2NH3+H2SO4=(NH4)2SO4
与挥发性的酸反应冒白烟
NH3的检验方法:
①蘸有浓盐酸的玻璃棒靠近试管口,产生白烟
②湿润的红色石蕊试纸靠近试管口,试纸变蓝
氨气是中学阶段唯一呈碱性的气体
3.氨的催化氧化
氨中氮元素的化合价为最低价-3价,因此氨具有还原性,能与具有氧化性的物质发生反应。
4NH3+5O2 4NO+6H2O
注意:
①反应条件:催化剂、加热
②该反应是工业制硝酸中的关键一步,也叫氨的催化氧化
③说明氨有一定的还原性,可被O2、Cl2、CuO等氧化
8NH3+3Cl2=N2+6NH4Cl (产生白烟--检验氯气管道是否泄露)
拓展:工业制取硝酸
第一步: 4NH3+5O2 4NO+6H2O
第二步:2NO+O2=2NO2
第三步:3NO2+H2O=2HNO3+NO
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
氨的用途
2. 铵盐的物理性质:
铵盐一般为白色或无色晶体,都易溶于水。
NH4Cl
实验操作 实验现象 结论
加热氯化铵固体
加热碳酸氢铵固体
①试管中固体逐渐消失,
②试管口有白色固体生成
氯化铵固体受热易分解,
生成的NH3和HCl在试管口
反应生成NH4Cl
①试管中固体逐渐消失;
②试管口有水珠生成;
③石灰水变浑浊
碳酸氢铵固体受热易分解生成H2O和CO2 ,同时还生成 NH3
加热氯化铵固体的实验
加热碳酸氢铵固体的实验
实验操作 实验现象 结论
氯化铵固体与NaOH 溶液反应
湿润的红色石蕊
试纸变蓝色
氯化铵固体与
NaOH溶液反应
产生NH3
氨气提示:不是所有的铵盐分解都产生氨气,如硝酸铵。
【思考】
1. 从离子反应的角度分析铵盐与强碱溶液反应的实质(写出铵盐和强碱溶液反应的离子方程式)
①铵盐与强碱溶液 常温
②铵盐与浓强碱溶液加热
2. 如何检验某溶液中是否含有NH4+ ?
取溶液少许于试管中,加入浓氢氧化钠溶液,加热,若生成的气体使湿润的红色石蕊试纸变蓝,则说明溶液中含有NH4+
NH4++OH- = NH3·H2O
NH4++OH- NH3↑+H2O
铵根离子检验
(1)实验操作:取少许待测液或晶体于小试管中,加入浓氢氧化钠溶液,微热,将湿润的红色石蕊试纸(或者蘸有浓盐酸的玻璃棒)靠近试管口。
(2)现象、结论:试纸变蓝色(或者冒白烟),说明是铵盐或待测液含有NH4+。
铵盐的性质提示:不是,因为有的铵盐分解不产生氨气,如硝酸铵。2.所有铵盐加热都产生氨气吗
3、施用铵态肥料有哪些注意事项?如何保存铵态肥料?
4、如何除去氯化钠中混有的氯化铵固体?
①铵态氮肥不能与草木灰等碱性物质混合施用,并埋入土层下面,原因是铵态氮肥中的铵根离子与碱性物质中的氢氧根离子能反应生成氨气逸出,降低氮肥肥效。
② 铵态氮肥应密封保存,远离热源,不能和碱性物质混放。
加热法
(二)实验室制氨气
1、反应原理:常用加热氯化铵和氢氧化钙固体混合物的方法制取氨。
2、反应装置:
反应原理和
条件决定
反应装置
复分解反应
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
棉花:防止
空气对流
固 + 固 →气体
(1)、 实验室制氨气时不用氢氧化钠固体来代替氢氧化钙固体?
(2)、图中的反应装置和收集装置,应注意哪些问题?
反应装置:试管口向下倾斜
收集装置:导气管插到试管底部
若将棉花换为一个单孔橡皮塞可以吗?
不能单孔橡胶塞:
空气无法排出,收集的氨气不纯
氢氧化钠易吸水结块,对玻璃的腐蚀性较强。
(3)、装置中收集氨气的试管口的棉花的作用是什么?你在以前学过的哪个实验中也用过棉花?
4、干燥:从反应原理分析,氨气中可能混有的杂质?如何除去?
防止氨气与空气对流,提高氨气的纯度。
混有水蒸气
CaO、NaOH固体、碱石灰等碱性干燥剂来干燥氨气
NaOH固体和CaO的混合物
无水CaCl2不能用来干燥NH3(反应形成CaCl2· 8NH3)
氨气的干燥
氨气的干燥通常使用碱石灰,
装置如下图
粗进细出
(3)氨气的收集方法:
向下排空气法
注意:CaCl2不能用来干燥NH3。反应形成(CaCl2.8NH3)
5、氨气如何验满?
(6)、尾气处理: 多余的氨气如何处理? 常用的尾气处理方法有哪些?
① 用湿润的红色石蕊试纸靠近瓶口,看试纸是否变蓝
② 用玻璃棒一端蘸取浓盐酸靠近瓶口,看是否产生白烟
用水吸收。
氨气尾气吸收常采用的防倒吸装置有:
方 法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH3·H2O NH3↑+H2O
归纳总结
实验室制取氨气的简易方法
1.加热浓氨水
两种快速制取氨气的方法
方 法 化学方程式(或原理) 气体发生装置
浓氨水+ 固体NaOH NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的逸出
浓氨水+ 固体CaO CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解,NH3逸出。化学方程式为NH3·H2O+CaO==NH3↑+Ca(OH)2 浓氨水+碱石灰
归纳总结
实验室制取氨气的简易方法
2.浓氨水中加固态碱性物质
训练2如图是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.①② B.②③ C.①③ D.②④
答案:C
