化学人教版(2019)选择性必修1 3.3.盐类水解的应用(共15张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.盐类水解的应用(共15张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 505.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-25 18:13:19 | ||
图片预览





文档简介
(共15张PPT)
第三章 水溶液中的离子反应和平衡
盐类水解的应用
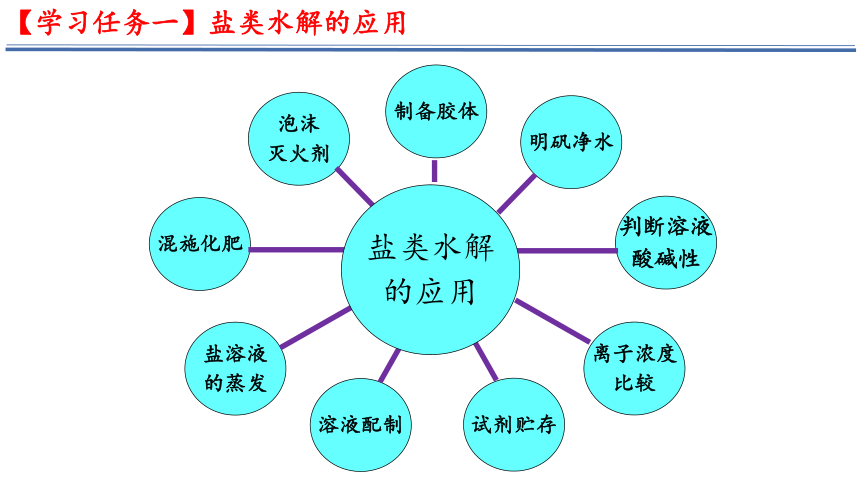
【学习任务一】盐类水解的应用
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
【学习任务一】盐类水解的应用
问题1:为什么用热水配制CuCl2溶液,溶液会出现浑浊?怎样配制澄清溶液?
CuCl2+2H2O Cu(OH)2+2HCl ΔH>0 Cu2++2H2O Cu(OH)2+2H+ ΔH>0
配制CuCl2溶液,为防止出现浑浊,应加少量的_______
稀盐酸
[应用1]设计物质水溶液的配制方法
凡配制能水解的盐溶液时,通常需采取防水解措施。
①配制强酸弱碱盐溶液:滴几滴相应的强酸,可使水解平衡向左移动,抑制弱碱阳离子的水解。如配制FeCl3的水溶液:FeCl3溶于水时会发生水解反应Fe3++3H2O Fe(OH)3+3H+,通常先将FeCl3固体溶于较浓盐酸中,抑制Fe3+的水解,使溶液保持澄清,再加水稀释至所需浓度。
②配制强碱弱酸盐溶液:加入少量相应的强碱,可抑制弱酸根离子水解。如配制硫化钠的水溶液时,可加入少量氢氧化钠,抑制S2-的水解。
【学习任务一】盐类水解的应用
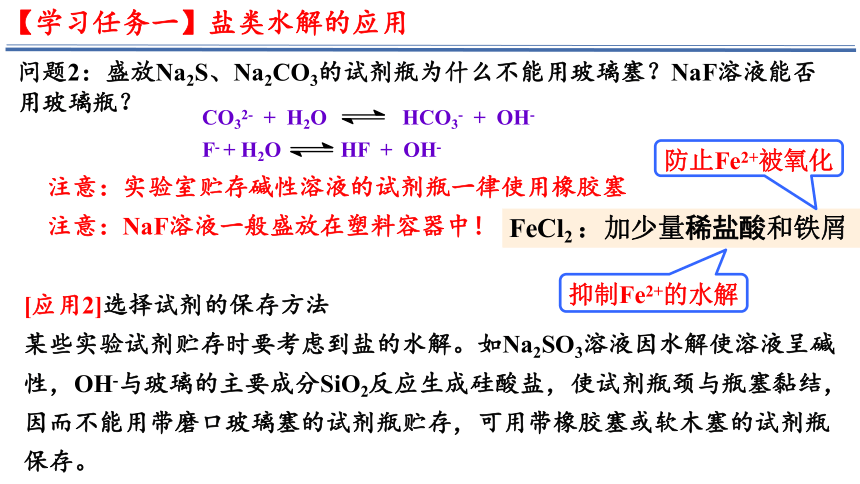
问题2:盛放Na2S、Na2CO3的试剂瓶为什么不能用玻璃塞?NaF溶液能否用玻璃瓶?
CO32- + H2O HCO3- + OH-
F- + H2O HF + OH-
注意:实验室贮存碱性溶液的试剂瓶一律使用橡胶塞
注意:NaF溶液一般盛放在塑料容器中!
[应用2]选择试剂的保存方法
某些实验试剂贮存时要考虑到盐的水解。如Na2SO3溶液因水解使溶液呈碱性,OH-与玻璃的主要成分SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带磨口玻璃塞的试剂瓶贮存,可用带橡胶塞或软木塞的试剂瓶保存。
FeCl2 :加少量稀盐酸和铁屑
抑制Fe2+的水解
防止Fe2+被氧化
【学习任务一】盐类水解的应用
问题3:化肥的使用——草木灰不能和铵态氮肥混合使用,为什么?
铵态氮肥——铵盐,水解呈酸性
NH4++H2O NH3·H2O+ H+,
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,会导致NH3·H2O分解生成NH3逸出了,从而降低了肥效。
[应用3]某些化肥的混合施用
草木灰不能与铵态氮肥混用,因草木灰的主要成分为K2CO3,溶于水时
NH3+H2O,使氮肥肥效下降。
【学习任务一】盐类水解的应用
问题4:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠 C.碳酸钠 D.碳酸镁
AD
Fe3+ + 3H2O Fe(OH)3 + 3H+
如: MgCl2溶液中混有FeCl3杂质
Mg2+ + 2H2O Mg(OH)2 + 2H+
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
④ 加入Mg
不引入新杂质!
(主)
(次)
[应用4]利用盐的水解去除杂质
如果两种离子的水解程度不一样,可通过调控溶液的pH将其中一种离子转化为氢氧化物沉淀而除去。
思考:除去CuCl2溶液中的FeCl3用什么试剂?
CuO、Cu(OH)2、CuCO3等
【学习任务一】盐类水解的应用
[应用5]判断蒸干盐溶液所得固体的成分
盐溶液 水解方程式 酸挥发性 蒸干所得固体
AlCl3
Al2(SO4)3
AlCl3+3H2O Al(OH)3+3HCl
易
Al(OH)3
Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4
难
Al2(SO4)3
规
律
弱碱易挥发性酸盐
蒸干灼烧
氧化物固体
弱碱难挥发性酸盐
蒸干灼烧
同溶质固体
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
△
Mg(OH)2
△
MgO
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
【学习任务一】盐类水解的应用
[应用5]判断蒸干盐溶液所得固体的成分
考虑盐受热是否分解
如1:Ca(HCO3)2
蒸干
CaCO3
灼烧
CaO
如2:NaHCO3;KMnO4;
蒸干并灼烧
Na2CO3;K2MnO4和MnO2
如3:NH4Cl
蒸干并灼烧:
无固体
有时要多方面考虑:
CuSO4溶液加热得CuSO4·5H2O;蒸干得CuSO4
如4:易被氧化的盐,蒸干得氧化产物;
Na2SO3蒸干得Na2SO4;FeSO4蒸干得Fe2(SO4)3
【学习任务一】盐类水解的应用
[应用6]解释生产和生活这中的某些事实
(1)FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
(2)热的纯碱液去油污效果好
加热能促进纯碱Na2CO3水解,产生的c(OH-)较大,而油污中的油脂在碱性较强的条件下水解更完全。
(3)在NH4Cl溶液中加入Mg粉,为何有H2放出
NH4++H2O NH3·H2O+H+
Mg+2H+= Mg2++H2↑
Mg+2NH4+=Mg2++2NH3↑+H2↑
(4)泡沫灭火器反应原理
Al2(SO4)3和NaHCO3溶液
【学习任务一】盐类水解的应用
Al3+ + 3HCO3- =Al(OH)3↓+ 3CO2↑
生成的CO2将胶状Al(OH)3吹出可形成泡沫。
混合前
混合后
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
速度快
耗盐少
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
K(H2CO3)a1=4.4×10-7
K(Al(OH)3)b=5.1×10-9
为什么CH3COONH4不彻底水解?
【学习任务一】盐类水解的应用
例1:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaHCO3、NaClO、CH3COONa、Na2SO4、NaOH、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为:
pH: NaOH>Na2CO3>NaClO>NaHCO3 >CH3COONa>Na2SO4 >(NH4)2SO4>NaHSO4
[应用7]判断盐溶液的酸碱性
酸性:HCO3-<HClO<H2CO3<CH3COOH
1、温度相同、浓度均为0.1mol/L的
①(NH4)2SO4 ②NaNO3 ③NH4HSO4 ④NH4NO3 ⑤CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑤ B. ①③⑤④② C. ③②①⑤④ D. ⑤ ②④①③
A
2、比较相同pH值的 ①Na2CO3 ②CH3COONa ③NaClO三种稀溶液物质的量浓度大小顺序 。
②>③>①
【学习任务一】盐类水解的应用
3.室温下,物质的量浓度相同的下列溶液,按pH由小到大的顺序排列的是
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl、(NH4)2SO4、Na2S、NaNO3
解析:的水解程度大于的,pH:Na2CO3>NaHCO3,故选项A、B不符合要求;水解使NH4Cl溶液、(NH4)2SO4溶液显酸性,相同物质的量浓度时,(NH4)2SO4溶液中浓度大于NH4Cl溶液中浓度,则pH:(NH4)2SO4C
破题思路
【学习任务一】盐类水解的应用
[应用8]比较盐溶液中离子种类的多少
将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子种类最多的是
A. KCl B. Na3PO4 C. Na2CO3 D. MgSO4
B
[应用9]判定离子能否大量共存:
(1)不完全双水解:两离子水解相互促进,但仍部分水解,可逆的,阴阳离子仍能在溶液中大量共存,如NH4+与S2-、HCO3-、CO32-、CH3COO-
(2)完全双水解:水解进行完全,用“ = ”、“↑”“↓”。阴阳离子不能在溶液中大量共存
①Al3+与AlO2-、CO32-、HCO3-、HS-、S2-、ClO-、SiO32-
② Fe3+与 AlO2-、CO32-、HCO3-
③ NH4+与 SiO32-、AlO2-
说明:(Fe3+与S2-、HS-)主要发生氧化还原反应
Al3+与 AlO2-
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3+ 与 HCO3-
Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al3+与CO32-
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3+与S2-
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
【学习任务一】盐类水解的应用
典例:在氯化铁溶液中存在下列水解平衡:FeCl3+3H2O Fe(OH)3+3HCl ΔH>0
回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,得到的一种红褐色透明液体为 。
(2)在配制FeCl3溶液时,为防止浑浊,应加入 。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
解析 (1)加热FeCl3溶液得到的红褐色透明液体为Fe(OH)3胶体。
(2)为防止浑浊,应加入盐酸抑制FeCl3水解。
(3)CO32-与Fe3+发生相互促进的水解反应,生成的Fe(OH)3可过滤除去。
Fe(OH)3胶体
少许盐酸
MgCO3能与H+反应,促进了Fe3+的水解,使Fe3+转化为Fe(OH)3沉淀而被除去
【学习任务一】盐类水解的应用
离子浓度
比较
第三章 水溶液中的离子反应和平衡
盐类水解的应用
【学习任务一】盐类水解的应用
混施化肥
泡沫
灭火剂
制备胶体
明矾净水
判断溶液
酸碱性
离子浓度
比较
试剂贮存
盐溶液
的蒸发
溶液配制
盐类水解
的应用
【学习任务一】盐类水解的应用
问题1:为什么用热水配制CuCl2溶液,溶液会出现浑浊?怎样配制澄清溶液?
CuCl2+2H2O Cu(OH)2+2HCl ΔH>0 Cu2++2H2O Cu(OH)2+2H+ ΔH>0
配制CuCl2溶液,为防止出现浑浊,应加少量的_______
稀盐酸
[应用1]设计物质水溶液的配制方法
凡配制能水解的盐溶液时,通常需采取防水解措施。
①配制强酸弱碱盐溶液:滴几滴相应的强酸,可使水解平衡向左移动,抑制弱碱阳离子的水解。如配制FeCl3的水溶液:FeCl3溶于水时会发生水解反应Fe3++3H2O Fe(OH)3+3H+,通常先将FeCl3固体溶于较浓盐酸中,抑制Fe3+的水解,使溶液保持澄清,再加水稀释至所需浓度。
②配制强碱弱酸盐溶液:加入少量相应的强碱,可抑制弱酸根离子水解。如配制硫化钠的水溶液时,可加入少量氢氧化钠,抑制S2-的水解。
【学习任务一】盐类水解的应用
问题2:盛放Na2S、Na2CO3的试剂瓶为什么不能用玻璃塞?NaF溶液能否用玻璃瓶?
CO32- + H2O HCO3- + OH-
F- + H2O HF + OH-
注意:实验室贮存碱性溶液的试剂瓶一律使用橡胶塞
注意:NaF溶液一般盛放在塑料容器中!
[应用2]选择试剂的保存方法
某些实验试剂贮存时要考虑到盐的水解。如Na2SO3溶液因水解使溶液呈碱性,OH-与玻璃的主要成分SiO2反应生成硅酸盐,使试剂瓶颈与瓶塞黏结,因而不能用带磨口玻璃塞的试剂瓶贮存,可用带橡胶塞或软木塞的试剂瓶保存。
FeCl2 :加少量稀盐酸和铁屑
抑制Fe2+的水解
防止Fe2+被氧化
【学习任务一】盐类水解的应用
问题3:化肥的使用——草木灰不能和铵态氮肥混合使用,为什么?
铵态氮肥——铵盐,水解呈酸性
NH4++H2O NH3·H2O+ H+,
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
混施后,OH-与H+中和成水,使两种盐的水解平衡强烈地向右移动,以至生成大量的NH3·H2O,会导致NH3·H2O分解生成NH3逸出了,从而降低了肥效。
[应用3]某些化肥的混合施用
草木灰不能与铵态氮肥混用,因草木灰的主要成分为K2CO3,溶于水时
NH3+H2O,使氮肥肥效下降。
【学习任务一】盐类水解的应用
问题4:为了除去氯化镁酸性溶液中的Fe3+离子,可在加热搅拌下加入一种试剂,过滤后再加入适量盐酸。这种试剂是( )
A.氧化镁 B.氢氧化钠 C.碳酸钠 D.碳酸镁
AD
Fe3+ + 3H2O Fe(OH)3 + 3H+
如: MgCl2溶液中混有FeCl3杂质
Mg2+ + 2H2O Mg(OH)2 + 2H+
① 加入Mg(OH)2
② 加入MgO
③ 加入MgCO3
④ 加入Mg
不引入新杂质!
(主)
(次)
[应用4]利用盐的水解去除杂质
如果两种离子的水解程度不一样,可通过调控溶液的pH将其中一种离子转化为氢氧化物沉淀而除去。
思考:除去CuCl2溶液中的FeCl3用什么试剂?
CuO、Cu(OH)2、CuCO3等
【学习任务一】盐类水解的应用
[应用5]判断蒸干盐溶液所得固体的成分
盐溶液 水解方程式 酸挥发性 蒸干所得固体
AlCl3
Al2(SO4)3
AlCl3+3H2O Al(OH)3+3HCl
易
Al(OH)3
Al2(SO4)3+6H2O 2Al(OH)3+3H2SO4
难
Al2(SO4)3
规
律
弱碱易挥发性酸盐
蒸干灼烧
氧化物固体
弱碱难挥发性酸盐
蒸干灼烧
同溶质固体
AlCl3溶液
蒸干
Al(OH)3
灼烧
Al2O3
MgCl2· 6H2O
△
Mg(OH)2
△
MgO
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
【学习任务一】盐类水解的应用
[应用5]判断蒸干盐溶液所得固体的成分
考虑盐受热是否分解
如1:Ca(HCO3)2
蒸干
CaCO3
灼烧
CaO
如2:NaHCO3;KMnO4;
蒸干并灼烧
Na2CO3;K2MnO4和MnO2
如3:NH4Cl
蒸干并灼烧:
无固体
有时要多方面考虑:
CuSO4溶液加热得CuSO4·5H2O;蒸干得CuSO4
如4:易被氧化的盐,蒸干得氧化产物;
Na2SO3蒸干得Na2SO4;FeSO4蒸干得Fe2(SO4)3
【学习任务一】盐类水解的应用
[应用6]解释生产和生活这中的某些事实
(1)FeCl3、KAl(SO4)2·12H2O等可作净水剂
Al3+ + 3H2O Al(OH)3 (胶体) + 3H+
Fe3+ + 3H2O Fe(OH)3 (胶体) + 3H+
(2)热的纯碱液去油污效果好
加热能促进纯碱Na2CO3水解,产生的c(OH-)较大,而油污中的油脂在碱性较强的条件下水解更完全。
(3)在NH4Cl溶液中加入Mg粉,为何有H2放出
NH4++H2O NH3·H2O+H+
Mg+2H+= Mg2++H2↑
Mg+2NH4+=Mg2++2NH3↑+H2↑
(4)泡沫灭火器反应原理
Al2(SO4)3和NaHCO3溶液
【学习任务一】盐类水解的应用
Al3+ + 3HCO3- =Al(OH)3↓+ 3CO2↑
生成的CO2将胶状Al(OH)3吹出可形成泡沫。
混合前
混合后
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
速度快
耗盐少
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
K(H2CO3)a1=4.4×10-7
K(Al(OH)3)b=5.1×10-9
为什么CH3COONH4不彻底水解?
【学习任务一】盐类水解的应用
例1:相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、NaHCO3、NaClO、CH3COONa、Na2SO4、NaOH、(NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为:
pH: NaOH>Na2CO3>NaClO>NaHCO3 >CH3COONa>Na2SO4 >(NH4)2SO4>NaHSO4
[应用7]判断盐溶液的酸碱性
酸性:HCO3-<HClO<H2CO3<CH3COOH
1、温度相同、浓度均为0.1mol/L的
①(NH4)2SO4 ②NaNO3 ③NH4HSO4 ④NH4NO3 ⑤CH3COONa溶液,它们的pH值由小到大的排列顺序是
A. ③①④②⑤ B. ①③⑤④② C. ③②①⑤④ D. ⑤ ②④①③
A
2、比较相同pH值的 ①Na2CO3 ②CH3COONa ③NaClO三种稀溶液物质的量浓度大小顺序 。
②>③>①
【学习任务一】盐类水解的应用
3.室温下,物质的量浓度相同的下列溶液,按pH由小到大的顺序排列的是
A.Na2CO3、NaHCO3、NaCl、NH4Cl
B.Na2CO3、NaHCO3、NH4Cl、NaCl
C.(NH4)2SO4、NH4Cl、NaNO3、Na2S
D.NH4Cl、(NH4)2SO4、Na2S、NaNO3
解析:的水解程度大于的,pH:Na2CO3>NaHCO3,故选项A、B不符合要求;水解使NH4Cl溶液、(NH4)2SO4溶液显酸性,相同物质的量浓度时,(NH4)2SO4溶液中浓度大于NH4Cl溶液中浓度,则pH:(NH4)2SO4
破题思路
【学习任务一】盐类水解的应用
[应用8]比较盐溶液中离子种类的多少
将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子种类最多的是
A. KCl B. Na3PO4 C. Na2CO3 D. MgSO4
B
[应用9]判定离子能否大量共存:
(1)不完全双水解:两离子水解相互促进,但仍部分水解,可逆的,阴阳离子仍能在溶液中大量共存,如NH4+与S2-、HCO3-、CO32-、CH3COO-
(2)完全双水解:水解进行完全,用“ = ”、“↑”“↓”。阴阳离子不能在溶液中大量共存
①Al3+与AlO2-、CO32-、HCO3-、HS-、S2-、ClO-、SiO32-
② Fe3+与 AlO2-、CO32-、HCO3-
③ NH4+与 SiO32-、AlO2-
说明:(Fe3+与S2-、HS-)主要发生氧化还原反应
Al3+与 AlO2-
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3+ 与 HCO3-
Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al3+与CO32-
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3+与S2-
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
【学习任务一】盐类水解的应用
典例:在氯化铁溶液中存在下列水解平衡:FeCl3+3H2O Fe(OH)3+3HCl ΔH>0
回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,得到的一种红褐色透明液体为 。
(2)在配制FeCl3溶液时,为防止浑浊,应加入 。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
解析 (1)加热FeCl3溶液得到的红褐色透明液体为Fe(OH)3胶体。
(2)为防止浑浊,应加入盐酸抑制FeCl3水解。
(3)CO32-与Fe3+发生相互促进的水解反应,生成的Fe(OH)3可过滤除去。
Fe(OH)3胶体
少许盐酸
MgCO3能与H+反应,促进了Fe3+的水解,使Fe3+转化为Fe(OH)3沉淀而被除去
【学习任务一】盐类水解的应用
离子浓度
比较
